短小芽孢杆菌(Bacillus pumilus)糖基转移酶基因的克隆、序列分析及表达
2012-12-23王秋艳蓝袁洋李海峰张亚丽黄黎锋
王秋艳,蓝袁洋,李海峰,张亚丽,黄黎锋
(杭州师范大学生物医药与健康中心,浙江 杭州 311121)
短小芽孢杆菌(Bacillus pumilus)糖基转移酶基因的克隆、序列分析及表达
王秋艳,蓝袁洋,李海峰,张亚丽,黄黎锋
(杭州师范大学生物医药与健康中心,浙江 杭州 311121)
为获得具有催化活性的糖基转移酶纯酶,本研究以短小芽孢杆菌基因组DNA为模板,利用简并PCR技术扩增到基因(GT-A)全长序列.该序列全长1 287bp、编码423个氨基酸,分子量约为49.2KD.经序列分析,该基因属于糖基转移酶基因.根据GT-A 基因开放阅读框序列设计引物,构建了原核表达重组质粒GTA-pet28a,并在大肠杆菌BL21(DE3)中成功诱导出了一个约50kD的融合蛋白.纯化后测定其糖基转移酶活性,与37℃相比,80℃的反应温度其活性能提高3.4倍左右.研究结果表明,该酶是一种具有应用潜力的嗜高温糖基转移酶.
短小芽孢杆菌;原核表达;糖基转移酶
糖基转移酶(EC 2.4.x.y)是自然界存在的最为多样性的一大类酶,糖基转移酶负责将活性供体的单糖部分转移至糖、蛋白质、脂类、核酸以及另外一些小分子,即完成糖基化反应,形成具有很多生物学功能的糖基化产物[1-2].糖基转移酶在所有生命体中都扮演着重要的生物学角色,日益引起人们的重视.蛋白质的糖基化修饰和天然糖蛋白的去糖基化是研究糖蛋白糖链结构和功能的重要手段之一.其中糖基转移酶是该反应中的有用工具.已纯化的糖基转移酶是目前糖基化工程中的重要酶,为研究糖蛋白糖链的结构与功能的关系以及细胞表面糖基化修饰提供了极好的方法[3-5].目前对这些酶的研究还处于起步阶段,纯化的酶种类依然很少.本实验利用PCR技术从短小芽孢杆菌中克隆了糖基转移酶基因,构建了原核表达重组质粒,在大肠杆菌中诱导表达,纯化后测定其活性,为利用糖基转移酶进行活性产物改造提供了有利条件.
1 材料与方法
1.1 材料
实验所用短小芽孢杆菌为本实验室分离培养所得,DH5а,BL21(DE3)感受态为实验室自制,限制性内切酶,T4连接酶,Taq DNA聚合酶,琼脂糖凝胶回收试剂盒,PMD-19Teasy购于大连宝生物工程公司
(TaKaRa Biotechnology),Pet28a质粒、质粒提取试剂盒购自 Novagen,对硝基苯基-α-D-吡喃葡萄糖苷购于百灵威科技有限公司.
1.2 方法
1.2.1 糖基转移酶基因(GT-A)的克隆测序
根据GenBank中Bacillus pumilus基因组序列,设计引物Bp-as TATCCTAAACACCTCCTTGAA,Bp-aRs GAACAACATATTGATTCCCTCT,扩增条件:94 ℃ 10min;94 ℃30s,50 ℃ 45s,72℃90s,30个循环;72℃10min.PCR产物经1.0%琼脂糖凝胶电泳检测,目的片段切胶回收,与PMD-19Teasy连接,转化DH5а感受态细胞,蓝白斑筛选,利用通用引物M13进行菌落PCR验证,阳性克隆送上海生工测序.1.2.2 重组糖基转移酶基因表达载体的构建
根据测出的糖基转移酶序列开放阅读框设计引物,上游引物为Bba-bds:ccgGaattccggatggtggctgatgtttta(下划线为EcoRI位点),下游引物为Bba-bdRs:ccgCtcgagcggtcacccgcttttcttttg(下划线为xhoI位点),扩增条件:94℃10min;94℃30s,50℃45s,72℃90s,30个循环;72℃10min.将目的片段1.0%琼脂糖凝胶电泳检测回收并与PMD-19Teasy载体连接,连接产物转化DH5а感受态细胞,蓝白斑筛选,用通用引物M13进行菌落PCR验证.
将阳性菌落转接过夜培养,利用质粒提取试剂盒提取阳性重组质粒GTA-T.分别用EcoRI和xhoI双酶切重组质粒GTA-T和质粒pet28a(Novagen),琼脂糖凝胶电泳回收酶切片段,按照质粒DNA与目的基因用量比1∶3,用T4连接酶进行连接,连接产物转化DH5а感受态细胞,在卡那霉素抗性平板上筛选转化子,随机挑取克隆菌落PCR鉴定,并测序验证.将测序正确的阳性克隆过夜摇菌,并提取重组质粒GTA-pet28a.
1.2.3 重组糖基转移酶基因在大肠杆菌中的诱导表达
经鉴定的阳性GTA-pet28a重组质粒转化到BL21(DE3)中,挑取单菌落到含有50ng/μL卡那霉素的LB液体培养基中,37℃,180rpm/min培养过夜,1%接种至新鲜LB培养基中,37℃培养至菌体光密度值OD600≈0.6~0.8,加入IPTG至终浓度为1mM/L,28℃150rpm/min继续培养5h后,取1mL菌液,5 000r/min离心10min,去除上清,用pH7.4PBS将沉淀重新悬浮5 000r/min离心10min,收集菌体,用20μLPBS重悬浮,并加入20μL 2×SDS凝胶加样缓冲液后震荡悬浮,煮沸10min后进行SDS-PAGE蛋白电泳分析.
1.2.4糖基转移酶基因(GT-A),酶活测定
GT-A粗酶液,经过低温Ni-NTA 柱纯化、透析,得到纯酶液.在300μL pH7.0的磷酸缓冲液中,加入纯化的GTA酶液100μL,1g/L对硝基苯基-α-D-吡喃葡萄糖苷200μL为底物,分别在37℃、80℃下保存0(空白对照)、10、20、60min.之后在波长405nm处测吸光值.
2 结果与分析
2.1 糖基转移酶基因(GT-A)的PCR扩增
提取短小芽孢杆菌的基因组DNA为模板.采用引物Bp-as/BpaRs,扩增出一条约1.2kb大小的DNA片段.如图1所示.回收PCR产物与载体PMD-19Teasy连接,转化DH5а感受态细胞,在含有IPTG(40mg/mL)和 X-gal(20mg/mL)的氨卞抗生素(100μg/mL)的LB平板上进行37℃过夜培养.
2.2 糖基转移酶基因(GT-A)的序列分析
随机挑取糖基转移酶的阳性克隆,对插入片段进行测序,结果如图2所示.序列含有一个完整的开放阅读框,编码423个氨基酸,分子量约为49.2kD.等电点约为9.361.其中含187个疏水性氨基酸96个极性偏中性氨基酸47个碱性氨基酸和35个酸性氨基酸.测序结果用BLAST进行比对,GT-A蛋白与来源于芽孢杆菌糖基转移酶蛋白(SAFR-032)同源性为72%、(QM B1551)同源性65%、(DSM319)同源性62%.由此可见,GT-A蛋白为一种新型糖基转移酶.
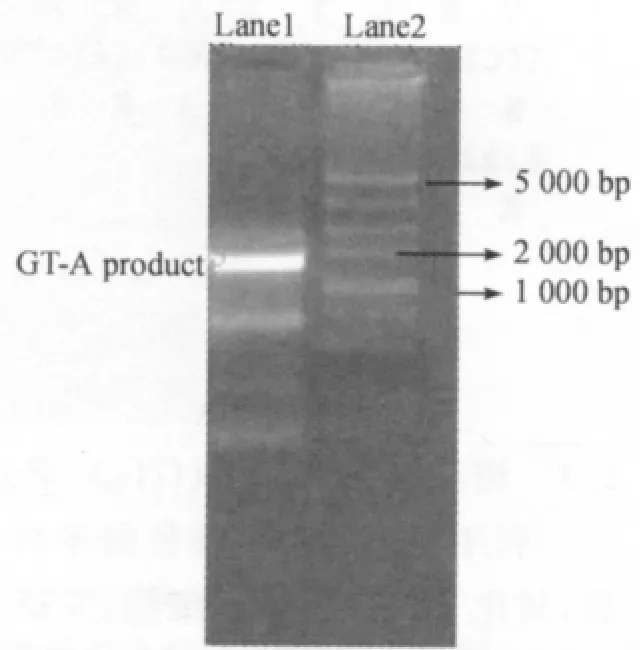
注:lane1,糖基转移酶基因增产物;lane2,DNA标准分子量Note:lane1,PCR product of glycosyltransferase;Lane 2,DNA marker

图2 核酸和氨基酸序列结果Fig.2 Nucleotide sequence and deduced amino acid sequence
2.3 糖基转移酶基因(GT-A)表达载体构建
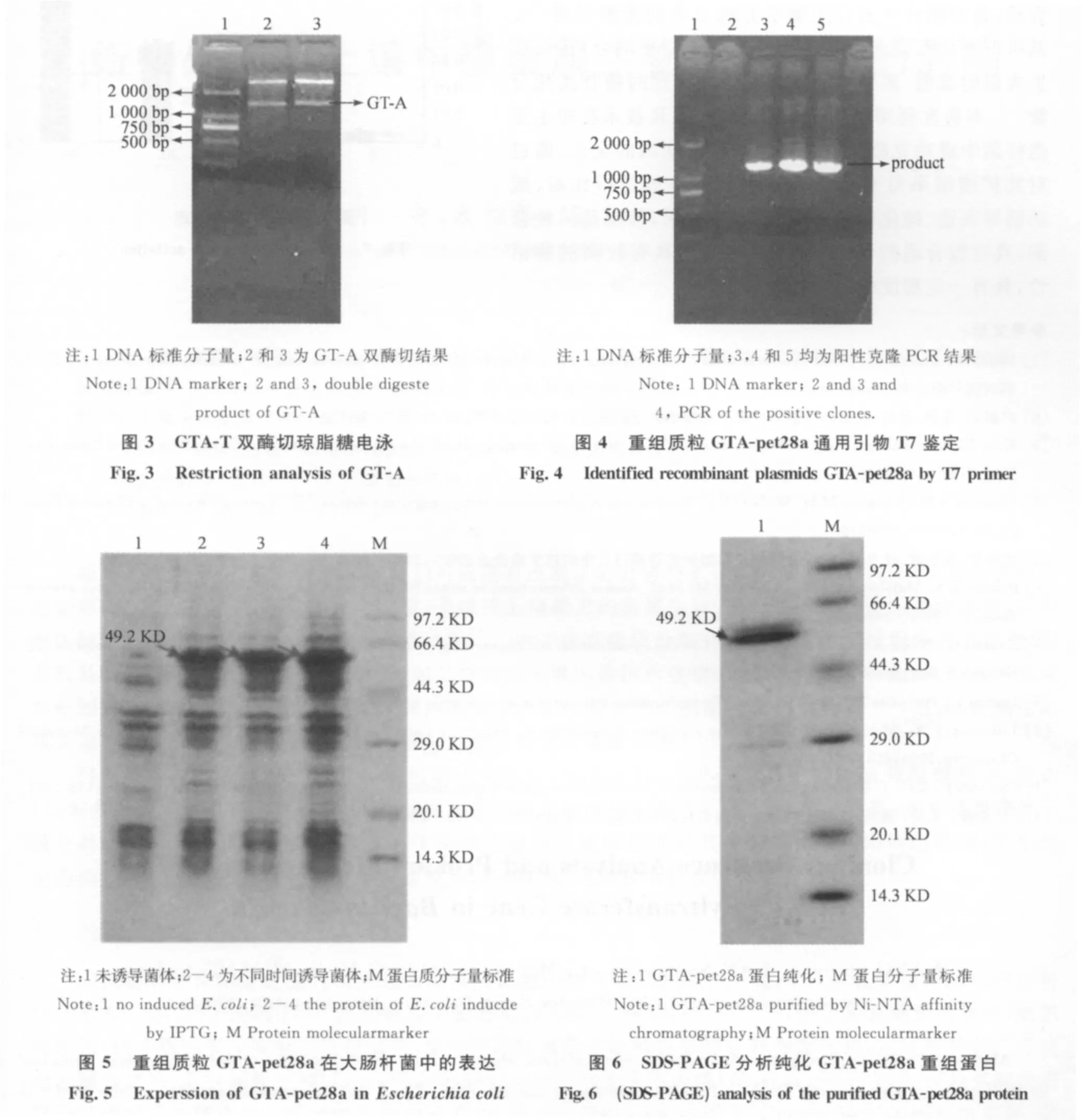
利用测出的糖基转移酶序列,设计表达引物,两端引入酶切位点,将扩增产物与PMD-19Teasy连接后,转化DH5а感受态细胞,并挑取阳性克隆放大培养,提取GTA-T阳性重组质粒.GTA-T阳性重组质粒EcoRI与XhoI双酶切结果如图3所示,将GTA-T双酶切产物回收与同样酶切的pet28a连接转化DH5а,利用通用引物T7鉴定阳性重组质粒GTA-pet28a,如图4所示.鉴定为阳性菌的重新提取重组质粒GTA-pet28a,转化到BL21(DE3)感受态中,挑阳性克隆培养.
2.4 糖基转移酶基因(GT-A)的诱导表达
含有GTA-pet28a的BL21(DE3)工程菌,在氨苄LB培养基中过夜培养.按1/1 000转接到新的氨苄LB培养基中,在 OD值达到0.6~0.8之间,加入1.0mM IPTG,不同时间6、8、10h诱导后,SDS-PAGE胶电泳,考马斯亮蓝染色后,在大约50KD处有一明显的特异蛋白条带.通过对GT-A酶进行不同时间段的诱导,我们可以看出8h之前没有明显表达量的差距,在10h诱导之后,可以得到相对较好的表达量(图5).根据PET-28a载体所带的6xHis标签特性,利用Ni-NTA纯化GTA粗酶液,经过SDS-PAGE胶鉴定,可以在50KD处有一条明显特异性条带(图6),使GT-A得到了一定程度的纯化.为我们下一步进行活性测定奠定了基础.
2.5 糖基转移酶基因(GT-A)的酶活测定
取纯化GTA酶液,以硝基苯基-α-D-吡喃葡萄糖苷为底物,在80℃随着反应时间的增长,产物增多,与37℃下的活性相比,提高了约3.4倍(图7).可以判断此糖基转移酶为嗜热酶,在高温下有较好的活性.
3 结 论
糖基是许多功能性化合物如碱性黄酮、抗生素等的重要组成部分[6-9],糖基转移酶参与糖苷类化合物生物合成,是对糖分子进行生物学方法改造的重要对象[10].其可以催化不同的糖基与特定的受体分子结合,从而产生大量的寡糖、多聚糖和其它结构多样性的糖苷类化合物[11].本研究利用引物简并性,运用PCR技术在短小芽孢杆菌中成功克隆到一个糖基转移酶基因的全长.通过对其扩增结果与GenBank上的标准序列进行比对、成功诱导表达、纯化和活性测定,结果表明,该酶是一种新酶,具有较合适的诱导条件、在高温下具有较高的酶活性,具有一定程度的应用特性.
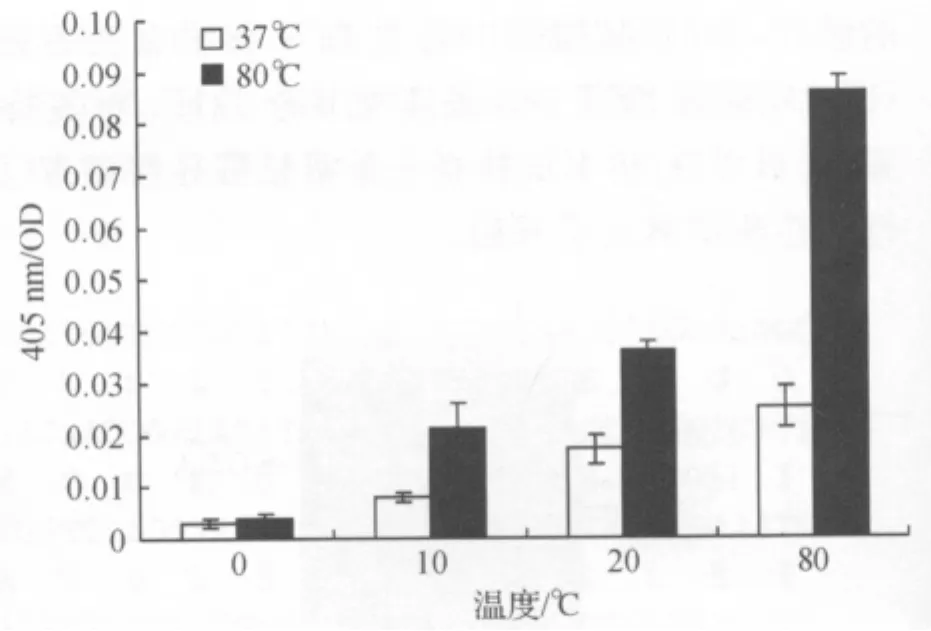
图7 GT-A酶活测定Fig.7 Detection of GT-A activites
[1]Faijes M,Planas A.In vitro synthesis of artificial polysaccharides by glycosidases and glycosynthases[J].Carbohydrate Research,2007,342(12/13):1581-1594.
[2]卢丽丽,肖敏,赵晗.具有转糖基活性的糖苷酶的分子进化[J].生命的化学,2007,27(1):45-48.
[3]Kren V,MartínkováL.Glycosides in medicine:“The role of glycosidic residue in biological activity”[J].Current Medicinal Chemistry,2001,8(11):1303-1328.
[4]Hancock S M,Vaughan M D,Withers S G.Engineering of glycosidases and glycosyltransferases[J].Current Opinion in Chemical Biology,2006,10(5):509-519.
[5]代焕琴,王浩鑫,沈月毛.抗生素糖基转移酶研究进展[J].中国抗生素杂志,2007,32(5):257-262.
[6]Palomo E S,Hidalgo M,Gonzalez-Vinas M,etal.Aroma enhancement in wines from different grape varieties using exogenous glycosidases[J].Food Chemistry,2005,92(4):627-635.
[7]Sianidis G,Wohlert S E,Pozidis C,etal.Cloning,purification and characterization of a functional anthracycline glycosyltransferase[J].Journal of Biotechnology,2006,125(3):425-433.
[8]Lairson L,Henrissat B,Davies G,etal.Glycosyltransferases:structures,functions,and mechanisms[J].Biochemistry,2008,77(1):521.
[9]Luzhetskyy A,Mendez C,Salas J A,etal.Glycosyltransferases,important tools for drug design[J].Current Topics in Medicinal Chemistry,2008,8(8):680-709.
[10]Stanley P,Ioffe E.Glycosyltransferase mutants:key to new insights in glycobiology[J].The FASEB Journal,1995,9(14):1436-1444.
[11]吴佳茜,王旻,陈代杰.糖基转移酶定向进化研究进展[J].生命科学,2009(3):388-393.
Cloning,Sequence Analysis and Prokaryotic Expression of the Glycosyltransferase Gene inBacilluspumilus
WANG Qiu-yan,LAN Yuan-yang,LI Hai-feng,ZHANG Ya-li,HUANG Li-feng
(Center for Biomedicine and Health,Hangzhou Normal University,Hangzhou 311121,China)
To get purified glycosyltransferase with catalytic ability,a full length sequence ofGT-Agene was amplified by PCR reaction with genomic DNA inBacillus pumilusas the template.The 1 287bp sequence encoded a protein of 423 amino acid with molecular weight of about 49.2kD.Sequence analysis implied that the gene was a glycosyltransferase gene.Prokaryotic recombinant expression vectorGTA-pet28awas constructed based on the ORF (open reading frame)of the glycosyltransferase gene and was expressed in Escherichia coli BL21(DE3).A recombinant protein of about 50kD was produced in the inducible expression system.The activity of the enzyme at 80℃ was 3.4times higher than that at 37℃.The results show that the glycosyltransferase is a thermophilic enzyme with potential applications.
Bacilluspumilus;prokaryotic expression;glycosyltransferase
Q75
A
1674-232X(2012)04-0364-05
11.3969/j.issn.1674-232X.2012.04.015
2011-12-12
杭州市科技局科研项目(KH10365;20090231T06).
黄黎锋(1979—),男,副研究员,博士,主要从事分子生物学与酶学研究.E-mail:huang@hznu.edu.cn
