4种兜兰RubisCO的分离纯化及酶学性质初步研究
2012-11-14陈立思闻真珍蔡继业曾伟达刘运权
陈立思, 闻真珍, 蔡继业, 曾伟达, 刘运权, 王 曼, 刘 伟*
(1.华南农业大学生命科学学院,广东广州 510642; 2.广州花卉研究中心,广东广州 510360)
4种兜兰RubisCO的分离纯化及酶学性质初步研究
陈立思1,2, 闻真珍1, 蔡继业1, 曾伟达2, 刘运权1, 王 曼1, 刘 伟1*
(1.华南农业大学生命科学学院,广东广州 510642; 2.广州花卉研究中心,广东广州 510360)
采用硫酸铵沉淀、阴离子交换层析与凝胶过滤层析的方法,分离纯化得到硬叶(Paphiopedilummicranthum)、紫纹(P.purpurattum)、带叶(P.hirsutissimum)和亨利(P.henryanum)4种兜兰RubisCO的大、小亚基,相对分子量分别为51.5×103~54.5×103和15.0×103~16.0×103. 4种兜兰RubisCO的羧化/加氧活性在pH8.0、温度30 ℃时最高,其活性大小顺序为硬叶兜兰>紫纹兜兰>亨利兜兰>带叶兜兰,且紫纹兜兰、亨利兜兰的羧化/加氧活性比值相对高于硬叶兜兰、带叶兜兰;硬叶兜兰RubisCO的Km(RuBP)值最小.4种兜兰RubisCO的特性反映了其不同的生理和生境特征.
兜兰(Paphiopedilum); RubisCO; 分离纯化; 酶学性质
核酮糖-1,5-二磷酸羧化酶/加氧酶( E.C.4.1.1.39)(简称RubisCO)存在于叶绿体基质中,是所有光合生物进行光合碳同化的关键性酶[1].目前,已经从多种植物中分离纯化了RubisCO,但有关兜兰RubisCO的研究却未见报道.兜兰属(Paphiopedilum)是兰科(Orchidaceae)植物中最具特色的一个类群,得名于其呈兜状的唇瓣,具有较高的观赏和研究价值.由于野生兜兰受到掠夺性采挖和贸易,导致数量急剧减少甚至灭绝.对野生兜兰进行有效保护是一个亟待解决的问题,而对其光合作用关键酶RubisCO的研究可为研究其光合作用特性提供基础,并能为其保护和栽培提供理论支持.
不同兜兰对光照的要求不同,其光合作用特性也不同.本论文从硬叶、紫纹、带叶和亨利4种兜兰(Paphiopedilum)中分离纯化RubisCO,并对该酶的部分特性进行研究,为认识兜兰的光合作用特性,提高栽培效率提供依据.
1 材料和方法
1.1 材料
实验材料硬叶兜兰(P.micranthum)、紫纹兜兰(P.purpurattum)、带叶兜兰(P.hirsutissimum)和亨利兜兰(P.henryanum)均为原生种,由华南农业大学植物化控研究室提供.栽培条件为湿度60%以上,温室有风机水帘降温,棚顶覆盖二层遮阳网.
1.2 RubisCO的分离纯化
取生长良好、浓绿色的兜兰叶片,洗净,晾干.称取15~20 g,加入预冷的酶提取液(50 mmol/L pH 8.0 Tris-HCl,1 mmol/L EDTA,20 mmol/L MgCl2,0.5%的Gly,0.6% β-巯基乙醇,10 mmol/L的抗坏血酸,1% PVP,酶提取液的体积数/叶片质量数=1/5)和少量石英砂,捣碎成匀浆,4层纱布过滤.得到的粗酶液经饱和 (NH4)2SO4分段盐析、Sephadex G-25换盐、DEAE纤维素阴离子交换柱层析(0~4 ℃)、Sephadex G-200 凝胶过滤纯化.
1.3 酶活性测定
RubisCO羧化活性的测定参照Racker的分光光度计法[2],在最适的反应条件下,每分钟催化1 μmol CO2所需要的酶量定义为1个酶活单位(U). 加氧活性的测定方法为氧电极法[3].
1.4 蛋白纯度检测和分子量确定
参照赵永芳等介绍的方法[4],采用不连续垂直板状非变性聚丙烯酰胺凝胶电泳(Native-PAGE)检测蛋白纯度.利用SDS-PAGE测定亚基的分子量大小,根据标准蛋白质分子量(Protein low molecular marker,TAKARA)的对数和泳动率呈线性关系而求出未知蛋白质的分子量,其中泳动率=(蛋白质迁移的距离/染料移动的距离)×(染色前凝胶的长度/脱色后凝胶的长度).
1.5 蛋白含量测定
采用考马斯亮蓝G-250染色法,用牛血清蛋白(BSA)做标准蛋白.
1.6 酶动力学参数
RubisCO对底物二磷酸核酮糖(RuBP)的Km和Vmax测定方法采用双倒数作图法[4].
2 结果与分析
2.1 RubisCO的分离纯化
粗酶液经用体积分数为30%~50%的硫酸铵分段盐析-DEAE阴离子交换(0.3 mol/L NaCl洗脱)-Sephadex G-200凝胶过滤的流程纯化后,得到了纯度达到85%以上的RubisCO酶蛋白(图1),纯化倍数均达到5倍以上(表1).
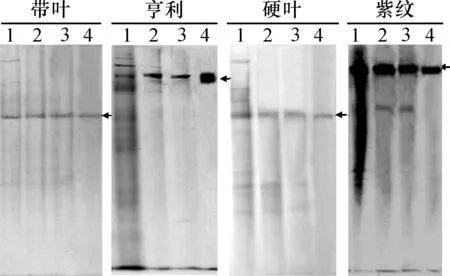
1:粗酶液;2:硫酸铵沉淀后酶液;3:阴离子交换后酶液;4:凝胶过滤后酶液

表1 4种兜兰RubisCO的纯化Table 1 Purification of RubisCO from 4 species of Paphiopedilum
2.2 RubisCO亚基分子量确定
SDS-PAGE电泳检测结果表明,4种兜兰RubisCO的大、小亚基分别位于标准相对分子量蛋白66.4×103~44.3×103之间和20.1×103~14.3×103之间(图2A).根据标准蛋白质相对分子量的对数与泳动率之间的线性关系(图2B),计算出各种兜兰RubisCO大、小亚基的相对分子量,范围为51.5×103~54.5×103和15×103~16×103(图2A),与已报道的RubisCO的大、小亚基相对分子量范围一致[5].
2.3 酶学性质
硬叶和紫纹2种斑叶类兜兰RubisCO的羧化活性和加氧活性显著高于带叶和亨利2种绿叶兜兰,亨利兜兰和紫纹兜兰的羧化/加氧值则显著高于带叶兜兰和硬叶兜兰(表2).
4种兜兰RubisCO对底物RuBP羧化活性的分析结果见表2,硬叶兜兰RubisCO的Km值最小,对底物RuBP的亲和力最高,带叶兜兰RubisCO的Km值最大,对底物RuBP的亲和力最低;紫纹兜兰RubisCO的Vmax/Km值最大,说明其对底物的专一性最强.
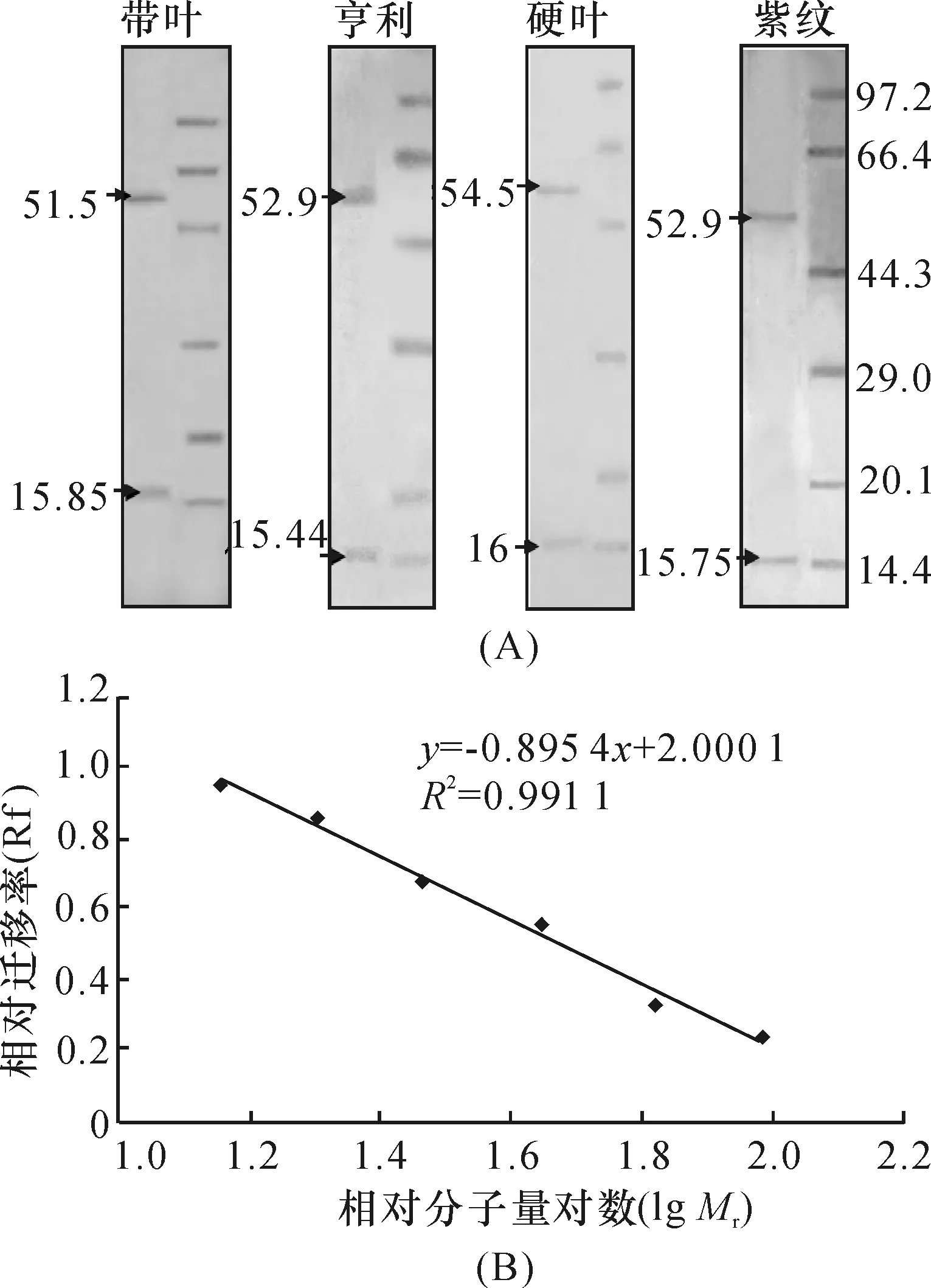
图2 RubisCO大、小亚基分子量的确定
2.4 酶稳定性
在30 ℃时,4种兜兰RubisCO羧化活性均最大,除带叶兜兰外,其它3种兜兰的羧化活性在温度小于25 ℃和大于30 ℃时下降明显(图3A);在pH 8测得的羧化活性最大,在pH 6,几乎检测不到RubisCO的羧化活性,此时接近RubisCO等电点,RubisCO解离为大亚基核L8和游离小亚基[6];在pH 3~5时,RubisCO羧化活性重新增加,其增幅小于pH 7~9的增幅值(图3B).以上结果表明带叶兜兰RubisCO的热稳定性最强,另外3种兜兰的热稳定性无明显差异.而硬叶和紫纹兜兰的活性受pH影响的程度大于亨利和带叶兜兰.

图3 4种兜兰RubisCO的温度(A)和pH(B)稳定性
3 讨论
RubisCO是植物可溶蛋白中含量最高的蛋白,达到50%左右. SUREZ等[7]利用阴离子交换的方法从小麦中分离纯化的RubisCO纯度高于96%,回收率高于75%,目前缺乏兜兰RubisCO分离纯化的报道.本研究参照其它植物RubisCO的分离纯化方法,针对兜兰叶片多糖、酚类物质含量高的特点,在提取液中加入PVP去除多糖;并利用阴离子交换和凝胶过滤的方法,从4种兜兰中成功分离到了RubisCO.相比前述小麦RubisCO的分离纯化,整个过程耗时较长,回收率较低(35%~42%),但得到的RubisCO纯度达85%以上,适用于酶学性质的进一步研究.
RubisCO具有双重功能:在CO2分压高时, 使二磷酸核酮糖(RuBP)羧化, 产生2分子的3-磷酸甘油酸(PGA),推动C3 碳循环;在O2分压高时,产生1分子的PGA和1分子的磷酸乙醇酸而引起C2氧化循环及光呼吸,即酶的氧化活性.在酶动力学参数上,Km(RuBP)和Vmax的大小可以反映RubisCO羧化/氧化能力的高低.4种兜兰RubisCO对底物RuBP的Km值,大小依次为带叶兜兰(1.26 mmol/L)>亨利兜兰(1.19 mmol/L)>紫纹兜兰(0.94 mmol/L)>硬叶兜兰(0.93 mmol/L),4种兜兰Km值之间没有显著性差异,但与陈根云[4]提供的参考值20~25 μmol/L相比,RubisCO对底物RuBP的Km值增加,说明兜兰RubisCO对底物RuBP的亲和能力不高,与兜兰属植物光合速率低相符合[8].而斑叶类兜兰紫纹和硬叶的Vmax值显著高于绿叶类兜兰带叶和亨利,Vmax与CO2固定速率有关,说明斑叶类兜兰对CO2的固定速率高于绿叶类兜兰.
与Km值对应的4种兜兰RubisCO的羧化/加氧活性比值依次为硬叶兜兰>紫纹兜兰>亨利兜兰>带叶兜兰,结合其形态和生境特征,斑叶类兜兰高于绿叶类兜兰,斑叶类兜兰生长在碱性土中,Km高于酸性土中的绿叶类兜兰.CO2浓度是RubisCO活性的关键限制因素[9],紫纹兜兰和亨利兜兰的羧化/加氧值相对高于硬叶兜兰和带叶兜兰,说明二者在高浓度CO2的环境下能更好地进行光合作用,这与前述2类兜兰Vmax之间的差异一致.4种兜兰RubisCO的羧化活性、羧化/加氧活性比都低于水稻和小麦等作物,阴生环境下的兜兰的光合作用能力较低,可能与其对生长环境的适应有关.
植物RubisCO在体内的最大活性温度多为20~30 ℃,而在体外失活温度为50 ℃以上[10].本研究中4种兜兰的RubisCO在pH 8、叶温30 ℃时羧化活性最大,对应空气温度25 ℃,为其最适生长温度.在pH为3~5的时候,4种兜兰RubisCO羧化活性重新回到一个小的高峰,此时对应紫纹兜兰最适生长环境的pH值(4.1~5.1)[11];带叶兜兰与紫纹兜兰同属酸性土壤类型,其RubisCO在pH 5时达到最大羧化活性.
以上研究说明,4种兜兰的RubisCO特性反映了其不同的生境和生理特征.兜兰具有极高的观赏价值,在栽培过程中缺乏生理特性研究,以致目前无法实现规模化生产;另一方面,市场的需求导致野生兜兰资源的过度挖掘,广东等野生兜兰分布区中一些品种已经濒临灭绝[12].因此,从生产和植物保护两方面来说,对兜兰光合生理等特性的了解是为提高栽培技术和采取有效保护措施的理论前提,本研究对4种兜兰RubisCO的研究将为进一步了解各兜兰的生理特征和光合特性,指导栽培管理提供理论基础.
[1] 潘瑞炽,王小菁,李娘辉.植物生理学[M]. 5版.北京:高等教育出版社,2004:89-91.
[2] RACKER E. Ribulose diphosphate carboxylase from spinach leaves[C]∥COLOWICK S P, KAPLAN N O. Methods in Enzymology, North Holland:Elsevier,1962: 266-278.
[3] 陈根云. 现代植物生理学实验指导[M]. 北京:科学出版社,1999:113-116.
[4] 赵永芳.生物化学技术原理及其应用[M]. 2版.武汉:武汉大学出版社,1994:51-59.
[5] WHITNEY S M, HOUTZ R L, ALONSO H. Advancing our understanding and capacity to engineer nature’s CO2-Sequestering enzyme, RubisCO[J]. Plant Physiol, 2011, 155:27-35.
[6] 李立人, 缪有刚.光合作用关键酶核酮糖二磷酸羧化酶/加氧酶[J]. 植物生物技术,1998,5(4): 2-26.
[8] CHANG W, ZHANG S B, LI S Y, et al. Ecophysiological significance of leaf traits inCypripediumandPaphiopedilum[J]. Physiol Plant, 2011,141:30-39.
[9] SAVIR Y, NOOR E, MILO R, et al. Cross-species analysis traces adaptation of RubisCO toward optimality in a low-dimensional landscape[J]. PNAS, 2010, 107(8):3475-3480.
[10] KUMAR A, LI C, PORTIS J A.Arabidopsisthalianaexpressing a thermostable chimeric RubisCO activase exhitbis enhanced growth and higher rates of photosynthesis at moderately high temperatures[J]. Photosynth Res, 2009, 100:143-153.
[11] 刘仲健,张建勇,茹正忠,等.兰科紫纹兜兰的保育生物学研究[J].生物多样性,2004,12 (5): 509- 516.
[12] 刘浩,阮作庆,徐颂军,等.广东古兜山自然保护区资源植物的现状及其保护[J].华南师范大学学报:自然科学版,2006(4):106-112.
PrimaryStudyontheIsolationandEnzymaticPropertiesofRubisCOfromFourSpeciesofPaphiopedilum
CHEN Lisi1,2, WEN Zhenzhen1, CAI Jiye1, ZENG Weida2, LIU Yunquan1, WANG Man1, LIU Wei1*
(1.College of Life Sciences, South China Agricultural University, Guangzhou 510642, China;2. Guangzhou Flower Research Center, Guangzhou 510360, China)
RubisCOs were isolated and purified fromPaphiopedilummicranthum,P.purpurattum,P.hirsutissimumandP.henryanumby (NH4)2SO4precipitation, anion exchange and gel filtration chromatography in succession. The molecular weights of their large and small subunits were 51.5×103~54.5×103and 15.0×103~16.0×103, respectively. Their zymologic characters were further studied. The results showed that these four RubisCOs from differentPaphiopedilumhad the highest activity at pH 8.0 and 30 ℃, and the descending order of RuBPcase/oase activity wasP.micranthum,P.purpurattum,P.henryanumandP.hirsutissimum, and the RuBPcase/oase activity ratio ofP.purpurattumandP.henryanumwere higher than that ofP.micranthumandP.hirsutissimum. TheKm(RuBP) value ofP.Micranthum’sRubisCO is the lowest in the fourPaphiopedilumspecies, which indicated that its affinity to RuBP is the highest. The physiological and habitat characteristics of the four differentPaphiopedilumwere reflected by properties of RubisCOs isolated from them, which provided a basis for further investigation of their photosynthetic physiology.
2012-04-25
广东省农业科技计划项目(2008-810);广东省科技计划项目(2008B02040006)
*通讯作者,liuwei@scau.edu.cn
1000-5463(2012)03-0112-04
Q55
A
10.6054/j.jscnun.2012.06.024
Keywords:Paphiopedilum; RubisCO; isolation; enzymatic properties
【责任编辑 成 文】
