树突状细胞DNA多价疫苗抗日本血吸虫感染作用机制的研究*
2012-11-13
血吸虫病是一种流行广泛、严重危害人体健康并影响畜牧业生产的人兽共患寄生虫病。作为吡喹酮化疗的补充,血吸虫病疫苗的研究是一种更有效的控制措施。血吸虫病疫苗的研究已有半个多世纪,历经死疫苗、减弱活疫苗、基因工程疫苗和核酸疫苗四个阶段。尽管血吸虫病疫苗的研究工作已取得一定的进展,但离实际应用尚有一定的距离,增强DNA疫苗的免疫效果便成为当前血吸虫病疫苗研究的焦点,有必要进一步加强对血吸虫的生物学特性、血吸虫与宿主的相互关系以及混合抗原、细胞免疫、疫苗免疫方法、免疫途径、佐剂应用等基础方面的研究[1]。
树突状细胞(DC)是体内功能最强的一种专职抗原提呈细胞,在机体免疫应答中起着核心作用。由于其独特的功能,DC目前广泛应用于抗感染、肿瘤、自身免疫病和移植免疫等[2-3]。作者此前已成功地将Sj26、Sj23和Sj14基因分别转染至小鼠DC,并在DC中得到稳定表达,联合免疫具有明显的协同或增强作用,本研究在此基础上对其保护性免疫机制进行了探讨。
1 材料与方法
1.1 材料 DC细胞株MTSC4(北京医科大学免疫学系陈慰峰教授惠赠),常规方法培养传代;BALB/c小鼠,6~8周龄、雌性(武汉市生物制品研究所);小鼠白细胞介素-4(IL-4)和干扰素-γ(IFN-γ)检测试剂盒(英国BD Biosciences Pharmingen公司);噻唑蓝MTT(美国Invitrogen公司);二甲基亚砜(DMSO,美国Sigma公司);HRP标记羊抗鼠IgG(美国Bio-Rad公司);RPMI-1640培养液(美国Gibco公司);胎牛血清(FCS,杭州四季青公司)。
1.2 方法
1.2.1Sj26基因转染 DC、Sj23基因转染 DC、Sj14基因转染DC、pcDNA3转染DC的制备与培养 参照文献[4]制备,按常规方法培养传代。
1.2.2 动物免疫 BALB/c小鼠随机分为7组,每组12只。A组为Sj26、Sj23、Sj14基因转染DC,B组为Sj26基因转染DC,C组为Sj23基因转染DC,D组为Sj14基因转染DC,E组为空质粒pcDNA3转染DC,F组为未处理DC,G组为RPMI-1640对照组。免疫前用RPMI-1640培养液洗涤细胞2次,0.25%胰蛋白酶分别消化各组DC,调细胞浓度为1×106/mL。A-F组,每只小鼠分别经耳廓注射0.2 mL细胞悬液,G 组注射0.2mL RPMI-1640培养液。共免疫3次,间隔2w。末次免疫后第2w,每鼠经皮肤感染40条日本血吸虫尾蚴。
1.2.3 血清特异性IgG抗体检测 收集初次免疫前、末次免疫后第2w以及攻击感染后第6周各组小鼠血清,ELISA法检测特异性IgG抗体。可溶性虫卵抗原(SEA)以10mg/mL包被酶标板,待测血清稀释度为1∶100,HRP标记羊抗鼠IgG工作浓度为1∶1000,底物为邻苯二胺,终止反应后用酶标仪测定吸光度(A491)值。
1.2.4 血清细胞因子IFN-γ和IL-4检测 按照IFN-γ和IL-4检测试剂盒操作说明书,ELISA法分别检测初次免疫前和末次免疫后第2w小鼠血清细胞因子水平。待测血清稀释度为1∶10,酶标仪测定吸光度(A450)值。根据同一酶标板上的标准曲线,计算待测样品中相应的细胞因子水平。
1.2.5 IFN-γ和IL-4的诱生及检测 攻击感染后第6w,无菌取小鼠脾脏,常规法制备脾淋巴细胞悬液。以含10%胎牛血清的RPMI-1640培养液调细胞浓度为5×106/mL,加至24孔细胞培养板中,1 mL/孔,每份样本设3孔,分别加入RPMI-1640培养液、SEA(10μg/mL)和 ConA(5μg/mL),37℃、5%CO2培养箱中孵育72h,14 000×g离心10min,收集上清液。双夹心ELISA法检测小鼠脾淋巴细胞诱生的IFN-γ和IL-4水平。
1.2.6 脾淋巴细胞增殖试验 将脾淋巴细胞加至96孔细胞培养板中,细胞数为2×105,200μL/孔,分别加入SEA(10μg/mL)和ConA(5μg/mL),同时设立 RPMI-1640培养液阴性对照,37℃、5%CO2培养箱中孵育72h,终止培养前,每孔加入MTT 10μL,混匀后继续培养6h。吸去上清,加入DMSO 100μL/孔,振荡以充分溶解甲肷产物,酶标仪测定吸光度(A560)值。按公式计算刺激指数(SI),SI=刺激孔A560均值/对照孔A560均值。
1.2.7 统计分析 用SAS软件包对数据进行ANOVA检验和t检验。
2 结 果
2.1 血清特异性IgG抗体水平 末次免疫后第2 w,A-D组小鼠血清特异性IgG抗体水平较免疫前显著升高,且明显高于E和F组(P<0.05)。感染后第6w,各组小鼠血清抗体水平差异无统计学意义(表1)。
2.2 血清IFN-γ水平 免疫后,A-D组小鼠IFN-γ水平较免疫前明显增高(P<0.01),且明显高于E和F组(P<0.01)(表2)。

表2 各组小鼠血清IFN-γ水平的比较Tab.2 Comparison of IFN-γlevels in sera from each group of mice
2.3 血清IL-4水平 免疫前、后各组小鼠血清IL-4水平差异无统计学意义(表3)。
2.4 脾淋巴细胞IFN-γ的诱生 A-D组小鼠脾淋巴细胞经ConA和SEA刺激诱生的IFN-γ水平显著高于G组(P<0.001),E和F组在ConA和SEA刺激下产生的IFN-γ水平与G组相比,差异均无统计学意义(表4)。
2.5 脾淋巴细胞IL-4的诱生 A-D组小鼠脾淋巴细胞经ConA和SEA刺激诱生的IL-4水平明显低于G组(P<0.001),E和F组在ConA和SEA刺激下产生的IL-4水平与G组相比,差异均无统计学意义(表5)。
2.6 脾淋巴细胞刺激指数 小鼠脾淋巴细胞经ConA和SEA刺激后的刺激指数,A-D组明显高于G组(P<0.001),E和F组的刺激指数与G组相比,差异均无统计学意义(表6)。

表3 各组小鼠血清IL-4水平的比较Tab.3 Comparison of IL-4levels in sera from each group of mice
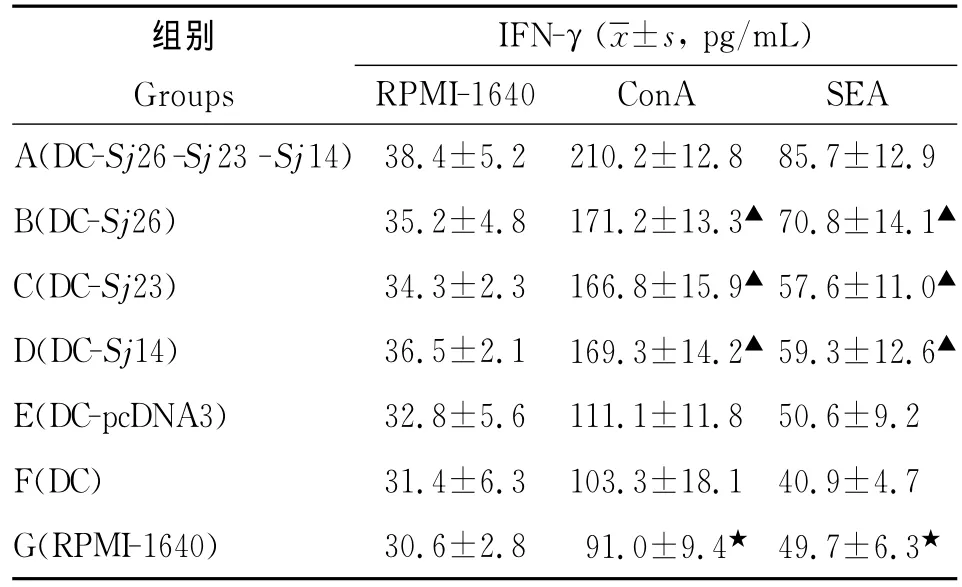
表4 各组小鼠脾淋巴细胞IFN-γ的诱生Tab.4 IFN-γresponses of spleen lymphocytes from each group of mice
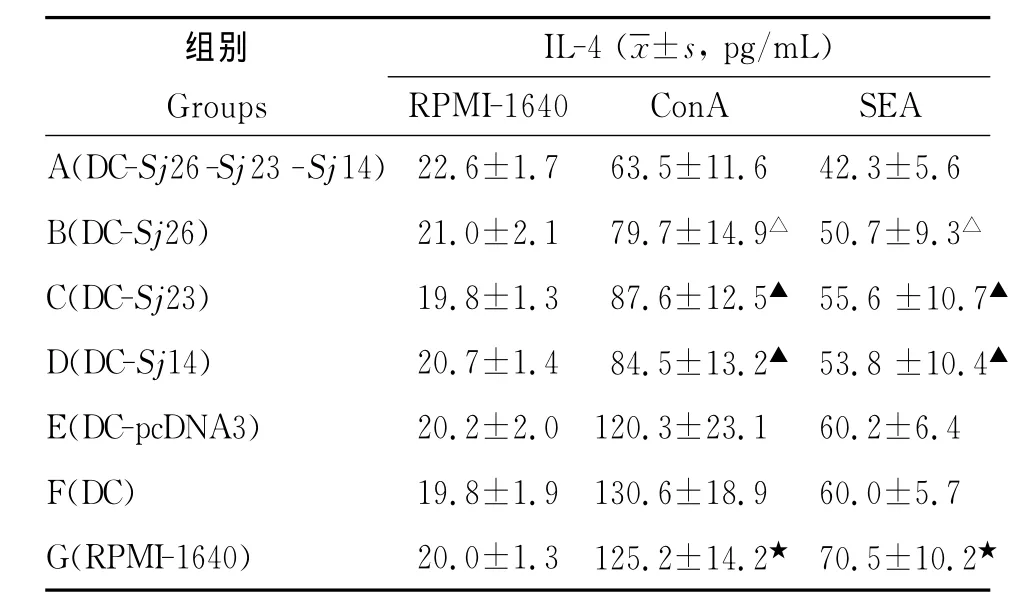
表5 各组小鼠脾淋巴细胞IL-4的诱生Tab.5 IL-4responses of spleen lymphocytes from each group of mice

表6 各组小鼠脾淋巴细胞刺激指数Tab.6 Stimulating index of spleen lymphocytes from each group of mice
3 讨 论
日本血吸虫病疫苗候选抗原可分为7大类,酶性抗原(谷胱甘肽S转移酶、磷酸丙糖异构酶)、肌球蛋白抗原(副肌球蛋白)、膜相关蛋白(Sj23)、钙相关蛋白(脂肪酸结合蛋白、钙蛋白酶、钙网蛋白)、线粒体相关蛋白、性别相关蛋白、信号蛋白(Sj14-3-3)等[5]。迄今为止,单价抗感染疫苗候选分子诱导的保护力很少超过50%,究其因,一是由于血吸虫感染后保护性免疫机制复杂多样,包括体液免疫和细胞免疫,并有其它细胞和补体等的参与,不同的抗原分子诱导的保护性免疫机制不同,而不同虫期的保护性抗原的特异性亦不同,人们对于血吸虫感染后的免疫机制目前尚不完全清楚;其二是血吸虫是一种多细胞生物,且生活史复杂,抗原成分多样,由于血吸虫与宿主在长期共进化过程中,产生了多种免疫逃避机制,使得疫苗的研制未能获得理想效果;其三是由于DNA疫苗免疫原性较弱,对CD+8T细胞和CD+4T细胞的刺激作用均较弱[6]。
多价DNA疫苗可增加有效的抗原决定簇数量,模拟血吸虫自然感染,能刺激机体产生更多的保护性抗体和激活更多效应T细胞,获得较好的免疫效果。DC是体内功能最强的抗原提呈细胞,在刺激免疫反应中起着核心作用,能刺激T淋巴细胞,尤其是初始T细胞。尽管DNA疫苗仅能直接转染较小一部分的DC,但是实验研究发现在引流淋巴结中的所有DC均能被广泛激活,从而为效应T细胞的活化提供了最佳条件,DNA疫苗若能以DC为载体可望获得良好的免疫效果[7]。因此,寻找新的疫苗候选分子、联合一种或几种有效抗原分子制成混合多价疫苗、结合佐剂的应用等提高疫苗分子的免疫效果的研究,是当前血吸虫病疫苗研究的主攻方向[8]。
研究证实,机体抗血吸虫感染的保护性免疫与Th1型细胞介导的免疫应答有关,发展以Th1型优势免疫应答为主的疫苗,将是高效血吸虫病疫苗研制的关键。本研究结果表明体液免疫和细胞免疫共同参与了DC DNA混合多价疫苗诱导的保护性免疫作用,DC DNA混合多价疫苗诱导的抗日本血吸虫感染的保护性免疫,与小鼠Th1型免疫应答的增强有关,为血吸虫病疫苗的研究打下了基础。
[1]Li YL.Human Parasitology[M].Beijing:People's Medical Publishing House,2004:114-126.(in Chinese)李雍龙.人体寄生虫学[M].北京:人民卫生出版社,2004:114-126.
[2]Turtle CJ,Hart DN.Dendritic cells in tumor immunology and immunotherapy[J].Curr Drug Targets,2004,5(1):17-39.DOI:10.2174/1389450043490640
[3]Morel PA,Feili-Hariri M,Coates PT,et al.Dendritic cells,T cell tolerance and therapy of adverse immune reactions[J].Clin Exp Immunol,2003,133(1):1-10.DOI:10.1046/j.1365-2249.2003.02161.x
[4]Shen DW,Luo JP,Li YL.Study on immune effect ofSj26andSj23 gene transferred dendritic cells againstSchistosomajaponicum[J].Chin J Publ Health,2008,24(10):1216-1217.(in Chinese)沈定文,罗金萍,李雍龙.基因转染树突状细胞联合免疫抗血吸虫感染作用[J].中国公共卫生,2008,24(10):1216-1217.
[5]Xu NW,Tian Z,Wang SP.Advances in the study ofSchistosoma japonicumDNA vaccines[J].J Pathog Biol,2010,5(10):786-789.DOI:CNKI:SUN:ZISC.0.2010-10-022(in Chinese)徐妮为,田智,汪世平.日本血吸虫病DNA疫苗的研究进展[J].中国病原生物学杂志,2010,5(10):786-789.DOI:CNKI:SUN:ZISC.0.2010-10-022
[6]Cernescu C.Nucleic acid vaccines[J].Rom J Virol,1995,46(1-2):69-73.
[7]Akbari O,Panjwani N,Garcia S,et al.DNA vaccination:transfection and activation of dendritic cells as key events for immunity[J].J Exp Med,1999,189(1):169-178.DOI:10.1084/jem.189.1.169
[8]Wang SP,Chen XC,Gao DM.Research progress on schistosome vaccine and prospect of its application in China[J].Chin J Parasitol Parasit Dis,2009,27(5):402-411.DOI:CNKI:SUN:ZJSB.0.2009-05-009 (in Chinese)汪世平,陈秀春,高冬梅.我国血吸虫疫苗研究进展及应用前景[J].中国寄生虫学与寄生虫病杂志,2009,27(5):402-411.DOI:CNKI:SUN:ZJSB.0.2009-05-009
