高效液相色谱法测定桃红促孕合剂中芍药苷的含量
2012-11-13张颖王伟丽朱明伟
张颖 王伟丽 朱明伟
河南省商丘市食品药品检验所,河南商丘 476000
高效液相色谱法测定桃红促孕合剂中芍药苷的含量
张颖 王伟丽 朱明伟
河南省商丘市食品药品检验所,河南商丘 476000
目的建立桃红促孕合剂的质量标准。方法色谱条件Agilent-C18色谱柱,流动相:乙腈-0.1%磷酸溶液(14∶86),流速:1.0 mL/min,波长:230 nm。结果芍药苷在0.308 2~6.164 0μg的范围内,有良好的线性关系,r=0.999 9,平均回收率为98.79%,RSD为0.96%。结论建立了桃红促孕合剂的质量标准,该方法操作易行,稳定可靠,可用于桃红促孕合剂中芍药苷的含量测定及该制剂的质量控制。
桃红促孕合剂;芍药苷;高效液相色谱法
桃红促孕合剂是经批准生产的医院中药制剂[1](豫药制字Z04140004),有补肾化瘀、理气和血之功效。经过多年的应用证明用于调节垂体卵巢功能,促成熟卵破裂排卵,治疗月经不调,无排卵性不孕症的功效显著。其处方由赤芍、熟地黄、赤芍、丹参、桃仁、红花等十味药组成,现行质量标准不能有效地控制药品质量。根据药效和处方确定赤芍为方中主要药味,而芍药苷是赤芍的有效成分之一,为了进一步提高该制剂标准,笔者采用HPLC法对处方中的芍药苷进行了含量测定。
1 仪器与试药
1.1 仪器
Agilent1260 HPLC;Agilent-C18(150 mm×4.6 mm,5μm)色谱柱,AUW-220D电子天平(上海方瑞仪器厂)。
1.2 试药
桃红促孕合剂(商丘市柘城县人民医院提供,批号:110409、110520、110525)。芍药苷对照品(中国药品生物制品检定所提供,批号:110736-201035)。高效液相色谱所用试剂均为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件[2]
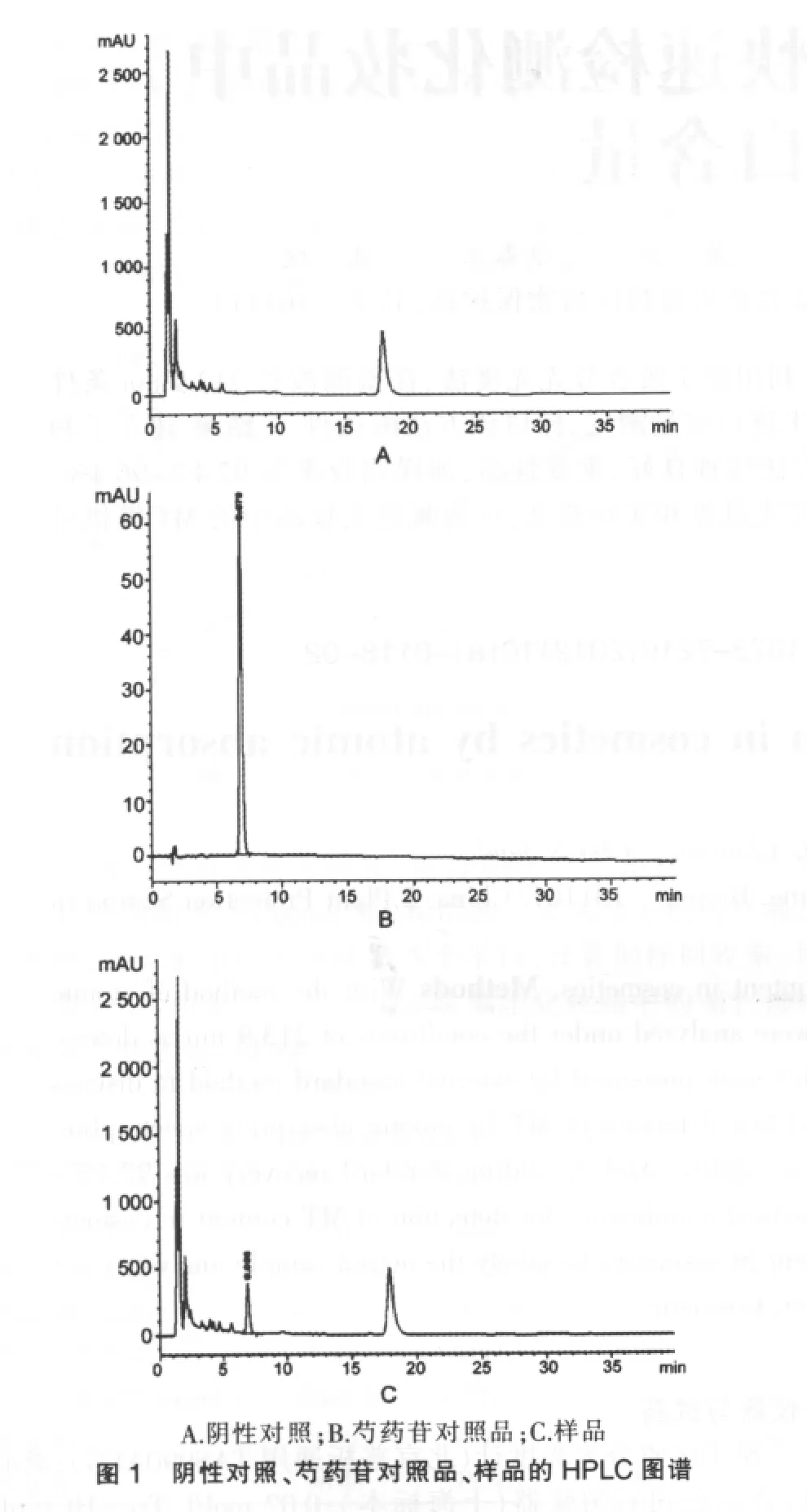
流动相:乙腈-0.1%磷酸溶液(14∶86),检测波长:230 nm,柱温:35℃,流速:1.0mL/min,进样量:10μL。理论塔板数按芍药苷峰计算应不低于2 000。
2.2 对照品溶液和供试品溶液的制备
2.2.1 对照品溶液的制备精密称取芍药苷对照品适量,置量瓶中,加稀乙醇制成每毫升含30.82μg的对照品溶液。
2.2.2 供试品溶液的制备取供试品5支,混匀,精密量取5mL,置于50mL量瓶中,加稀乙醇35mL,振摇提取,并加稀乙醇至刻度,滤过,取续滤液,即得供试品溶液。
2.3 线性关系考察
吸取对照品溶液(30.82μg/mL)1.0、5.0、7.5、10.0、15.0、20.0μL进样,芍药苷的保留时间为6.68min,以芍药苷峰面积对进样量进行回归,芍药苷的回归曲线Y=94.803X+2.865,r=0.999 9,芍药苷在0.308 2~6.164 0μg线性范围内线性关系良好。
2.4 阴性干扰试验
除赤芍外,其他各药味均正常投料制成阴性缺赤芍对照品,然后制成阴性供试品溶液。同法检测,在与芍药苷对照品色谱峰相应的位置上,供试品有相同保留时间的色谱峰,而阴性对照溶液在此位置上没有。见图1。
2.5 精密度考察
取同一供试品溶液(批号:110520)测定6次,测定峰面积,结果RSD=0.84%。
2.6 重复性考察
精密称取(批号:110520)样品,制备供试品溶液6份,进样,测定。结果平均含量为1.032mg/mL,RSD=1.13%。
2.7 稳定性考察
取供试品溶液(批号:110520),进样(0、1、2、4、8、12 h),按上述色谱条件测定峰面积积分值。计算结果,RSD=0.77%。
2.8 加样回收率考察
精密量取已知含量的样品6份(批号:110520),精密加入同一浓度(0.195 4 mg/mL)对照品,照上述方法制备,按上述色谱条件进样10μL,测定,计算,平均回收率为98.79%,RSD为0.96%,结果见表1。
2.9 含量测定
按上述含量测定方法测定样品中芍药苷含量。结果见表2。
3 讨论
本研究以超声提取、振摇提取,回流提取为不同提取方法,同时处理30 min、1 h后,进行检测[3-6],回流、超声和振摇30min和1 h的提取效果基本相似,说明处理30min时样品中的芍药苷已经被提取完全。而回流、超声和振摇30min芍药苷含量分别为2.241、2.202、2.235mg/mL,提取结果相近,考虑到实际操作过程的可操作性,本实验采取了振摇提取的提取方法。

表1 加样回收实验

表2 样品中芍药苷的含量
桃红促孕合剂是临床实践证明疗效良好的医院制剂,但该药的质量控制方法仅有薄层鉴别,考虑到赤芍是桃红促孕合剂的主药,本实验用HPLC法对该制剂中芍药苷的含量进行测定,建立了该制剂的质量控制方法。该方法能够准确并快速地控制该制剂的质量,可用于桃红促孕合剂中芍药苷的含量测定。
[1]河南省医疗机构制剂标准.豫药制字:Z04140004[Z].
[2]国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:96.
[3]凌明,马安宇.HPLC测定胃肠合剂中芍药苷和黄芩苷的含量[J].中成药,2008,30(9):1311-1113.
[4]陈晓燕,李顺祥.HPLC法测定阿归养血糖浆中芍药苷含量[J].中医药导报,2009,15(3):81-83.
[5]刘洁.反相高效液相色谱法测定白芍提取物中芍药苷的含量[J].时珍国医国药,2010,21(9):125.
[6]张建业,冯向东.HPLC法同时测定八珍益母丸中芍药苷和甘草酸铵的含量[J].中国药师,2011,14(7):992.
Determ ination of Paeoniflori in Taohongcuyun M ixture by HPLC
ZHANG Ying WANGWeili ZHU Mingwei
Shangqiu Institute for Food and Drug Control,He′nan Province,Shangqiu,476000,China
ObjectiveTo establish a standard for determination of Paeoniflori in Taohongcuyun Mixture.MethodsChromatographic colum was Agilent-C18,themobile phase was acetonitrile-0.1%phosphoric acid solution(14∶86),the flow ratewas1.0mL/min,the detection wavelength was 230 nm.ResultsThe linear range of Paeonifloriwas 0.308 2-6.164 0μg, r=0.999 9.The average recovery of Paeonifloriwas 98.79%and RSD was 0.96%.ConclusionThemethod is simple,sensitive and accurte,and can be used to determine Paeoniflori in Taohongcuyun Mixture and quality control of Taohongcuyun Mixture.
Taohongcuyun Mixture;Paeoniflori;HPLC
R927.2
A
1673-7210(2012)10(a)-0116-02
张颖(1972-),女,本科,副主任药师,从事药品检验及制剂质量标准研究。
2012-04-16 本文编辑:卫轲)
