生脉饮对TNF-α诱导的大鼠心肌成纤维细胞胶原合成的影响
2012-11-11王敬春
王敬春 徐 波 张 春
1.齐齐哈尔医学院药学系,黑龙江齐齐哈尔 161006;2.齐齐哈尔卫生学校药学教研室,黑龙江齐齐哈尔 161005
生脉饮对TNF-α诱导的大鼠心肌成纤维细胞胶原合成的影响
王敬春1徐 波2张 春1
1.齐齐哈尔医学院药学系,黑龙江齐齐哈尔 161006;2.齐齐哈尔卫生学校药学教研室,黑龙江齐齐哈尔 161005
目的 探讨生脉饮对肿瘤坏死因子 (tumor necrosis factorα,TNF-α)诱导的新生大鼠心肌成纤维细胞(cardiac fibroblasts,CFs)胶原合成的影响及其机制。 方法 用不同浓度生脉饮载药血清与TNF-α处理体外培养的CFs,采用分光光度法检测细胞培养上清液中羟脯氨酸含量,采用实时定量RT-PCR检测MMP1和TIMP1mRNA的表达水平。 结果TNF-α处理组羟脯氨酸含量较空白对照组明显升高;与TNF-α组比较,生脉饮口服液血清中羟脯氨酸含量降低。与空白对照组比较,TNF-α组MMP1和TIMP1mRNA表达上调;生脉饮载药血清组MMP1较TNF-α组显著升高,而TIPM1显著降低,差异有统计学意义(均P<0.05),并呈浓度依赖性。 结论 生脉饮对TNF-α诱导的CFs胶原合成具有抑制作用,下调MMP1和上调TIPM1mRNA表达可能是其作用的机制之一。
心肌纤维化;生脉饮;肿瘤坏死因子;胶原合成
心肌纤维化(myocardial fibrosis,MF)是指在正常心肌组织中胶原纤维过量积聚或胶原成分发生改变,阻止或逆转纤维化是延缓心力衰竭、减少心律失常发生的重要手段[1]。MF受多种因素调控,其中胶原代谢调节酶基质金属蛋白酶(matrixmetalloproteinases,MMPs)和基质金属蛋白酶组织抑制剂(tissue inhibitor ofmetalloproteinases,TIMPs)的平衡失调引起的胶原合成增加、降解减少是主要的因素[2]。心肌成纤维细胞(cardiac fibroblasts,CFs)在MF的发生发展过程中起重要作用,MF时CFs增殖并分泌大量胶原蛋白[3]。根据MF特性,中医学可将心肌间质纤维化归属于“心痹”范畴,病情发展可逐步导致“心悸”、“喘证”、“水肿”等[4]。目前现代医学对MF没有确切的治疗手段,中医药干预能从多环节、多靶点发挥作用,具有一定的优势[5]。生脉饮是中医益气养阴、益心复脉的著名古方,出自金元时期张元素所著的《医学启源》。本实验旨在探讨生脉饮对TNF-α诱导的CFs胶原合成的影响及其机制,为临床用药提供可靠依据。
1 仪器与试药
1.1 实验动物
新生1~3 d Wistar大鼠由齐齐哈尔医学院实验动物中心提供。
1.2 药品与试剂
生脉饮购自北京同仁堂科技发展股份有限公司(国药准字:Z11020363);精制胎牛血清购自江海生物高新技术开发有限责任公司;DMEM培养基购自Gibco公司;TNF-α购自北京白鹭园生物技术有限公司;Trizol RNA提取试剂购自美国 Invitrogen公司;Prime Script RT reagent Kit逆转录与SYBR Premix Ex Taq TMⅡ试剂盒购自日本TaKaRa公司。参照GenBank数据库,采用Primer primer 5.0计算机软件设计引物,由Takara公司合成。基因序列如下:MMP1(扩增片段长度 100 bp),Forward Primer为 5′-TTC AGC CAG GCC CAG GTA-3′,Reverse Primer为 5′-TGA GCA GCC ACA CGA TAC AAG T-3′;TIMP1 (扩增片段长度 82 bp),Forward Primer为5′-GAG AAG GGC TAC CAG AGC GA-3′,Reverse Primer为5′-TCG AGA CCCCAA GGTATTGC-3′;GAPDH(扩增片段长度 134 bp),Forward Primer为 5′-TGG TCTACA TGTTCCAGT ATG ACT-3′,Reverse Primer为 5′-CCA TTT GAT GTT AGC GGG ATC TC-3′。羟脯氨酸试剂盒购自南京建成生物公司。
1.3 仪器
2700 型PCR System扩增仪为Applied Biosystems公司产品,ABI 7300荧光定量PCR仪为美国ABI公司产品,UV-2550型紫外分光光度计为日本岛津产品。
2 方法与结果
2.1 方法
2.1.1 载药血清的制备 取SD大鼠,随机分为两组,即空白对照组及生脉饮组,每组5只。上述两组大鼠依次分别按生理盐水 2mL/只和生脉饮 3mL/(kg·d)灌服(相当于正常人临床剂量的6倍)。每日1次,连续7 d。于第7天上午末次灌服后2 h腹主动脉取血。4℃离心取上清,同组血清混合,56℃水浴灭活 30min,-20℃冻存。
2.1.2 CFs分离和培养 无菌条件下开胸取出仔鼠心脏,PBS漂洗,剪成约1mm3碎块。加入0.25%胰蛋白酶于37℃消化10 min,用含20%胎牛血清的DMEM终止消化,加Hanks液离心收集细胞。所得细胞用培养液悬浮,分种于25 cm2塑料培养瓶中,根据CFs贴壁速度快的原理,采用差速贴壁法5%CO2培养箱内培养90min,弃上清液,贴壁细胞即CFs。待CFs生长接近融合时传代,实验采用3~5代细胞。
2.1.3 实验分组及处理 实验分空白对照组、TNF-α组、TNF-α+空白血清组、TNF-α+5%载药血清组、TNF-α+10%载药血清组、TNF-α+20%载药血清组。细胞经0.125%胰蛋白酶消化后接种于多聚赖氨酸包被的96孔板上,接种密度为1×105细胞/mL,培养24 h后换无血清培养液同步驯化24 h。空白对照组给予等体积培养基,TNF-α组给予50 ng/mL TNF-α,TNF-α+空白血清组给予含空白对照大鼠血清的DMEM添加50 ng/mL TNF-α,各浓度的生脉饮+TNF-α处理组分别给予含5%、10%或20%的生脉饮载药血清的DMEM同时添加TNF-α50 ng/mL。共孵育24 h后,收集细胞。
2.1.4 羟脯氨酸测定 将CFs以4×104细胞/mL的浓度接种于6孔板中。药物处理24 h后,收集各组细胞上清液,严格按照试剂盒说明书进行操作。上清液羟脯氨酸含量(mg/L)=(测定管吸光度值-空白管吸光度值)/(标准管吸光度值-上空白管吸光度值)×标准管浓度。
2.1.5 实时定量PCR检测 实时定量PCR检测CFs MMP1和TIMP1mRNA表达。用Trizol试剂抽提细胞总RNA,取2μg RNA逆转录合成cDNA。Real-time PCR反应体系扩增条件为:95℃ 10 s,然后 95℃ 5 s,60℃ 31 s,进行 40 个循环。数据采用 2-ΔΔCt相对定量法分析。
2.1.6 统计学方法 采用统计软件SPSS 11.5对实验数据进行分析,计量资料数据以均数±标准差()表示,采用单因素方差分析,组间差异用SNK-q检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2.2 结果
2.2.1 羟脯氨酸测定 羟脯氨酸含量测定结果显示,空白对照组CFs培养上清液中羟脯氨酸含量较低,经50 ng/mLTNF-α刺激24 h后,羟脯氨酸含量较空白对照组明显升高(P<0.05),表明TNF-α具有促进胶原蛋白合成作用。经过各浓度的生脉饮载药血清处理,CFs培养上清中羟脯氨酸含量较TNF-α组明显减少,并呈浓度依赖性(均P<0.05)。见表1。
表1 生脉饮载药血清对TNF-α诱导的CFs羟脯氨酸含量的影响(,n=6)
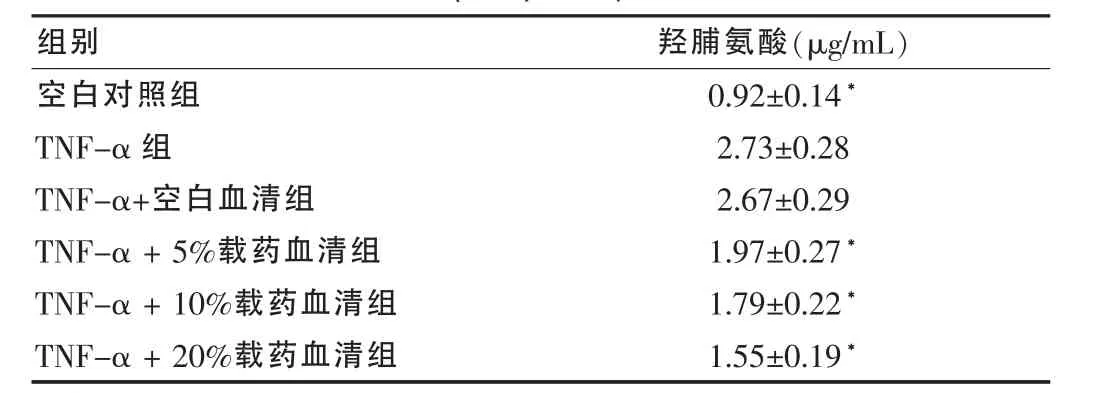
表1 生脉饮载药血清对TNF-α诱导的CFs羟脯氨酸含量的影响(,n=6)
注:与 TNF-α组比较,*P<0.05
组别 羟脯氨酸(μg/mL)空白对照组TNF-α组TNF-α+空白血清组TNF-α+5%载药血清组TNF-α+10%载药血清组TNF-α+20%载药血清组0.92±0.14*2.73±0.28 2.67±0.29 1.97±0.27*1.79±0.22*1.55±0.19*
2.2.2 生脉饮载药血清对CFs MMP1 mRNA表达的影响 MMP1 mRNA在空白对照组CFs中呈低表达,经50 ng/mL TNF-α刺激24 h后,MMP1表达代偿性增加,与空白对照组比较,差异有统计学意义(P<0.05)。同时,经过3个浓度生脉饮载药血清处理后,CFs TIMP1 mRNA表达较TNF-α组明显升高,呈浓度依赖性(均P<0.05)。见表2。
表2 生脉饮载药血清对TNF-α诱导的CFs MMP1和TIMP1基因表达的影响(,2-ΔΔCt,n=5)
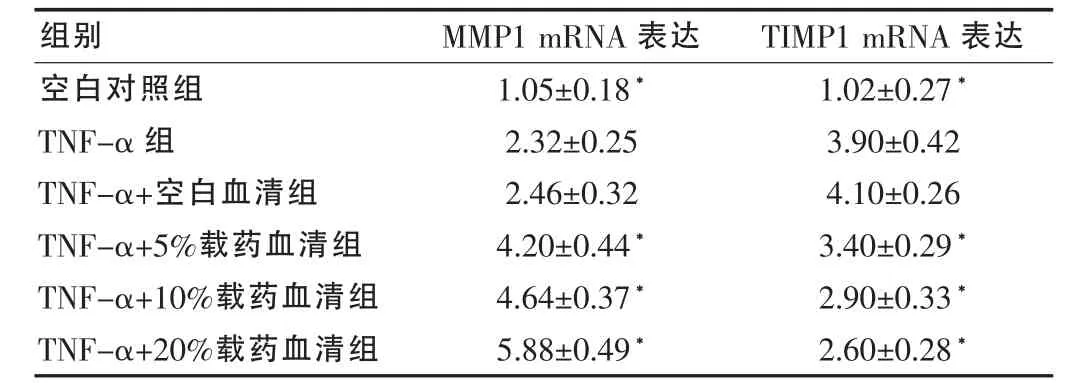
表2 生脉饮载药血清对TNF-α诱导的CFs MMP1和TIMP1基因表达的影响(,2-ΔΔCt,n=5)
注:与 TNF-α组比较,*P<0.05
组别 MMP1 mRNA表达 TIMP1mRNA表达空白对照组TNF-α组TNF-α+空白血清组TNF-α+5%载药血清组TNF-α+10%载药血清组TNF-α+20%载药血清组1.05±0.18*2.32±0.25 2.46±0.32 4.20±0.44*4.64±0.37*5.88±0.49*1.02±0.27*3.90±0.42 4.10±0.26 3.40±0.29*2.90±0.33*2.60±0.28*
2.2.3 生脉饮对CFs TIMP1 mRNA表达的影响 TIMP1 mRNA在空白对照组CFs中呈低表达,经50 ng/mL TNF-α刺激24 h后,TIMP1mRNA表达上调,与空白对照组比较,差异具有统计学意义(P<0.05)。3种浓度的生脉饮载药血清处理后,CFs TIMP1 mRNA表达较TNF-α组明显降低,呈浓度依赖性(均P<0.05)。
3 讨论
“生脉饮”由人参、麦冬和五味子3药组成。人参甘温不燥,具有补气生津的作用为君药;麦冬甘寒生津,润肺养阴,与人参相协气阴双补,相得益彰为臣药;五味子酸湿收敛,益气生津,敛阴止汗,既可固气津之外泄,又能复气阴之损耗,与人参、麦冬相辅相成为佐药。现代研究发现,人参含有多种人参皂苷,能促进造血功能,提高应激反应能力[6]。麦冬含有多种甾体皂苷,能提高免疫力,抗心率失常和扩张外周血管作用[7]。五味子主含挥发油等,与人参相似的适应原样作用,能增强机体对非特异性刺激的防御能力[8]。本实验结果发现,生脉饮载药血清使CFs培养上清羟脯氨酸表达量明显减少,提示在MF形成过程中,生脉饮可通过抑制胶原含量而逆转MF。
MF主要的特征为成纤维细胞数目增多和心肌间质胶原过度沉积,导致心肌顺应性下降,心脏舒缩及电传导功能障碍,是引起心力衰竭的重要原因[9]。有研究发现,TNF-α通过与心肌细胞和成纤维细胞表面受体结合,诱导心肌细胞凋亡及引起细胞外胶原纤维累积,并且激活MMPs,最终也导致心室纤维化、扩张及泵功能衰竭。抗TNF-α治疗能阻止转基因鼠心肌胶原合成、沉积和变性。心肌过量产生的TNF-α可以引起MF、心力衰竭[10]。本研究发现,结果显示TNF-α可以促进胶原蛋白合成,诱导MMP1酶降解,增加异常胶原合成,还能够抑制TIMP1表达,增加MMP1酶活性,表明TNF-α诱导下的CFs模拟了MF的过程,而生脉饮能逆转TNF-α诱导的CFs胶原蛋白合成增加。
MMP降解细胞外基质成分。MMP-1是最先完成蛋白纯化和cDNA克隆的脊椎动物胶原酶,以酶原形式合成,通过蛋白水解作用裂解酶原N-端残基,与其他MMP分享一个催化区及一个序列相似于血红素蛋白的羧端。在正常成人组织中MMP-1表达量极少,但在病理情况下如创伤愈合、修复或重塑过程中,MMP-1表达量增加[11]。MMP和TIMP处于平衡状态,有助于保持动脉壁内细胞外基质成分合成与降解相互平衡达到稳定作用[12]。正常心脏胶原合成是一个动态的过程,合成增加和(或)降解减弱均导致胶原累积。本研究发现与空白对照组比较,TNF-α组CFs中TIMP1 mRNA表达显著升高(P<0.05),促使胶原纤维增生,同时MMP-1 mRNA也代偿性升高。与TNF-α组相比较,3个浓度生脉饮载药血清处理使CFs中MMP-1mRNA表达升高 (P<0.05),而TIMP1 mRNA表达降低。可见生脉饮可能是通过下调MMP-1和上调TIMP1 mRNA表达水平,从而抑制心肌胶原纤维增生及心肌间质纤维化,这可能是其防治心肌纤维化的的作用机制之一。
[1]Lee DW,Lee TK,Cho IS,et al.Creation ofmyocardial fibrosis by transplantation of fibroblasts primed with survival factors [J].Am JPhysiol Heart Circ Physiol,2011,301(3):1004-1014.
[2]Truter SL,Catanzaro DF,Supino PG,et al.Differential expression of matrix metalloproteinases and tissue inhibitors and extracellular matrix remodeling in aortic regurgitant hearts [J].Cardiology,2009,113(3):161-168.
[3]Castoldi G,Digioia CR,Bombardi C,et al.MiR-133a regulates collagen 1A1:potential role ofmiR-133 a in myocardial fibrosis in angiotensinⅡ-dependent hypertension[J].JCell Physiol,2012,227(2):850-856.
[4]楼洪刚,何俏军,吴洪海,等.鸡肝散总黄酮抗胸痹证的实验研究[J].中药材,2003,26(12):878-881.
[5]金锋,储全根,李敏.从“瘀”论治糖尿病心肌病[J].安徽中医学院学报,2011,31(1):6-8.
[6]Lee B,Shim I,Lee H,et al.Effect of ginsenoside Re on depression-and anxiety-like behaviors and cognition memory deficit induced by repeated immobilization in rats[J].JMicrobiolBiotechnol,2012,22(5):708-720.
[7]Xu M,Wang G,Xie H,et al.Pharmacokinetic comparisons of schizandrin after oral administration of schizandrin monomer,Fructus Schisandrae aqueous extract and Sheng-Mai-San to rats[J].JEthnopharmacol,2008,115(3):483-488.
[8]Kwon DY,Kimda S,Yang HJ,et al.The lignan-rich fractions of Fructus Schisandrae improve insulin sensitivity via the PPAR-γpathways in in vitro and in vivo studies[J].JEthnopharmacol,2011,135(2):455-462.
[9]FengW,LiW,Liu W,et al.IL-17 inducesmyocardial fibrosis and enhances RANKL/OPG and MMP/TIMP signaling in isoproterenol-induced heart failure[J].Exp Mol Pathol,2009,87(3):212-218.
[10]Voloshenyuk TG,Hart AD,Khoutorova E,et al.TNF-α increases cardiac fibroblast lysyl oxidase expression through TGF-βand PI3Kinase signaling pathways[J].Biochem Biophys Res Commun,2011,413(2):370-375.
[11]Picard F,Brehm M,Fassbach M,et al.Increased cardiac mRNA expression of matrix metalloproteinase-1 (MMP-1) and its inhibitor(TIMP-1) in DCM patients[J].Clin ResCardiol,2006,95(5):261-269.
[12]Halapas A,Zacharoulis A,Theocharis S,et al.Serum levels of the osteoprotegerin, receptor activator of nuclear factor kappa-B ligand,metalloproteinase-1 (MMP-1) and tissue inhibitors of MMP-1 levels are increased in men 6 months after acute myocardial infarction[J].Clin Chem Lab Med,2008,46(4):510-516.
Effect of Shengmai Oral Liquid on TNF-α-induced collagen synthesis in cardiac fibroblasts for rats
WANG Jingchun1 XU Bo2 ZHANG Chun1
1.Department of Pharmacology,Qiqihar Medical College,Heilongjiang Province,Qiqihar 161006,China;2.Pharmacy Teaching and Research Section,Qiqihar Health School,Heilongjiang Province,Qiqihar 161005,China
Objective To explore the effect and mechanism of Shengmai Oral Liquid on collagen synthesis of neonatal rat cardiac fibroblasts(CFs)induced by tumor necrosis factor(tumor necrosis factor α,TNF-α).MethodsCardiac fibroblasts(CFs)were treated with different concentrations of ShengmaiOral Liquid drug-loaded serum plus TNF-αtreatment in vitro.Hydroxyproline content,MMP1 mRNA and TIMP1 mRNA expression were assayed by spectrophotometry and real-time quantitative reverse transcription-PCR,respectively.ResultsThe content of hydroxyproline in cardiac fibroblasts treated with TNF-αwas higher than the control group.The content of hydroxyproline was reduced in Shengmai Oral Liquid drugloaded serum group compared with the TNF-αgroup.MMP1 and TIMP1mRNA expression was up-regulated expression in TNF-αgroups compared with the control group.MMP1mRNA expression was up-regulated and TIMP1 was down-regulated in Shengmai Oral Liquid drug-loaded serum group compared with the TNF-αgroup.ConclusionTheResultsreveal that Shengmai Oral Liquid can inhibit the collagen synthesis in cardiac fibroblasts,and may correlate with down-regulate expression of TIMP1mRNA and up-regulate expression of MMP1mRNA.
Cardiacmuscle fiber;ShengmaiOral Liquid;TNF-α;Collagen synthesis
R541.61
A
1673-7210(2012)12(a)-0024-03
黑龙江省教育厅科学技术研究项目(项目编号:12511627)。[作者简介]王敬春(1974-),男,生物学硕士,讲师;研究方向:心肌纤维化的发病机制和防治策略。
2012-09-05 本文编辑:卫 轲)
