两种MHC-DRB1单倍型哈萨克绵羊细粒棘球六钩蚴侵染期小肠消减文库的构建
2012-11-10杜鑫立惠文巧赵博郭玉强马军德马世俊木叶沙尔巴吐尔刘贤侠贾斌
杜鑫立,惠文巧,赵博,郭玉强,马军德,马世俊,木叶沙尔·巴吐尔,刘贤侠,贾斌
(1石河子大学动物科技学院,石河子832003;2塔城地区 农九师165团兽医站,塔城834700)
细粒棘球蚴病(俗称包虫病)是细粒棘球绦虫的幼虫寄生于人、绵羊等中间宿主所致的一种人畜共患寄生虫病,其在南美洲、中亚地区、非洲部分地区、澳大利亚和中国最为流行[1-2]。在中国,新疆是最主要的流行地区之一。2009年新疆塔城地区屠宰绵羊的包虫病感染率达50.63%,人群患病率达2.18%[3],而 2010 年 该 地 区 的 人 群 发 病 率 又 较2009年增加了15.67%[4]。全疆范围的包虫病流行趋势亦不容乐观。据报道,2010年全疆包虫病人群发病数和人群发病率较2009年分别增加了8.8%和7.41%[5]。可以看出,新疆包虫病的防治工作仍需进一步的加强。同时,对包虫病和绵羊抗包虫病相关基因等方面的研究工作也显得更为急需。
MHC即主要组织相容性复合体,是由许多紧密连锁、高度多态的基因位点组成的染色体上的1个基因系统。其Ⅱ类基因具有丰富的多态性,所编码的产物在免疫系统中起着抗原呈递和调节免疫应答反应的重要作用,是疾病相关研究的热点基因之一。人MHC基因的多态性与强直性脊柱炎[6]等70多种疾病具有相关性。绵羊MHC-DRB1基因同样具有丰富的多态性[7]。在笔者实验室的前期研究中,即采用PCR-RFLP方法对哈萨克绵羊MHC-DRB1第二外显子的多态性进行了分析,并进一步探讨了该多态性与包虫病抗性的相关性,筛选出了与包虫病抗性相关的MHC-DRB1第二外显子的基因单倍型,并通过人工感染实验进行了初步验证[8]。但对该抗性相关基因单倍型哈萨克绵羊抗包虫病感染的分子作用机制尚不知晓,且目前国内外在六钩蚴侵染期机体相关的免疫应答机制方面的研究尚未见报道。
本研究采用抑制性消减杂交技术,建立以细粒棘球六钩蚴侵染期MHC-DRB1非抗性和抗性相关基因单倍型哈萨克绵羊小肠组织cDNA作为tester和driver的消减文库,旨在为分离相关差异表达基因,进一步研究相关的分子作用机制奠定基础。
1 材料与方法
1.1 动物模型的建立及组织样品的采集
2只土狗驱虫后,人工饲喂带有包虫囊的绵羊肝脏或肺脏,感染细粒棘球蚴绦虫。45 d后,参照朱兴全等[9]的操作方法,分离获取成熟的细粒棘球蚴绦虫虫卵,用于后续哈萨克绵羊的人工感染。
参照实验室前期研究[8]中,获取包虫病抗性相关和非抗性相关MHC-DRB1第二外显子的基因单倍型的试验方法(PCR-RFLP技术),对250只哈萨克绵羊MHC-DRB1第二外显子的基因单倍型进行筛选,获得抗性相关和非抗性相关 MHC-DRB1基因单倍型哈萨克绵羊各14和22只。进一步对此36只哈萨克绵羊进行包虫病血清抗体检测(ELISA检测试剂盒购自深圳康百得生物公司)和肝脏部位B超探测。挑选ELISA检测结果为阴性,经B超探测肝脏部位无包囊的抗性相关和非抗性相关MHCDRB1基因单倍型哈萨克绵羊各3只(简称为抗性组和非抗性组)。
对抗性组和非抗性组的3只哈萨克绵羊均经口饲喂上述分离获取的细粒棘球蚴绦虫虫卵约5000枚,分别于2、3和4 h宰杀抗性组和非抗性组哈萨克绵羊各1只,迅速采集小肠组织于液氮中保存。
1.2 小肠组织总RNA提取及mRNA分离
参照TRIzol Reagent RNA提取试剂盒(Invitrogen公司)的操作说明,提取抗性组和非抗性组哈萨克绵羊小肠组织的总RNA。将非抗性组的3只哈萨克绵羊小肠组织的总RNA等量混合构成非抗性组小肠组织总RNA库,同样方法获得抗性组小肠组织总RNA库。
依据Poly Tract mRNA Isolation System(Promega公司)的操作说明,采用磁珠法分离抗性组和非抗性组的mRNA。
1.3 抑制性消减杂交
按照 PCR-SelectTMcDNA Subtraction kit(Clontech公司)说明书的具体步骤进行抑制性消减杂交。抗性组和非抗性组mRNA各2μg,反转录合成双链cDNA,依据 QIAquick PCR Purification Kit(Qiagen公司)的操作说明进行纯化,完成Driver cDNA(抗性组双链c DNA)的制备。非抗性组双链cDNA经RsaI内切酶(试剂盒提供,下文中其他试验材料未特别标注的均为试剂盒提供)37℃充分酶切后,分为2份,分别与adaptor1和adaptor 2 R进行连接,完成 Tester-1 cDNA 和 Tester-2 cDNA 的制备。Tester-1 cDNA和 Tester-2 cDNA分别与过量的Driver cDNA进行1轮杂交后,杂交产物同时与新变性的Driver cDNA混合,进行2轮的杂交反应。获得的消减杂交产物进行2轮的PCR扩增完成抑制性消减杂交。
消减效率的检测以看家基因GAPDH为指标。以消减cDNA和未经消减的cDNA(制备Tester cDNA时,加好样但还未进行连接反应的Tester-1 cDNA和Tester-2 cDNA各取2μL混合后,一并进行连接反应获得)为模版,用GAPDH的特异性引物 (5′-CTGACCTGCCGCCTGGAGAAA-3′;5′-GTAGAAGAGTGAGTGTCGCTGTT-3′,由 上 海生工合成)进行PCR扩增。扩增程序:94℃5 min,94℃30 s,60℃30 s,72℃1min。比较二者在不同循环数(18、23、28、33、38循环,每循环各取5μL用于电泳分析)时,PCR产物的产量来确定消减效率。
1.4 消减cDNA文库的构建及PCR初步鉴定
参照p MDTM19-T Vector(大连宝生物)说明书的操作步骤,将获得的消减cDNA产物(2轮PCR产物)与p MD19 T载体连接。连接产物经热击法转化至DH5α感受态细胞(天根生物),涂布于含X-gal、IPTG和Amp的LB平板,37℃培养过夜,完成消减cDNA文库的构建。
随机挑取阳性克隆于800μL含Amp的LB液体培养基中,37℃200 r/min振荡培养5 h。取1 μL菌液作为模版,用Nested primer 1和Nested primer 2 R作为引物进行PCR扩增,初步鉴定获得的消减c DNA片段。PCR反应程序为:94℃5 min,(94℃30 s,68℃30 s,72℃90 s)×35。
2 结果与分析
2.1 小肠组织总RNA提取及mRNA的分离
经1.0%普通琼脂糖凝胶电泳检测显示提取的总RNA(图1a)完整性较好,28和18S条带清晰且二者的亮度比较好,5S条带较弱;通过核酸分析仪分析测得 OD260/280比值均为1.9~2.1,OD260/230比值均大于2,提示所提取的总RNA无蛋白质和其他杂质污染,纯度较高;所分离的mRNA(图1b)效果较好,未发生明显降解。通过核酸分析仪测得OD260/280比值均为2.0~2.1,OD260/230比值均大于2,表明m RNA提取过程中未发生污染。综合来看,分离获得的mRNA可用于后续研究。
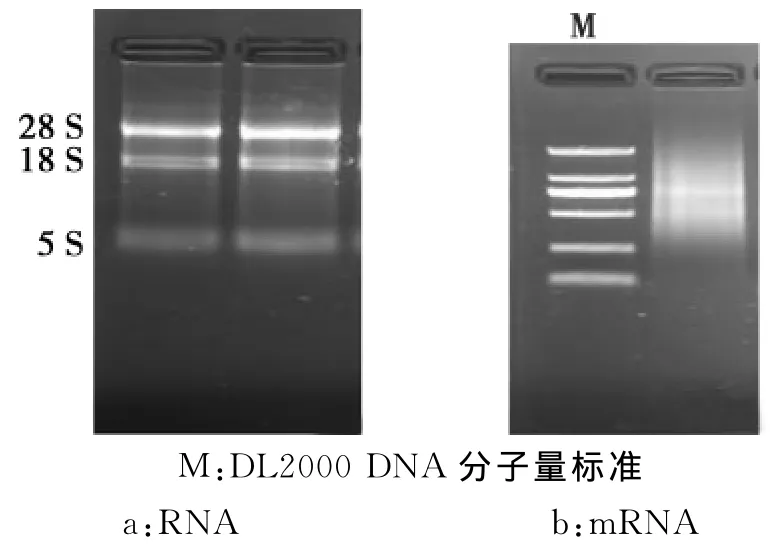
图1 部分总RNA及mRNA电泳结果Fig.1 The results of RNA and mRNA electrophoresis
2.2 双链cDNA的合成及RsaI酶切
按照试剂盒使用说明中步骤,将分离获得的mRNA反转录合成双链cDNA,之后用识别GTAC四碱基酶切位点的RsaI核酸内切酶酶切。合成的双链cDNA及其经RsaI酶酶切后的产物经1.0%琼脂糖凝胶电泳检测,由结果(图2)可以看出,酶切后的cDNA片段较酶切前的cDNA片段,长度及整体亮度明显下降,提示酶切效果较好,经纯化后可用于Driver cDNA后续的杂交反应和Tester cDNA的接头连接反应。
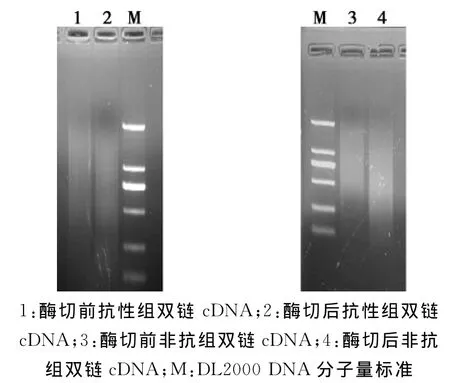
图2 双链cDNA合成和RsaI酶切结果Fig.2 Results of dscDNA synthesis and RsaI digestion
2.3 接头连接效率检测
连接反应的效率对整个抑制性消减杂交试验至关重要。按照试剂盒操作说明,采用PCR方法检测了接头连接反应的连接效率。产物经2.0%琼脂糖凝胶电泳检测,通过对比不同引物组合的扩增产物的大小和条带亮度分别确定接头连接的成败和效率。
结果(图3)显示,1、3道采用 GAPDH3′引物和PCR primer1为上下游引物的PCR产物大小大于2、4道采用GAPDH 自身3′和5′引物所扩增的PCR产物,同时1、2道和3、4道的条带亮度比均大于1/4。可以看出Tester cDNA与接头的连接反应成功且效率均大于25%,符合试验要求;同时5道只采用PCR primer1作为上下游引物的PCR产物呈现为抹带,符合预期。
综合来看,接头连接反应符合试验要求,可以进行后续的杂交试验。
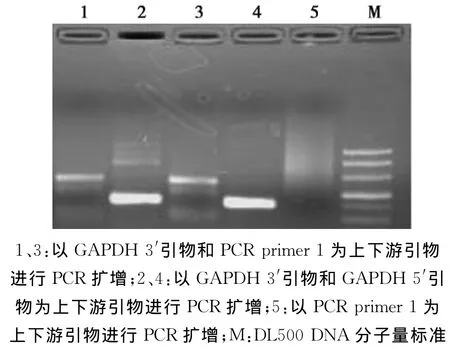
图3 接头连接效率检测Fig.3 Results of the adaptor ligation efficiency analysis
2.4 消减效率检测
消减效率直接标示着抑制性消减杂交试验的成败,采用绵羊GAPDH看家基因,以未消减cDNA作为对照,检测GAPDH基因在未消减cDNA和消减后cDNA中含量的差异,来反映消减效率的高低。产物经1.5%琼脂糖凝胶电泳检测后的结果(图4)显示:未消减cDNA做为模板的PCR扩增产物在第18个循环即有条带出现,而以消减后cDNA做为模板的PCR扩增产物在33个循环才有较弱的条带出现,提示GAPDH基因在反向消减文库的消减效率达到了233-218即215倍,也即表明某些差异表达的基因得到相同倍数的富集。
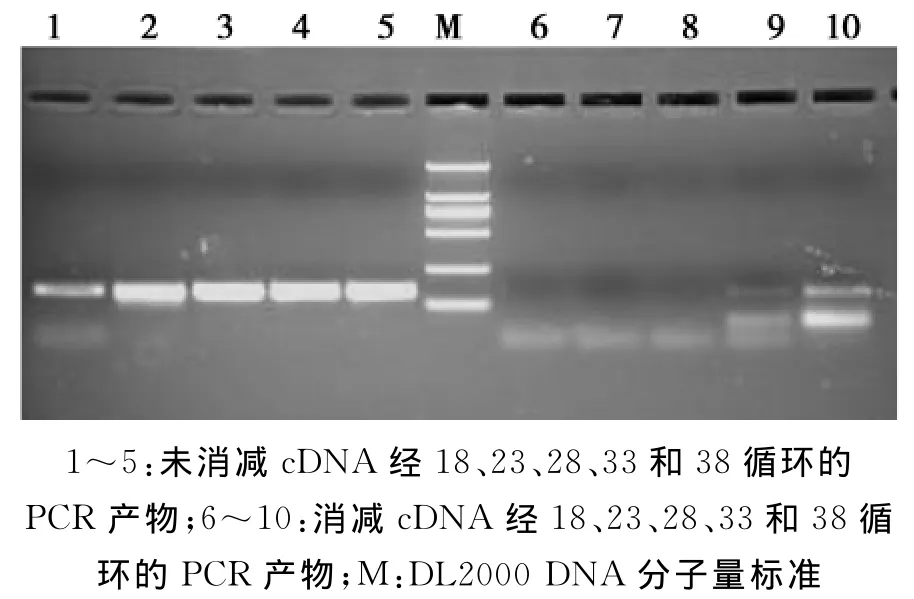
图4 以GAPDH为指标检测消减文库的消减效率Fig.4 Subtraction efficiency of subtracted cDNA library by detection of GAPDH gene
2.4 消减cDNA文库阳性克隆的PCR鉴定
将最终获得的抑制性消减产物与PMD19 T载体连接和转化后,随机挑取阳性克隆98个,菌液PCR验证,PCR扩增产物于1.5%琼脂糖凝胶电泳中检测。结果(图5)显示插入片段大小为150~1000 bp,符合试验预期。
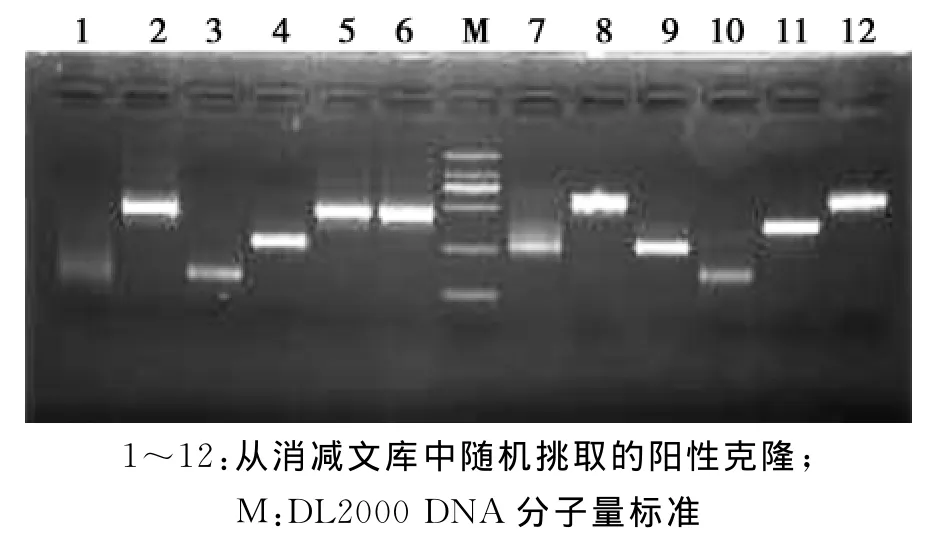
图5 PCR检测消减cDNA文库克隆插入片段Fig.5 Identification of the inserted cDNA fragments
3 讨论
抑制性消减杂交技术是分离差异表达基因的一种简便高效的方法,具有较高的特异性,能够为后续的研究工作提供相关的候选基因,提高研究的工作效率。本实验中,在采取每组3只绵羊个体用于降低个体间差异的同时,完成了消减文库的构建,消减效率(1015)较高,为后续的试验研究奠定了基础。
在构建抑制性消减文库的操作过程中,细心认真的操作十分重要。在双链c DNA合成后纯化和双链cDNA产物经RsaI酶切后酶切产物的纯化中,按试剂盒操作说明,纯化时采用的为酚氯仿抽提法。这对试验操作的精确性要求较高,因合成后的双链cDNA产物及其后续的酶切产物体积均较小(均<100μL),在进行酚氯仿抽提,吸取上清的操作过程中,吸取过少会使产物损失过多,吸取过多又容易将酚、氯仿等抑制剂带入到下游的酶切反应和接头连接反应中。将直接导致酶切和连接效率不足,进而影响后续消减杂交试验中的消减效率。为此,在本实验的实际操作过程中,选择了过柱纯化这种更稳妥的方法,在保证纯化效率的同时也避免了产物的过多损失,更为重要的是排除了酶切效率和接头连接效率较低时反应抑制剂这个因素。如此能更为迅速并较好地达到试验的要求,保证了试验的成功率。这在一些研究[10]中也有相同的做法。
细粒棘球蚴绦虫含有多种抗原成分,并能够在感染机体的不同阶段产生特定的抗原,致使机体在不同时期产生不同的的特异性免疫反应[11],涉及一系列复杂的免疫应答过程。目前,对细粒棘球六钩蚴侵染小肠时期的研究较少,而Pater等[12]发现,对Balb/C小鼠经口饲喂1500枚多房棘球蚴绦虫的成熟虫卵,在感染后的早期阶段,粘膜免疫在机体的免疫反应中占着主导地位。同样,有研究认为小肠粘膜免疫是防御寄生虫侵入小肠进入机体的一道防线,是进行抗原捕获、诱导免疫效应反应和免疫记忆细胞生成的重要场所之一[13-14],当寄生虫虫卵孵化出的幼虫侵入肠壁时能够诱导小肠粘膜免疫应答的产生[15]。
本实验采用抑制性消减杂交技术成功构建了包虫病抗性相关和非抗性相关MHC-DRB1基因单倍型哈萨克绵羊在六钩蚴侵染期即小肠粘膜免疫时期,小肠组织的消减文库。本研究结果为进一步分离和鉴定相关的差异表达基因奠定了基础,进而为探索包虫病抗性相关MHC-DRB1基因单倍型哈萨克绵羊抗包虫病的分子作用机制提供了一定参考。
[1]Yang Y R,Sun T,Li Z,Zhang J,et al.Community surveys and risk factor analysis of human alveolar and cystic echinoco-ccosis in Ningxia Hui Autonomous Region,China[J].Bull World Health Organ,2006,84(9):714-721.
[2]Moro P L,Schantz P M.Echinococcosis:historical landmarks and progress in research and control[J].Ann Trop Med Parasitol,2006,100(8):703-714.
[3]薛玉芝,布荣华,邢华.2009年新疆塔城市包虫病调查报告[J].地方病通报,2010,25(3):48.
[4]曹岩,王新旗,郑强,等.2010年新疆塔城地区包虫病流行状况分析[J].疾病预防控制通报,2011,26(4):14-16.
[5]曹岩,温娟,郑强,等.2010年新疆包虫病流行状况分析[J].宁夏医科大学学报,2011,33(8):784-788.
[6]Scofield R H,Kurien B,Gross T,et al.HLA-B27 binding of peptide from its own sequence and similar peptides from ba-cteria:implications for spondyloarthopathies[J].Lancet,1995,35:1542-1544.
[7]彭林泽,袁其彬,郭玉强,等.多浪羊MHC-DRBI基因的HaeIII的酶切多态性[J].石河子大学学报:自然科学版,2007,25(2):177-179.
[8]Li R Y,Jia B,Zhang W J.Analysis The Relationship Between MHC-DRB 1 Gene Polymorphism and Hydatid Resistance in Hazakh sheep[J].Asian-Australasian Journal of Animal Sciences,2010,23(9):1145-1151.
[9]朱兴全,窦兰清,史晓红,等.细粒棘球绦虫排泄分泌抗原研究[J].中国兽医科技,1991,21(9):6-9.
[10]王刚.应用抑制消减杂交筛选小鼠肾虚证差异表达基因[D].成都:成都中医药大学,2001.
[11]刘约翰,赵慰先.寄生虫病临床免疫学[M].重庆:重庆出版社,1993.
[12]Pater C,Müller V,Harraga S,et al.Intestinal and systemic humoral immunological events in the susceptible Balb/C mouse strain after oral administration of Echinococcus multilocularis eggs[J].Parasite Immunology,1998,20(12):623-629.
[13]MacDonald T T.The mucosal immune system[J].Parasite Immunol,2003,25(5):235-246.
[14]董玉兰,王树迎.动物黏膜免疫细胞研究进展[J].动物医学进展,2003,24(1):7-9.
[15]Yang W,Gobert G N,Mc Manus D P.Oral vaccination of mice with recombinant Schistosoma japonicum proteins inducesspecific anti-parasite antibodies and damage to adult worms after a challenge infection[J].Int J Parasitol,1997,27(7):843-853.
