香花槐各组织总RNA提取方法的改良和优化
2012-11-10昌艳萍王晓茹王宇张子达王华芳
昌艳萍,王晓茹,王宇,张子达,王华芳
(1.北京林业大学 生物科学与技术学院, 北京 100083;2.河北大学 生命科学学院, 河北 保定 071002)
香花槐各组织总RNA提取方法的改良和优化
昌艳萍1,2,王晓茹2,王宇2,张子达2,王华芳1
(1.北京林业大学 生物科学与技术学院, 北京 100083;2.河北大学 生命科学学院, 河北 保定 071002)
为探索香花槐各组织总RNA提取的最佳方法,以实验苗圃中的香花槐为实验材料,在比较了Trizol试剂法和常规CTAB法的基础上,建立了香花槐不同组织的最适提取方法.改良CTAB法利用高质量浓度的β-巯基乙醇和合适质量浓度的聚乙烯基吡咯烷酮(PVP)来防止RNA提取过程中多酚的氧化,然后增加苯酚/氯仿抽提次数来去除香花槐叶片和茎皮过多蛋白质.改良Trizol试剂法在根皮中加PVP研磨成白色粉末,可以有效地防止反应液褐化.各组织优化方法经琼脂糖凝胶电泳检测,所提取的总RNA的28S、18S条带清晰明亮,无降解;其A260 nm/A280 nm值为2.0,表明提取的总RNA质量较好.
香花槐;多糖;多酚;总RNA; 组织
香花槐(Robiniapseudoacacia‘Idaho’)为豆科刺槐属乔木树种,20世纪60年代从西班牙引入朝鲜,1996年从朝鲜引入中国[1].香花槐速生,花紫红色,总状花序壮观,开花时间5-7月,花期长;根系强健,萌蘖更新能力强,有根瘤菌,能固氮,耐旱、耐瘠薄、耐盐碱,喜沙质土壤,并可有效地保持水土,改善生态环境.是城市绿化、美化、沙化及流域治理、荒山荒地生态修复的先锋树种[2].在基因水平上了解该树种生长发育;开展遗传转化品种改良的研究已得到了重视.相关分子生物学和工程技术研究, cDNA文库建立、Northern杂交分析或RT-PCR及表达差异分析等亟待高质量的RNA[3].
植物组织总RNA提取方法的报道很多, 且Yoshida曾报道香花槐凝集素cDNA的克隆,这为香花槐不同组织RNA提取方法的建立和优化提供了丰富资料[4].同时考虑到植物组织特异性,不同材料甚至同一材料不同发育阶段,RNA的提取方法也不尽相同[5-7].本文以香花槐根、茎、叶等不同器官为试材,以Trizol法、十六烷基三甲基溴化胺(CTAB)法为基础,优化和建立其RNA提取方法,为其分子生物学研究和生物工程技术需要奠定基础.
1 材料和方法
1.1材料和试剂
1.1.1 材料
供试材料香花槐(Robiniapsuedoacacia‘Idaho’)采自北京林业大学生物中心苗圃.4-5月,植株萌芽生长,采集嫩叶、茎、根部皮层和幼嫩根尖,液氮冷却,-80 ℃储存备用.
1.1.2 主要试剂配制
焦碳酸二乙酯(DEPC)水:质量浓度为1 g/L;CTAB裂解缓冲液;苯酚、氯仿、异戊醇以体积比25∶24∶1混合; 体积分数为75%的乙醇;LiCl 10 mol/L;SSTE溶解液(DEPC水配制).
1.1.3 实验用品处理
实验中所用的塑料制品在含质量浓度为1 g/L的 DEPC水中,37 ℃浸泡12 h;玻璃器皿与用具均在180 ℃下烘烤12 h,然后121 ℃灭菌30 min,60 ℃烘干备用.
1.2提取方法
1.2.1 Trizol法
自Invitrogen公司购Trizol试剂,其RNA提取方法参照试剂说明书,得到的总RNA溶于适量的 DEPC水中.
1.2.2 改良Trizol法
考虑到植物组织中多酚类和多糖物质的含量高,细胞破碎后极易被氧化成红褐色物质,与核酸不可逆地结合[8]干扰RNA提取,在上述Trizol法基础上,在研磨幼嫩根皮过程中,加入质量浓度为20 g/L的PVP,在抽提过程中加入等体积的苯酚、氯仿、异戊醇(体积比25∶24∶1)混合液进行抽提.
1.2.3 改良CTAB法
在徐进[9]方法基础上,以幼嫩树皮为实验材料,针对香花槐组织本身蛋白质含量高的特性[10],对聚乙烯基吡咯烷酮(PVP)最适质量浓度、β-巯基乙醇以及用等体积的苯酚、氯仿、异戊醇(体积比25∶24∶1)混合液抽提去蛋白的次数进行了摸索,各比例设计见表1.
1.3 RNA完整性分析
从表1所述方法得到的RNA中取6 μL进行质量浓度为10 g/L的琼脂糖凝胶电泳分析.
1.4 RNA得率及纯度
以微量分光光度计(SMA3000型)测量RNA样品的OD230,OD260,OD280和RNA质量浓度,以OD260/OD280,OD260/OD230检测RNA纯度.按照以下公式计算RNA产率,
产率=ρ×N×V/m,
ρ为样品质量浓度,单位为μg/mL,N为样品稀释倍数,V为样品体积,单位为mL,m为样品质量,单位为g.
本实验用相同质量的组织为研究对象,同时提取后的RNA溶解于相同体积的DEPC水中,因此,样品质量浓度的大小就反应了各组织材料的产率大小.
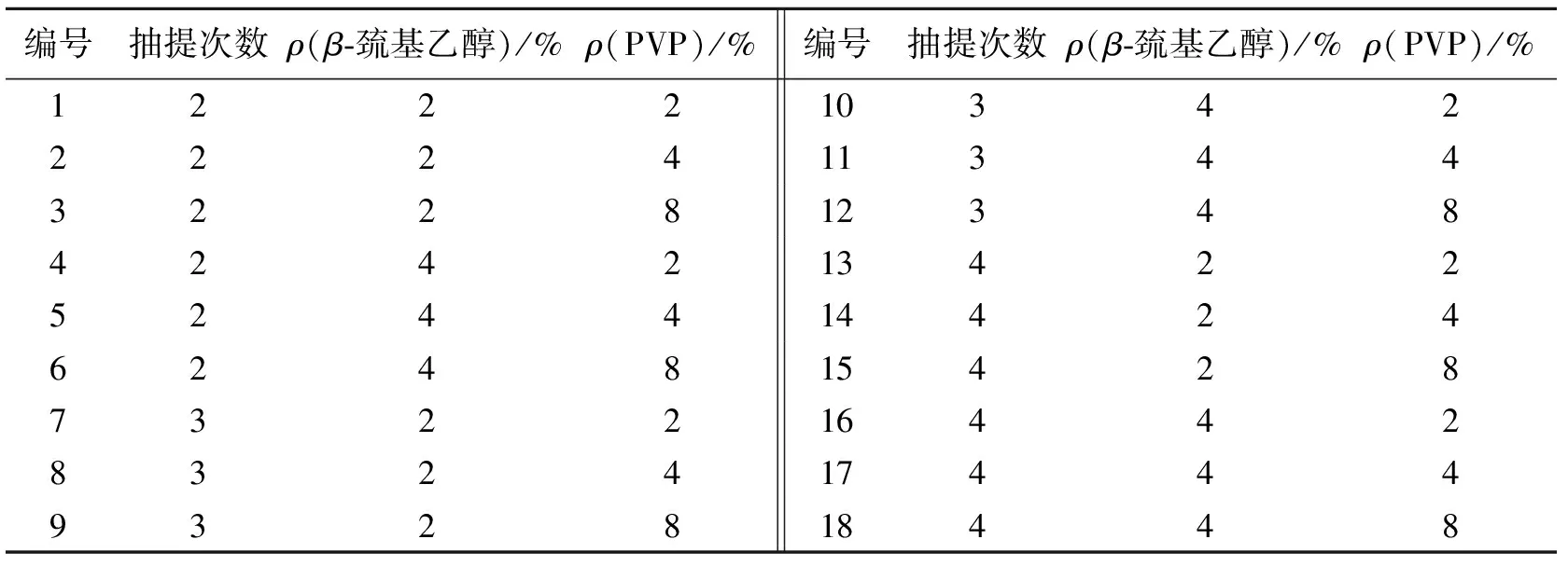
表1 香花槐总RNA提取方法
2 结果与分析
2.1 2种Trizol法提取RNA的比较
RNA的完整性:总RNA的主要成分是28S RNA和18S RNA,因此,根据琼脂糖凝胶电泳图上28S和18S RNA的完整性可以判断RNA有无降解及有无DNA污染.图1显示,Trizol法提取的总RNA样品有条带的只有根组织,18S rRNA条带亮度与28S rRNA 几乎一致, 28S rRNA条带亮度为18S rRNA条带亮度2倍的状况没有呈现出;茎和叶片提取的总RNA无清晰条带出现,而点样孔周围亮,可能有大片段DNA污染;该方法不适合用于提取香花槐RNA.
改良Trizol法,在根皮中加入PVP研磨,粉末白色,有效防止褐化(图2).由于Trizol试剂中含有强氧化剂苯酚,能将根皮组织中的多酚类物质氧化,从而发生褐化效应[11].在本研究中发现Trizol法1次并不能非常完整有效地去除细胞中的蛋白质.为了将多糖和蛋白成分更彻底地去除,增加了在抽提过程中加入等体积的苯酚、氯仿、异戊醇(体积比25∶24∶1)混合液,28S和18S条带均清晰可见,且条带明亮,28S条带的亮度约是18S条带的2倍,说明提取的RNA无降解,质量好,且无DNA污染(图3).图2表明,常规Trizol法提取的根组织总RNA样品,在琼脂糖凝胶电泳点样孔附近显示明亮条带,说明有大分子蛋白或DNA污染.与此相比,改良Trizol法去除了根皮总RNA提取的干扰,提取效率高,为香花槐根皮总RNA提取的首选方法.
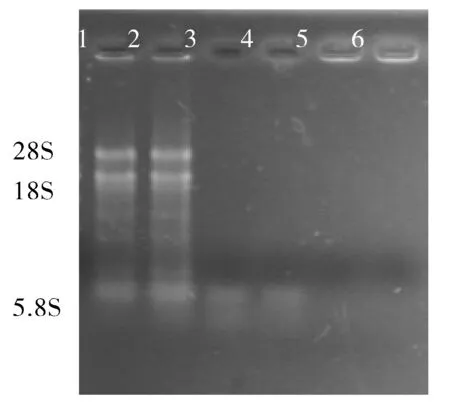
1,2.根皮;3,4.枝皮;5,6.叶片.

1.加PVP裂解粗提物;2.不加PVP裂解粗提物.
2.2提取香花槐RNA的改良CTAB法
本实验着重以幼嫩叶片为实验材料对CTAB法进行了改良.紫外分光光度计测定不同处理方法提取的总RNA进行比较,结果见表2、表3.表2、表3显示当PVP质量浓度为20 g/L时,RNA的平均产率为243.25 μg/mL,显著高于质量浓度为40, 80 g/L时的产率209.25,174.67 μg/mL, PVP质量浓度升高时,RNA纯度逐渐增高,但RNA产率却开始下降,说明在PVP去除多酚等杂质时也结合RNA使其丢失了,但其OD260/OD230和OD260/OD280的比率都在2.0左右.PVP与酚类化合物(特别是原花色素类物质)能形成鳌合物,使之不能成为多酚氧化酶的底物而阻止它们的氧化.3种不同质量浓度的PVP所获得的第1次抽提产物的颜色比较见图4.图4结果表明,PVP可以有效地防止底物的褐化,结合表2可知,PVP的质量浓度在20 g/L时无论是RNA产率,还是OD260/OD230和OD260/OD280的比率都是最理想的.如果在能保证RNA质量的前提下,适当降低PVP的质量浓度,认为20 g/L即可作为PVP的适宜质量浓度.40 g/L和20 g/Lβ-巯基乙醇2个处理中RNA产率变化不显著,但40 g/L处理可明显提高RNA的纯度,所以认为40 g/L为β-巯基乙醇作用的最适质量浓度.

1.20 g/L PVP;2.40 g/L PVP ;3.80 g/L PVP.
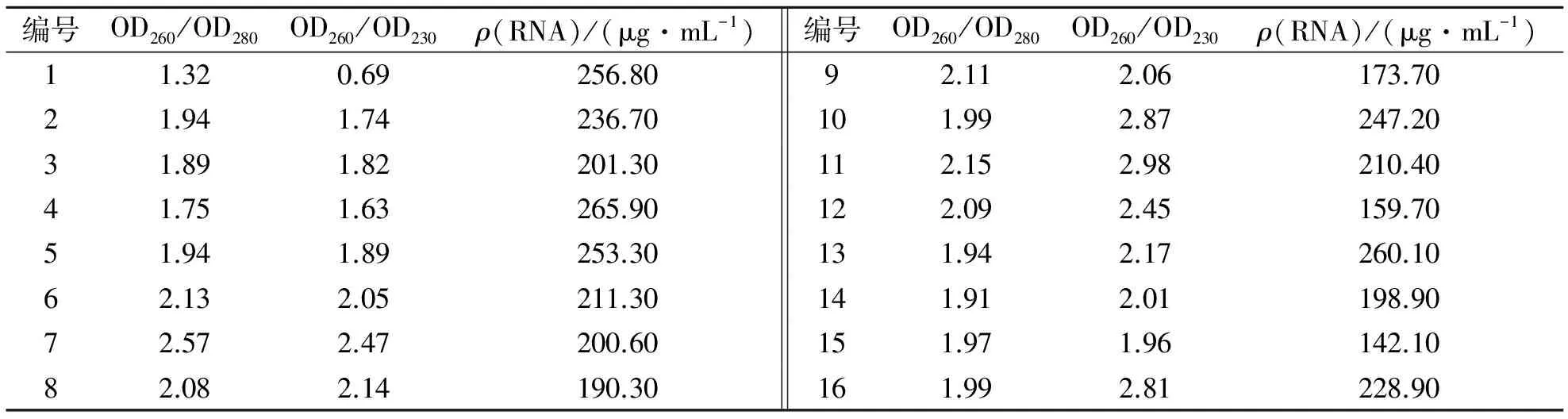
表2 不同组合提取RNA的结果比较
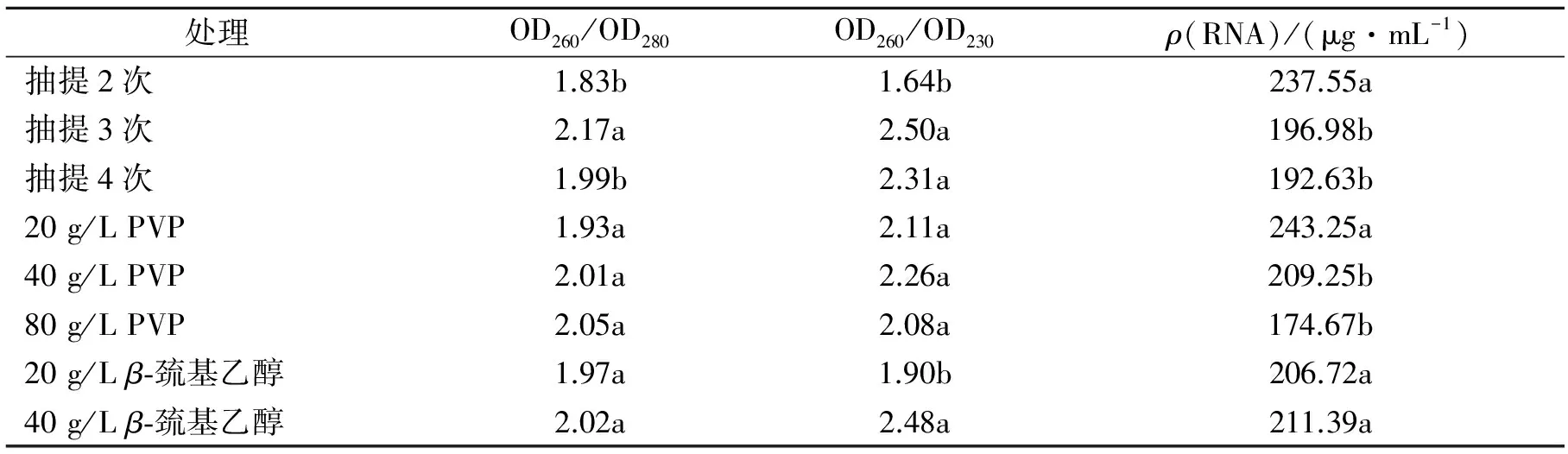
表3 不同组合提取RNA的平均纯度、产率及其差异显著性
据测定,香花槐茎叶中分别含粗蛋白21%~25%,是一种速生、高产、优质的木本饲料[10].在提取的过程中应该加强对蛋白的去除,防止蛋白对下游工作的影响,因此本实验选用增加抽提次数来比较蛋白的去除,结果如图5和表2.表2显示随着抽提次数的增加RNA含量会有所降低,但其OD260/OD230和 OD260/OD280的比率是越来越理想(2.0左右),图5也表明不同抽提次数的离心产物也显示越来越透明澄清.考虑到RNA的得率及其OD260/OD230和 OD260/OD280的比率,选择2次为最适的抽提次数.
对香花槐而言,综合以上结果,改良CTAB法的最适提取液组成为 4 mol/L异硫酸氰胍,20 g/L CTAB, 20 mmol/L EDTA(pH 8.0), 100 mmol /L Tris-HCl ( pH 8.0 ),质量浓度为40 g/L的β-巯基乙醇和20 g/L PVP,在抽提过程中选择抽提2次,在以下香花槐茎皮和叶片组织的改良CTAB法中均采用此方法.
2.3不同组织的RNA提取方法比较
以改良的Trizol法提取香花槐根皮,以改良CTAB法提取香花槐叶片和茎皮结果如图6.图6显示提取的RNA 28S条带的亮度约是18S条带的2倍,多酚、蛋白及多糖类等杂质污染较少, 符合后续分子生物学的实验要求.

1.抽提1次 ;2.抽提2次 ;3.抽提3次.
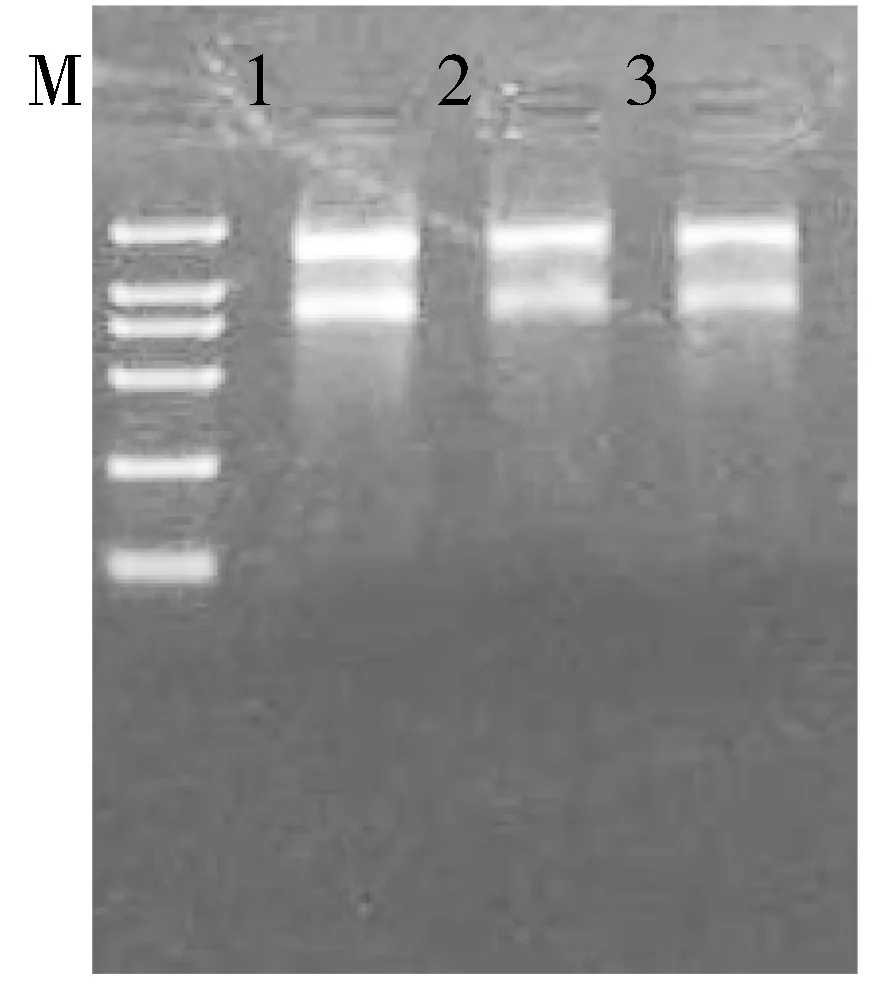
M.Mark;1.改良Trizol试剂法提取根皮;2,3.改良CTAB法分别提取的叶片和茎皮.
图6不同方法提取香花槐不同器官与组织的总RNA琼脂糖凝胶电泳图谱
Fig.6AgarosegelelectrophoresisoftotalRNAisolatedfromdifferenttissuesororganswithdifferentmethods
3 讨论
不同植物,即使同一植物不同组织的组成差别较大,所以对于不同植物或同一植物不同组织的RNA提取方法也应该有所不同[5].
3.1 RNA提取需要注意的问题
实验过程中要严格控制无酶的环境,操作人员要带一次性手套和口罩,整个过程尽量在超净台工作,提前用紫外灯照射消毒超净台30 min,所用试剂都需要灭酶处理,以减少RNase的污染.要用液氮彻底研磨,否则影响细胞的完全破裂,提出的RNA量少或根本提不出.特别在本实验中比较坚硬的根皮组织可以事先在液氮中冷冻2 h以上再研磨.
3.2防止酚类氧化
在整个RNA提取过程中十分容易氧化,这是由于香花槐等植物类含有大量酚类化合物,导致各组织提取过程中颜色逐渐加深变褐,为解决酚类氧化问题,可以用β-巯基乙醇作为还原剂[13],提高RNA的质量的同时用PVP作鳌合剂,减轻氧化而产生的背景颜色.
3.3克服蛋白质污染
考虑到香花槐尤以茎叶组织中含有大量的蛋白,这样在提取缓冲液中加入如盐酸呱、异硫酸氰胍、巯基乙醇及CTAB等蛋白质变性剂,使蛋白质变性完全,细胞裂解彻底,从而将RNA完全释放出来,同时可去除大部分蛋白质,最后再用苯酚/氯仿多次抽提除去残存的蛋白质和DNA.
经过上述改良的CTAB法、Trizol试剂法产率和质量均有显著改善,且在香花槐的不同材料组织中具有较好的适用性.即使方法适宜,实验材料也会很大程度限制RNA的提取,应根据操作者实验具体要求选择适宜的材料,从而达到最佳效果.本实验于4月中旬,以香花槐幼嫩组织为试材提取RNA,产率和质量均较高.
[1] JUNFAR.香花槐[EB/OL].(2005-10-05).[2006-01-20].http://www.landscape66.com/plant/ahiwu/200510/3526.html.
JUNFAR.Robiniapseudoacacia'Idaho'[EB/OL].(2005-10-05).[2006-01-20].http://www.landscape66.com/plant/ahiwu/200510/3526.html
[2] 刘昀,李凤霞,郑易之,等.香花槐组培苗快繁体系的建立及工厂化育苗的主要影响因素[J].应用与环境生物学报,2004, 10(2): 162-165.
LIU Yun,LI Feng-xia,ZHENG Yi-zhi,et al.Clonal propagation ofrobiniacn.idaho and main factor affecting its large-scaleproduction [J].Chinese Journal of Applied and Environmental Biology, 2004, 10(2): 162-165.
[3] 李宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999, 15(1): 36-39.
LI Hong, WANG Xinli.The difficulties in the isolation of RNA from plant tissues and their resolving strategies [J].1999, 15(1): 36-39.
[4] YOSHIDA K, BABA K, YAMAMOTO N, et al.Cloning of a lectin cDNA and seasonal changes in levels of the lectin and its mRNA in the inner bark of Robinia pseudoacacia[J].Plant Mol Biol,1994, 25(5): 845-853.
[5] AINSWORTH C.Isolation of RNA from floral tissue of Rumex acetosa (sorrel) [J].Plant Moleculer Biology Reporter,1994, 12(3): 198-203.
[6] LEWINSOHN E S C L C.Simple isolation of functionalRNA from woody stems of gymnosperms[J].Plant Moleculer Biology Reporter,1994, 12(1): 20-25.
[7] SU X, GIBOR A.A method for RNA isolation from marine macro-algae[J].Anal Biochem,1988,174: 650-657.
[8] 萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].黄培堂,译.北京: 科学出版社, 2002: 518-525.
SAMBROOK J, RUSSELL D W.Molecular cloning: a laboratory manual [M].Beijing: Science Press,2002:518-525.
[9] 徐进,李帅,施季森.鹅掌楸属植物总RNA提取方法的比较与分析[J].福建林学院学报,2008, 28(2): 156-159.
XU Jin,LI Shuai,SHI Ji-Sen.Comparison and analysis of the methods of RNA isolation for Liriodendron genus[J].2008, 28(2): 156-159.
[10] 梁山.高产速生优质木本饲料-香花槐[J].新疆农业科技,2002(6): 38.
[11] FANG G H S G R.A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J].Bio Techniques,1992,13: 52-56.
[12] SCHNEIDERBAUER A, SANDERMANN H Jr, ERNST D.Isolation of functional RNA from plant tissues rich in phenolic compounds[J].Anal Biochemistry,1991(197): 91.
(责任编辑:赵藏赏)
EfficientimprovedmethodsforisolationofhighqualitytotalRNAfromdifferenttissuesofRobiniapseudoacacia‘Idaho’
CHANGYan-ping1,2,WANGXiao-ru2,WANGYu2,ZHANGZi-da2,WANGHua-fang1
(1.College of Biological Science and Biotechnology,Beijing Forestry University,Beijing 100083,China; 2.College of Life Sciences, Hebei University,Baoding 071002,China)
To search for the best methods, the different organs ofRobiniapseudoacacia‘Idaho’ were used as materials to establish the improved methods for isolation of total RNA by comparing Trizol method and CTAB method.An improved CTAB method which can use the high concentrationβ-mercaptoethanol and 20 g/L PVP to eliminate the interferences of polysacchrides and the further phenol/chloroform extraction to eliminate the interferences of proteins of the leaf blade and stem ofR.pseudoacacia‘Idaho’ was constructed in this study.The reaction solution could effectively prevent to brown by adding PVP in the root bark in the improved Trizol method.The optimized methods of each organ ofR.pseudoacacia‘Idaho’ showed that 28S and 18S RNA bands were clearly visible and theA260 nm/A280 nmratio of the isolated total RNA was 2.0, and which indicated that the total RNA quality was satisfying.
Robiniapseudoacacia‘Idaho’;polysacchrides; polyphenols; RNA extraction; tissues
Q52
A
1000-1565(2012)01-0075-06
2011-10-12
国家林业公益性行业科研专项项目(200704017)
昌艳萍(1969-),女,湖北仙桃人,河北大学副教授,北京林业大学在读博士研究生,主要从事生物技术研究.
王华芳(1956-),男,云南石屏人,北京林业大学教授,博士生导师,主要从事植物生物技术方面的研究.
E-mail:hfwang.163@163.com
