磁性负载型光催化材料TiO2/Fe3O4的制备、改性及表征
2012-11-10陈明洁李学光
陈明洁,李学光,白 路
(1 华南农业大学理学院,广东广州 510642;2 中山大学物理科学与工程技术学院,太阳能系统研究所,广东广州 510006)
纳米TiO2具有无毒、高效、洁净、性能稳定等突出特点,在净化空气、降解农药残留、染料敏化太阳能电池等许多领域都具有广泛的应用前景[1].特别是在光催化处理废水的应用中,由于性能好而在研究中倍受关注,但在具体应用过程中,悬浮态的纳米TiO2颗粒细小,不易被传统的分离方法所回收(如絮凝、沉淀等)[2]、重复利用率低且排出液易产生二次污染[3-4],因而严重限制了其应用推广.目前文献报道解决这一问题主要有几种方法:在载体上镀膜、无基底(自支撑)的整体薄膜、分级微纳结构和磁性负载等.在载体上镀膜方式是将TiO2负载于载体表面或者内嵌于载体中,制备成光催化复合膜,有研究采用硅胶[5]、活性碳[6]、氧化铝[7]、氧化锆[8]等多孔材料作为载体,但该方法制备工艺复杂,且往往导致TiO2比表面积大大降低,同时载体的吸光也会造成光催化活性下降.无基底的整体薄膜是采用包括阳极氧化法、水热法及传统溶胶-凝胶法等制备出TiO2的整体薄膜,如TiO2纳米线、纳米管阵列组成的薄膜,因具有很高的比表面积,比载体上的TiO2薄膜具有更好的光催化效率.然而,上述提到的一维TiO2纳米阵列一般是在基底上(如Ti箔、TCO玻璃或是硅基底)先进行薄膜制备[9-12],再用物理或化学方法从基底上剥离,常常会造成薄膜的破碎.TiO2分级微纳结构则是同时具有纳米尺度和微米尺度对应的特征和性能,在纳米尺度上可以提高催化剂的比表面积,有利于在光催化反应过程中光子的捕获,而在微米尺度上作为一个整体相对于纯纳米材料易于沉降分离,有利于回收[13-14].此外,还有一种非常有前景的方法是采用磁性负载光催化材料,以超顺磁性材料作为载体,把TiO2包覆在其外面,利用磁场进行分离回收,从而解决TiO2光催化材料回收的问题.相比于前面描述的方法,这种磁性负载型的TiO2材料制备上简单、回收工艺更为简便,将有利于实现光催化技术在实际工业废水处理中的规模化应用.本论文用化学共沉淀法合成的磁性纳米Fe3O4作为磁核,通过溶胶-凝胶法,在没有氮气的保护下合成了TiO2/Fe3O4磁性光催化剂,研究了制备条件对材料磁性能和光催化性能的影响,并通过引入中间层改性制备TiO2/SiO2/Fe3O4光催化剂,研究了2种材料的光催化反应动力学,并进行表征.
1 试验方法
1.1 化学共沉淀法制备Fe3O4纳米磁性颗粒
在室温下将FeCl2·4H2O和FeCl3·6H2O按一定的物质的量比溶于蒸馏水中,氨水作为沉淀剂,在40℃下进行化学共沉淀反应,反应如下[15]:
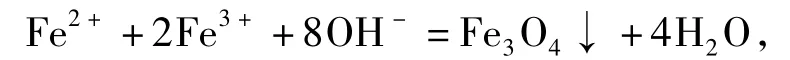
反应结束后磁力沉降,倒出上层清液,先用蒸馏水洗涤产品3次,再用稀盐酸洗到中性后,抽滤,将Fe3O4颗粒放入烘箱中,40℃烘干,备用.
1.2 溶胶-凝胶法负载TiO2
准确称量一定量Fe3O4颗粒于三口瓶中,加入无水乙醇,以钛酸丁酯作为前驱体,具体制备过程见文献[16],在40℃下搅拌,发生如下反应:
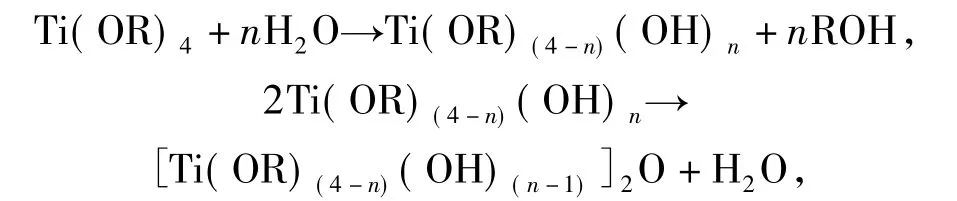
生成的TiO2直接包裹在Fe3O4颗粒表面,然后放入烘箱中80℃干燥,研细,在马弗炉中450℃煅烧2 h,制得磁性负载型光催化材料TiO2/Fe3O4.
1.3 TiO2/SiO2/Fe3O4光催化材料制备
SiO2由于其热稳定性、化学不活泼性和具有较高的表面积,而成为最普遍的一种催化剂支撑材料[17].本文将SiO2作为中间层,制备TiO2/SiO2/Fe3O4光催化材料.准确称量一定量Fe3O4颗粒于三口瓶中,加入无水乙醇,以正硅酸乙酯为前驱体,滴入氨水和乙醇的混合液,滴加完毕后继续反应1.5 h,反应如下[18]:

生成的颗粒清洗后,40℃烘干,制得SiO2/Fe3O4纳米材料.然后参照1.2的方法负载 TiO2,制备出TiO2/SiO2/Fe3O4纳米光催化材料.
1.4 表征方法
使用AVATAR FT-IR360型红外光谱仪(FT-IR)测定样品的红外吸收光谱;使用TECNAI G212型透射电子显微镜(TEM)观测样品颗粒的形貌特征及其显微结构;使用XD-2型X射线衍射仪(XRD)测定样品的晶型和晶粒尺寸;使用7404型振动样品磁强计(VSM)测定材料的磁性能.
1.5 光催化活性评价
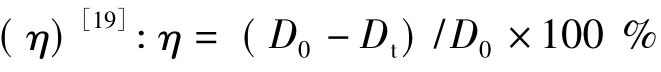
2 结果与分析
2.1 pH对TiO2/Fe3O4光催化性能的影响
调节负载TiO2时的pH,制备TiO2/Fe3O4光催化材料,并进行光催化降解试验,1 h后的脱色率结果见图1.从图1看出,当pH=1或2时,甲基橙脱色率均在95%左右,即得到的TiO2/Fe3O4光催化活性很高.这是因为在该pH范围内,钛酸丁酯水解速度合适,生成的纳米级TiO2包裹在Fe3O4上的量多而且均匀,因而脱色率高;pH过高,钛酸丁酯水解慢而且水解不完全,Fe3O4上包裹的TiO2的量过少,导致脱色率的下降.
虽然当pH=2时TiO2/Fe3O4的光催化率最高,但水解反应时间较长,而pH=1的条件下,钛酸丁酯完全水解仅需1~2 h,因此下面的材料都是在pH为1时制备.
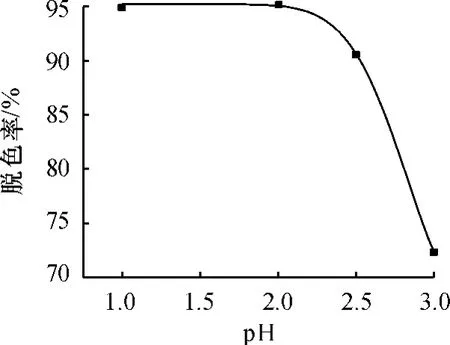
图1 pH对TiO2/Fe3O4材料光催化性能的影响Fig.1 Relationship between photocatalytic activity and pH on-TiO2/Fe3O4
2.2 负载比例对TiO2/Fe3O4光催化性能的影响
分别在 Fe3O4与 TiO2物质的量比为1∶1、1∶5、1∶10、1∶20 和 1∶30 的条件下制备 TiO2/Fe3O4光催化材料,并进行光催化降解试验.从图2中可以看出TiO2/Fe3O4的光催化性能并非随着TiO2量的增加而一直增大,而是在n(Fe3O4)∶n(TiO2)为1∶20时出现最大脱色率(94%).这是因为当形成核壳结构而TiO2的壳层厚度在一定范围内时,核中Fe3+的掺入形成了氧空位-点缺陷,当这些缺陷处于表面时,它既是表面的吸附活性位,又是光生电子的捕获中心;当它处于内部时,它可以使光生电荷分离.因此,这种空位的形成对催化剂的活性起促进作用[20].但是当表面包裹的TiO2过多时,产生过量的h+与e复合,形成的复合带影响了氢氧自由基的形成,降低了对光的利用率,导致催化降解效率(脱色率)下降,同时TiO2浓度过高时,颗粒在水中碰撞的机会大大增加,颗粒团聚使尺寸增大,也导致脱色率下降[21].
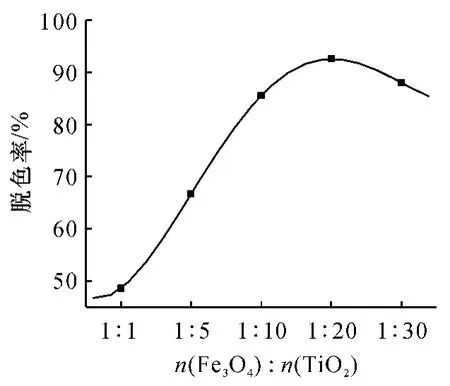
图2 不同Fe3O4与TiO2物质的量比对TiO2/Fe3O4材料光催化性能的影响Fig.2 Relationship between photocatalytic activity and the amount ratio of substance Fe3O4to TiO2on TiO2/Fe3O4
2.3 TiO2/Fe3O4和TiO2/SiO2/Fe3O4的光催化性能比较
测定改性前后的材料在不同时间下的脱色率,(图3),从图3中可以看出,2种材料在1 h的脱色率均达到90%以上.TiO2/SiO2/Fe3O4光催化材料的催化速率明显高于TiO2/Fe3O4材料,这与文献[21]的结论一致.这是因为无定形中间层SiO2的结构有利于增加比表面积[22],使负载TiO2能力大大增强,同时由于磁核在紫外区或可见光区的强吸光性[23],SiO2绝缘中间层的引入不仅可阻止这种负面效应,而且可避免电子反应、光溶解反应,并阻止热处理过程中磁核被氧化,还可增大TiO2与基体的附着力,增加循环使用时催化剂的脱色率[24].由图4可知,在3次使用之后,TiO2/SiO2/Fe3O4光催化材料的脱色率仍然在70%以上,而TiO2/Fe3O4的脱色率仅有40%左右,原因是Fe3O4与TiO2的直接接触导致了电子反应的发生,从而产生了光溶解现象,降低了光催化活性.

图3 2种纳米光催化材料的光催化性能Fig.3 Photocatalytic activity of two samples
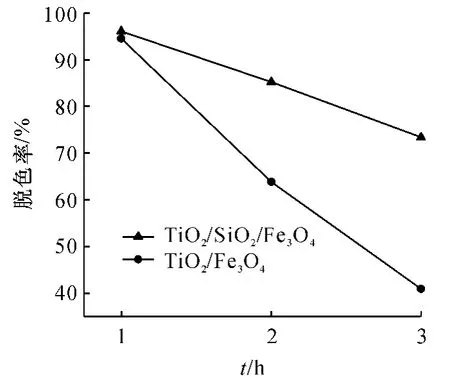
图4 2种纳米光催化材料循环使用后的光催化活性Fig.4 The recycling photocatalytic activity of two samples
将2种磁性负载光催化材料降解甲基橙反应的ln(c/cθ)随时间t的关系拟和后,如图5所示.由图5可以看出,2种材料的降解反应都属于一级动力学反应,满足 ln(c/cθ)-t成线性关系,TiO2/SiO2/Fe3O4和TiO2/Fe3O4的反应速率常数(K)分别为0.04886和0.04629 min-1,相关系数(R)分别为0.99736和0.99711.
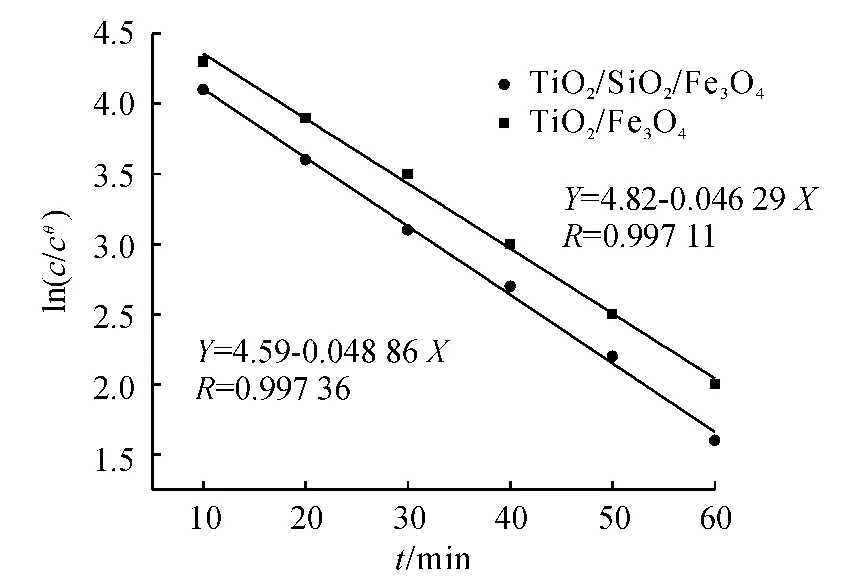
图5 TiO2/SiO2/Fe3O4和TiO2/Fe3O4降解甲基橙的速率曲线Fig.5 The degradation rate curves of TiO2/SiO2/Fe3O4and TiO2/Fe3O4samples
2.4 磁性负载光催化材料的红外光谱分析
由图6中谱图a可以看出,578 cm-1处有较强的吸收峰,对应着Fe3O4中铁氧键(Fe O--)的特征峰;在700 cm-1左右无吸收峰,可知无亚铁氧键的特征吸收峰,即没有Fe2O3;3399 cm-1左右处的吸收峰是--OH 伸缩振动产生的,1631 cm-1是--OH 的弯曲振动引起的;3130 cm-1是--NH 伸缩振动产生的,1402 cm-1是它的弯曲振动,应该是残留的氨水引起的.
由图6中谱图b可以看出,同样有残留水和氨水的吸收峰.576 cm-1处为 Ti--O的吸收峰,与Fe3O4中Fe--O的特征峰重叠在一起,吸收峰明显增强,证明了TiO2的存在.
由图6中谱图c的TiO2/SiO2/Fe3O4红外吸收光谱可知,1100 cm-1处的吸收峰是Si--O--Si键的反对称伸缩振动,在 798 cm-1附近的吸收峰是键的对称伸缩振动[25],467 cm-1处的吸收峰对应于Si--O--Si键的弯曲振动,946 cm-1附近的吸收峰则归属于Si--O键的对称伸缩.576 cm-1也有Ti--O对应的吸收峰.
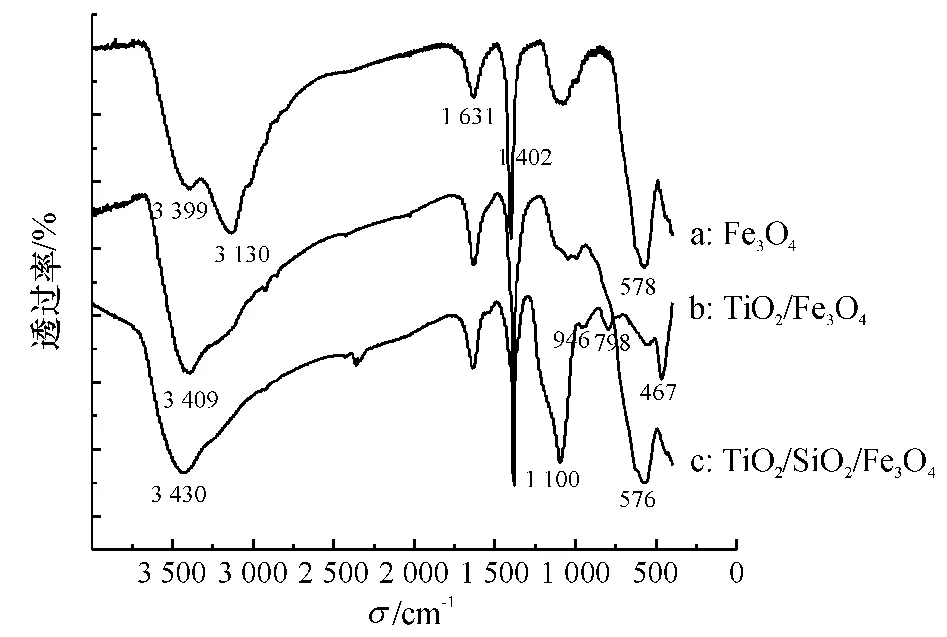
图6 Fe3O4、TiO2/Fe3O4和TiO2/SiO2/Fe3O4红外光谱图Fig.6 The IR spectra of Fe3O4、TiO2/Fe3O4and TiO2/SiO2/Fe3O4samples
2.5 磁性负载光催化材料TiO2/Fe3O4的XRD分析
对制备条件是 pH=1,反应温度为 35℃,n(TiO2)∶n(Fe3O4)=20∶1,反应时间 1.5 h,450 ℃煅烧2 h的材料进行XRD分析,结果见图7.衍射峰出现在 2θ为 30.15°、35.45°、43.08°、57.01°和 62.60°处,分别对应立方相 Fe3O4的(220)、(311)、(400)、(511)和(440)晶面,与标准谱图对比相差不大,且红外图谱中有对应的 Fe--O的特征峰出现,说明Fe3O4相 的 存 在.2θ在 25.28°、37.85°、48.52°、53.70°和 55.09°处,分别对应锐钛矿型 TiO2的(101)、(004)、(200)、(105)和(211)晶面,同时红外图谱中Ti--O的吸收峰的出现,说明了TiO2相的存在.
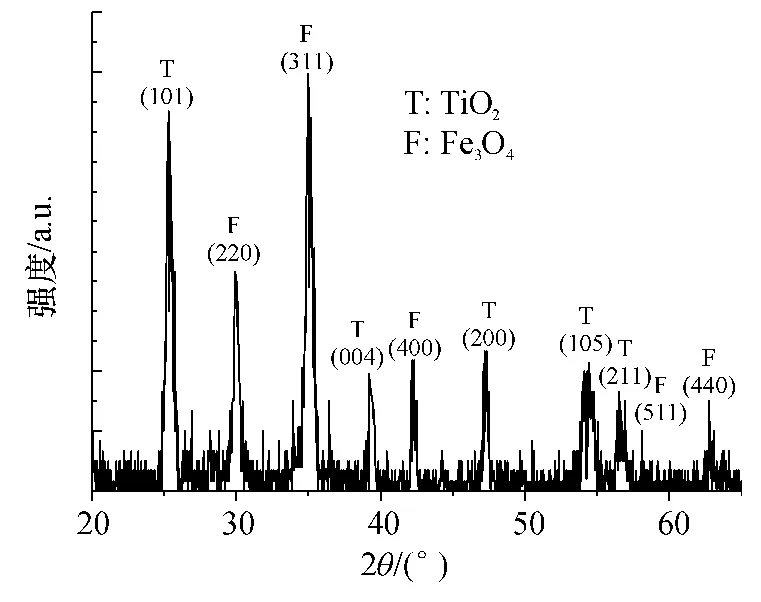
图7 TiO2/Fe3O4的XRD谱图Fig.7 XRD pattern of TiO2/Fe3O4sample
2.6 磁性负载光催化材料的磁性能
由图8磁滞回线可以看出,Fe3O4的饱和磁化强度约为60 A·m2·kg-1,而 TiO2/Fe3O4纳米光催化材料煅烧前的饱和磁化强度约为14 A·m2·kg-1,煅烧后约为12 A·m2·kg-1,包裹前后的材料都是超顺磁性.煅烧后饱和磁化强度进一步下降,可能是因为少量的Fe3O4被氧化为Fe2O3.使用3次后磁力沉淀,回收率仍达到85.6%.
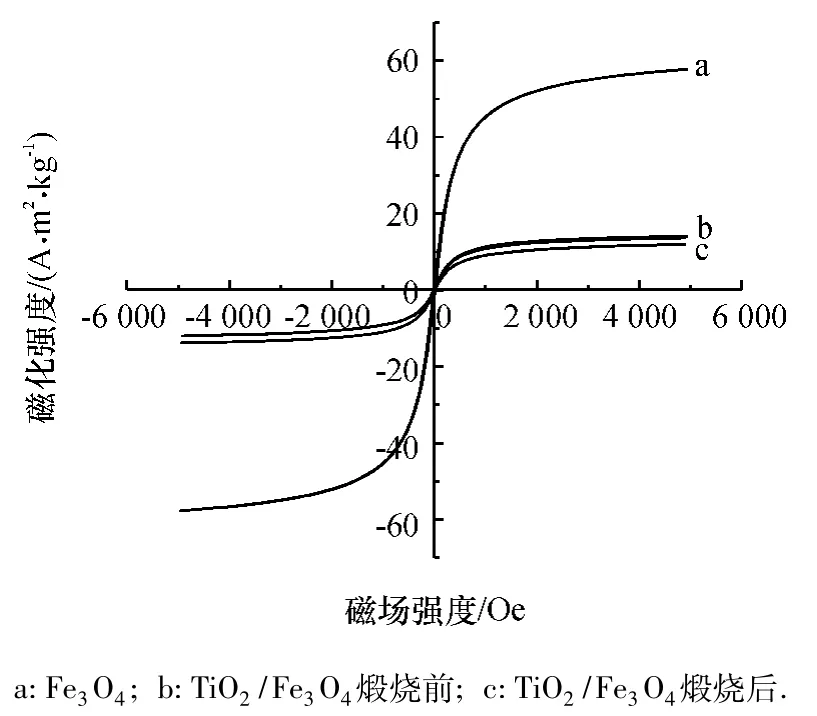
图8 Fe3O4和TiO2/Fe3O4450℃煅烧前、后的磁滞回线Fig.8 Magnetization curves of Fe3O4and TiO2/Fe3O4samples calcine
由图9可以看出,有SiO2中间层改性的TiO2/SiO2/Fe3O4光催化材料在煅烧前的饱和磁化强度约为34 A·m2·kg-1,比煅烧前 TiO2/Fe3O4的 14 A·m2·kg-1还高,原因是中间层的加入使得材料的颗粒增大,纳米颗粒的量子尺寸效应减少所致的.而煅烧后TiO2/SiO2/Fe3O4的饱和磁化强度约为18 emu·g-1,在负载量增大的情况下仍然有一些提高,原因是SiO2中间层能够一定程度上防止Fe3O4的氧化.
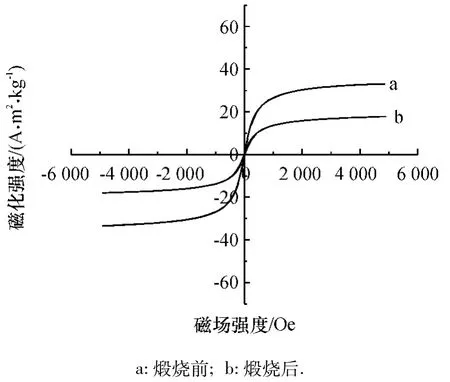
图9 TiO2/SiO2/Fe3O4煅烧前、后磁滞回线Fig.9 Magnetization curves of TiO2/SiO2/Fe3O4samples calcine
从图8、9可以看出,2种负载光催化剂不仅具有良好的磁学性能,而且都是超顺磁性,在磁场中易磁化,这为通过外加磁场进行分离和回收提供了条件.
2.7 磁性负载光催化材料的TEM分析
图10是Fe3O4颗粒的TEM图,颗粒呈球状,大小均匀,颜色比较深,发黑的地方是由于颗粒层叠在一起.从图11中可以看出,制备出的TiO2/Fe3O4溶胶中颗粒分散的非常均匀,大小在20 nm左右.外面浅色的一层为TiO2,里面深色的为Fe3O4,因而整个TEM图比图10颜色偏浅,说明TiO2包覆在了Fe3O4的表面,形成了核壳式的结构,但是也有一部分TiO2没有包覆在Fe3O4表面,在保证一定光催化活性的前提下,为了提高磁回收率,可以适当加大Fe3O4的加入量或是增加包裹的反应时间.而制备TiO2/SiO2/Fe3O4光催化材料的尺寸在35 nm左右,SiO2的负载量非常大,TiO2与SiO2颜色相近,不能明显的区分.与TiO2/Fe3O4纳米光催化材料的TEM对比,并不是均匀的球形,分散得不够理想.

图10 Fe3O4颗粒的TEM图Fig.10 TEM images of Fe3O4nanoparticles

图11 TiO2/Fe3O4颗粒(a)和TiO2/SiO2/Fe3O4颗粒(b)的TEM图Fig.11 TEM images of TiO2/Fe3O4(a)and TiO2/SiO2/Fe3O4(b)nanoparticles
3 结论
采用化学共沉淀法和溶胶-凝胶法制备磁性负载TiO2/Fe3O4光催化材料,实现了以磁性材料Fe3O4为核,将纳米TiO2包覆在其外部的核壳式结构,该复合材料具有纳米尺寸及超顺磁性,满足了磁性分离回收的条件,材料具有较高的光催化脱色率,1 h内对甲基橙脱色率达94.53%,3次使用后的磁性回收效率达85.6%.
引入SiO2中间层对TiO2/Fe3O4光催化材料进行改性后,显著提高了材料的饱和磁化强度和脱色速率,且使用多次后脱色率仍然在70%以上,改性前、后的材料对甲基橙降解反应都属于一级动力学反应.
[1]卢晓平,戴文新,王绪绪.纳米TiO2的负载化及其在环境光催化中的应用[J].应用化学,2004,21(11):1087-1092.
[2]AUGUGLIARO V,LITTER M,PALMISANO L,et al.Thecombination ofheterogeneousphotocatalysiswith chemical and physical operations:A tool for improving the photoprocess performance[J].Journal of Photochemistry and Photobiology:C:Photochemistry Reviews,2006,7(4):127-144.
[3]PELTON R,GENG Xing-lian,BROOK M.Photocatalytic paper from colloidal TiO2——fact or fantasy[J].Advances in Colloid and Interface Science,2006,127(1):43-53.
[4]SENTHILKUMAAR S,PORKODI K,VIDYALAKSHMI R.Photodegradation of a textile dye catalyzed by sol-gel derived nanocrystalline TiO2vita ultrasonic irradiation[J].Journal of Photochemistry and Photobiology:A:Chemistry,2005,170(3):225-232.
[5]BELLARDITA M,ADDAMO M,DI PAOLA A,et al.Photocatalytic activity of TiO2/SiO2systems[J].Journal of Hazardous Materials,2010,174(1/2/3):707-713.
[6]郭延红.活性炭负载TiO2光催化降解水中苯酚的研究[J].工业催化,2006,14(6):42-45.
[7]MA Ning,FAN Xin-fei,XIE Quan ,et al.Ag-TiO2/HAP/Al2O3bioceramic composite membrane:Fabrication,characterization and bactericidal activity[J].Journal of Membrane Science,2009,336(1/2):109-117.
[8]CISTON S,LUEPTOW R M,GRAY K A.Controlling biofilm growth using reactive ceramic ultrafiltration membranes[J].Journal of Membrane Science,2009,342(1/2):263-268.
[9]PRAKASAM H E,SHANKAR K,PAULOSE M,et al.A new benchmark for TiO2nanotube array growth by anodization[J].The Journal of Physical Chemistry:C,2007,111(20):7235-7241.
[10]WANG Jun,LIN Zhi-qun.Freestanding TiO2nanotube arrays with ultrahigh aspect ratio via electrochemical anodization[J].Chemistry of Materials,2008,20(4):1257-1261.
[11]ALBU S P,GHICOV A,MACAK J M,et al.Self-organized,free-standing TiO2nanotube membrane for flowthrough photocatalytic applications[J].Nano Letters,2007,7(5):1286-1289.
[12]WANG Wen-li,LIN Hong,LI Ji-bao,et al.Formation of titania nanoarrays by hydrothermal reaction and their application in photovoltaic cells[J].Journal of the American Ceramic Society,2008,91(2):628-631.
[13]LI Xiao-yun,CHEN Li-hua,LI Yu,et al.Self-generated hierarchically porous titania with high surface area:Photocatalytic activity enhancement by macrochannel structure[J].Journal of Colloid and Interface Science,2012,368(1):128-138.
[14]ZHENG Zhao-ke,HUANG Bai-biao,LU Ji-bao,et al.Hierarchical TiO2microspheres:synergetic effect of{001}and{101}facets for enhanced photocatalytic activity[J].Chemistry:A European Journal,2011,17(52):15032-15038.
[15]陈明洁,张汉昌,关志荣.化学共沉淀法制备Fe3O4纳米颗粒的结构和磁性能研究[J].材料导报,2008,22(专辑Ⅻ):94-96.
[16]寇生中,胡聪丽.纳米光催化剂TiO2/Fe3O4的制备及表征[J].应用化工,2008,37(1):67-73.
[17]WANG Li-yan,WANG Hong-xia,WANG Ai-jie,et al.Surface modification of a magnetic SiO2support and immobilization of a nano-TiO2photocatalyst on it[J].Chinese Journal of Catalysis,2009,30(9):939-944.
[18]刘晓林,张伟清,唐永兴,等.溶胶一凝胶工艺提拉法制备二氧化硅增透膜[J].光子学报,1998,27(1):29-33.
[19]方世杰,徐明霞,黄卫友,等.纳米TiO2光催化降解甲基橙[J].硅酸盐学报,2001,29(5):439-442.
[20]苏碧桃,张彰,郑坚,等.Fe3+掺杂的TiO2纳米复合粒子的合成及表征[J].化学学报,2002,60(11):1936-1940.
[21]GAD-ALLAH T A,SHIGERU K,SATOKAWA S,et al.Role of core diameter and silica content in photocatalytic activity of TiO2/SiO2/Fe3O4composite[J].Solid State Sciences,2007,9(8):737-743.
[22]LEE S W,DRWIEGA J,MAZYCK D,et al.Synthesis and characterization of hard magnetic composite photocatalyst Barium ferrite/silica/titania[J].Materials Chemistry and Physics,2006,96(2/3):483-488.
[23]GAO Yuan,CHEN Bao-hua,LI Hu-lin,et al.Preparation and characterization of a magnetically separated photocatalyst and it s catalytic properties[J].Materials Chemistry and Physics,2003,80(1):348-355.
[24]高俊宁,黄英,黄飞,等.核壳型磁载二氧化钛光催化剂研究进展[J].材料导报,2007,21(6):119-123.
[25]包淑娟,张校刚,刘献明,等.TiO2/SiO2/Fe3O4的制备及其光催化性能[J].应用化学,2004,21(3):261-265.
