黄曲条跳甲线粒体源硫辛酸蛋白连接酶的序列分析及表达
2012-03-05贺华良宾淑英廖泓之吴仲真林进添
贺华良,宾淑英,廖泓之,吴仲真,林进添
(仲恺农业工程学院农学院,外来有害生物预警与控制研究所,广东广州 510225)
硫辛酸(Lipoic acid,LA)亦称α-硫辛酸,为含硫八碳脂酸,在6,8位上有二硫键相连(C6和C8上的氢原子被二硫键取代),是一种类维生素物质.LA是三羧酸循环的2个重要酶系——丙酮酸脱氢酶复合物和α-酮戊二酸脱氢酶复合物的辅基,在能量代谢中发挥重要作用[1].动植物组织中LA通常与蛋白质分子以酰胺键形式共价结合[2],主要是由硫辛酸蛋白连接酶(Lipoate protein ligase,LPL)介导催化以共价键的方式将LA连接到一类含有硫辛酸结合结构域的蛋白分子上,即硫辛酸修饰(Lipoylation)[3].在原核生物中也发现了LPL的同系物.李斯特菌中LPL的同系物已被证实为毒力因子,它的缺失会使得细菌不能从宿主摄取硫辛酸,从而影响细菌的生长和毒力[4].肺炎链球菌的LPL的同系物对其粘附宿主细胞有抑制作用[5].对猪胰岛素的研究发现,其LPL同系物介导的蛋白硫辛酸修饰提高了胰岛素与受体的结合能力[6].硫辛酸与杀虫剂的作用发挥也有密切联系,如砷化物杀虫剂亚砷酸和2个脱氢酶系的一个辅基——硫辛酸的2个—SH相结合,从而中断三羧酸循环[7].目前,对于部分被硫辛酸修饰的蛋白分子是否可被砷化物杀虫剂优先识别还不清楚.因此,研究LPL的基因表达及其功能,对于蛋白分子硫辛酸修饰以及砷化物杀虫剂对该类蛋白的结合力研究具有一定参考意义.
黄曲条跳甲Phyllotreta striolata(Fabricius)隶属鞘翅目叶甲科害虫,可为害多种植物,尤其喜食十字花科植物,已成为十字花科蔬菜生产中最难控制的世界性害虫之一[8-9].本研究团队尝试从蛋白硫辛酸修饰的角度,在分子水平研究影响黄曲条跳甲生物学特性的作用因子.本文首先关注介导蛋白硫辛酸修饰的LPL相应基因的cDNA序列及表达情况,为今后研究蛋白硫辛酸修饰,以及硫辛酸修饰与砷化物杀虫剂或其他新型农药作用发挥之间的关系提供宝贵的信息资源.
1 材料与方法
1.1 材料
1.1.1 供试昆虫饲养及取样 黄曲条跳甲交配期雌、雄成虫由仲恺农业工程学院昆虫学实验室提供.成虫采用芥菜Brassica juncea菜叶喂食饲养,光照培养箱的温度为 28℃、湿度为 75%、光照度为4 000 lx,光暗比14 h光∶10 h暗.黄曲条跳甲的组织取样过程如下:将3~5头黄曲条跳甲装入离心管中,在冰上放置5 min;在解剖镜载物台的载玻片上滴1滴冰上预冷的磷酸盐缓冲液(0.01 mol/L,pH 8.0),将休克的黄曲条跳甲置于液滴中;在黄曲条跳甲即将苏醒时快速解剖,分别收集触角、头(去除触角)、中肠、精巢、卵巢、前足、中足、后足等组织样品,雌虫和雄虫的组织样本分开.样品收集时先在1.5 mL离心管中放入磷酸盐缓冲液,待解剖收集满10头时,4 000 r/min离心2 min,除去各组织样本中的磷酸盐缓冲液,置液氮中速冻后保存于-80℃冰箱中,备用;各组织器官RNA总量的提取需要解剖80头以上的雌虫或雄虫.
1.1.2 分子生物学试剂 RNeasy® Plus Mini Kit购置Qiagen公司;Taq DNA聚合酶,PrimeScript®RT reagent Kit,DNA Fragment Purification Kit,MineBest Plasmid Purification Kit,pMD® 18-T,SYBR® Premix Ex TaqTM,500 bp DNA Ladder Marker,DL2 000 DNA Marker,均购自TaKaRa公司.
1.2 黄曲条跳甲RNA的提取和反转录
按照RNA抽提试剂盒(Qiagen公司)使用说明提取黄曲条跳甲不同组织的总RNA.经琼脂糖凝胶电泳和紫外分光光度计检测后,按照PrimeScript®RT reagent Kit反转录系统说明书以随机引物进行反转录获得cDNA,以此作为PCR和荧光定量PCR模板.
1.3 引物设计与合成
根据黄曲条跳甲转录组测序获得的黄曲条跳甲lpl基因(Pslpl基因)序列(JQ278008),设计和筛选符合要求的特异性引物Pslpl-F、Pslpl-R用于后续的实时荧光定量PCR反应.同时本研究以黄曲条跳甲的actin基因作为内参基因(引物为Ps-actin-F和Ps-actin-R).荧光定量所用引物序列如下,Pslpl-F:TGAAAGCCGTAGGATGGGAATA;Pslpl-R:CTGGGAACCAATCGTCTGTAGG;PCR产物长度为123 bp.内参actin基因的PCR扩增引物如下,Ps-actin-F:TAAACCCGACGAAAGCAATGT;Ps-actin-R:CGATTCCGAGAAAAGAACAGG;PCR产物长度为220 bp.
1.4 普通PCR扩增及荧光定量PCR
在离心管中加入以黄曲条跳甲成虫总RNA逆转录合成的cDNA(约1μg/μL)为模板1μL,再加入10×Ex Taq DNA聚合酶反应缓冲液2μL(含Mg2+)、正向和反向引物各 1μL(10 mol/L),2.5 mmol/L dNTP 1.5 μL,Ex Taq DNA 聚合酶0.2 μL(5 U/μL),加水至 20 μL,混匀离心后放入PCR仪扩增.PCR反应程序为:94℃变性3 min;接着进行35个循环,循环条件为94℃ 30 s,60℃30 s,72℃ 30 s;循环完毕后,72℃保温10 min.扩增产物用20 g/L琼脂糖凝胶电泳检测,回收目的片段.回收产物纯化后连接到pMD-18载体,进一步转化到感受态大肠杆菌DH5α中,经蓝白斑和氨苄筛选,重组质粒经扩大培养,提取质粒DNA用于检测及后续的荧光定量PCR.测序工作由广州英骏生物技术有限公司完成.
荧光定量 PCR采用 SYBR Green染料法,在LightCycler 480荧光PCR仪上进行扩增和数据分析.根据SYBR® Premix Ex TaqTM试剂盒的说明书,按20 μL的总反应体系(SYBR® Premix Ex TaqTM2×Buffer 10μL,上游引物 0.8 μL,下游引物 0.8 μL,双蒸水7.4μL,cDNA模板1μL),采用二步法进行,程序具体的参数设置如下:预变性,95℃ 5 min;扩增,95℃ 5 s,60℃ 20 s,40个循环;融解度分析,95℃ 30 s,65℃ 15 s;冷却,40℃ 1 s.试验样本的反应结束后,结合下文的标准曲线进行基因表达的绝对定量分析.
1.5 标准曲线的建立及定量分析
分别以actin基因经测序验证的阳性重组质粒pMD-Ps-jhip-1为模板,经10倍系列稀释成7个质量浓度梯度(5.0、5.0 × 10-1、5.0 × 10-2、5.0 × 10-3、5.0×10-4、5.0 ×10-5和 5.0 ×10-6ng/μL)以优化的反应条件进行Real-time PCR,重复3次,以达到荧光的阈值(Ct值)为横坐标,以稀释倍数的对数为纵坐标建立标准曲线.分析3个标准曲线内部的标准差,检验试验的可重复性.分别根据标准曲线计算出每次试验样本中目标基因的绝对定量.黄曲条跳甲各部位基因相对表达量=Pslpl基因的绝对定量/Ps-actin基因的绝对定量.
1.6 序列分析及系统发育分析
序列和数据搜索使用NCBI上的Blast在线程序;蛋白质序列分析采用ExPASy在线ScanProsite程序;蛋白质相对分子质量和等电点分析采用http:∥www.expasy.org/tools/pi-tool.html在线工具;分泌蛋白信号肽序列预测采用http:∥www.cbs.dtu.dk/services/SignalP在线程序进行;线粒体定位分析采用MitoProt v1.101在线软件(http:∥ihg.gsf.de/ihg/mitoprot.html);跨膜结构预测采用TMHMM 2.0(http:∥www.cbs.dtu.dk/services/TMHMM/)在线程序进行.
从NCBI上下载Pslpl基因的同源基因蛋白产物的氨基酸序列,使用Clustalx1.8软件对这些序列进行比对,输出后缀为*.phy格式的文件,采用分子进化遗传分析软件PHYLIP3.68进行遗传距离分析.
2 结果与分析
2.1 基因序列分析
应用高通量测序平台Illumina's Solexa Genome Analyzer II对交配期的黄曲条跳甲雌、雄成虫混合样本进行转录组测序,采用Soap denovo软件将每一个读取序列片段(Read)聚类拼接成单独基因(Unigene),再结合生物信息学软件进行靶标序列cDNA全长的判定[10].本文成功克隆鉴定到含完整开放阅读框的 Pslpl基因的 cDNA(Genbank登录号:JQ278008),cDNA序列总长度为1 641 bp,开放阅读框为1 182 bp,编码393个氨基酸.ExPASy在线预测其蛋白质相对分子质量为44 650.92,其蛋白序列的理论等电点为7.62.TMHMM 2.0在线预测也没有发现跨膜结构域;SignalP 4.0在线软件分析没有发现典型的分泌蛋白信号肽区段.但根据MitoProt v1.101分析表明,该蛋白分子的前13个氨基酸为线粒体信号肽(Mitochondrial targeting sequences,MTS),定位于线粒体的概率为99.21%.
2.2 Pslpl基因蛋白序列与同源基因蛋白序列相似
性及进化分析
黄曲条跳甲lpl基因(Pslpl基因)的推测蛋白产物(Ps_LPL)与其他5种不同昆虫(分别属于鞘翅目、鳞翅目、膜翅目、双翅目和同翅目)的LPL蛋白序列的相似性分析见表1.从表1可以看出,Pslpl基因蛋白产物与同属鞘翅目的赤拟谷盗的LPL蛋白的相似性最高,达67%;而与同翅目昆虫蚜虫的相似性偏低,相同的氨基酸数目也少得多.上述6种昆虫LPL序列中相同氨基酸的具体分布位置见图1.
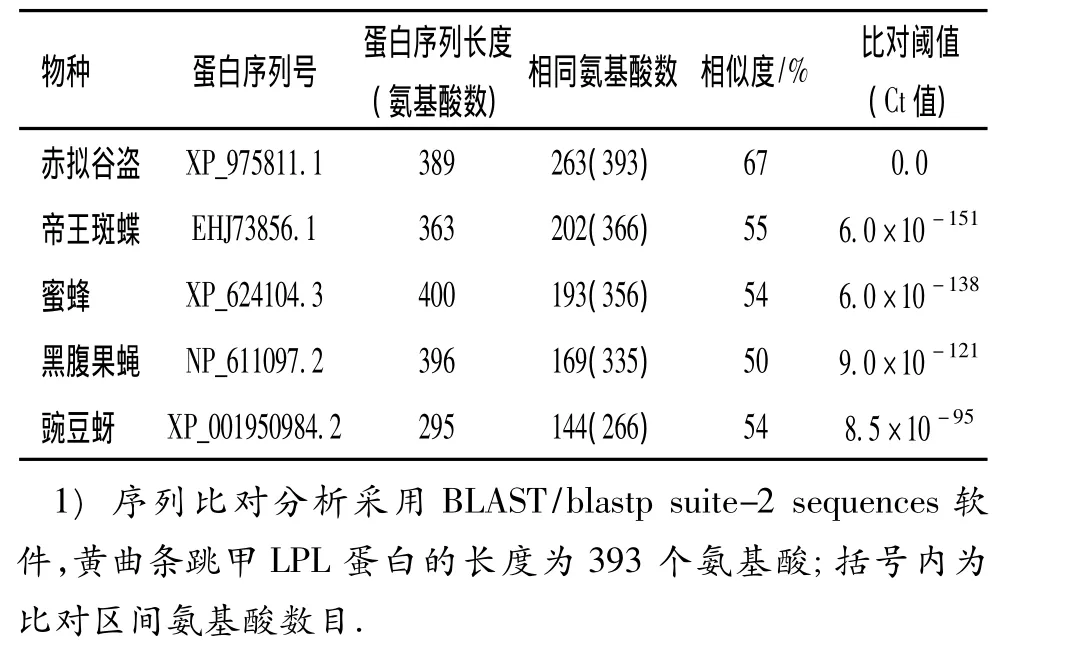
表1 黄曲条跳甲与其他5种昆虫LPL同源蛋白的相似性分析1)Tab.1 Sim ilarity analysis between Ps_LPL and other hom ologous p roteins from 5 different insects
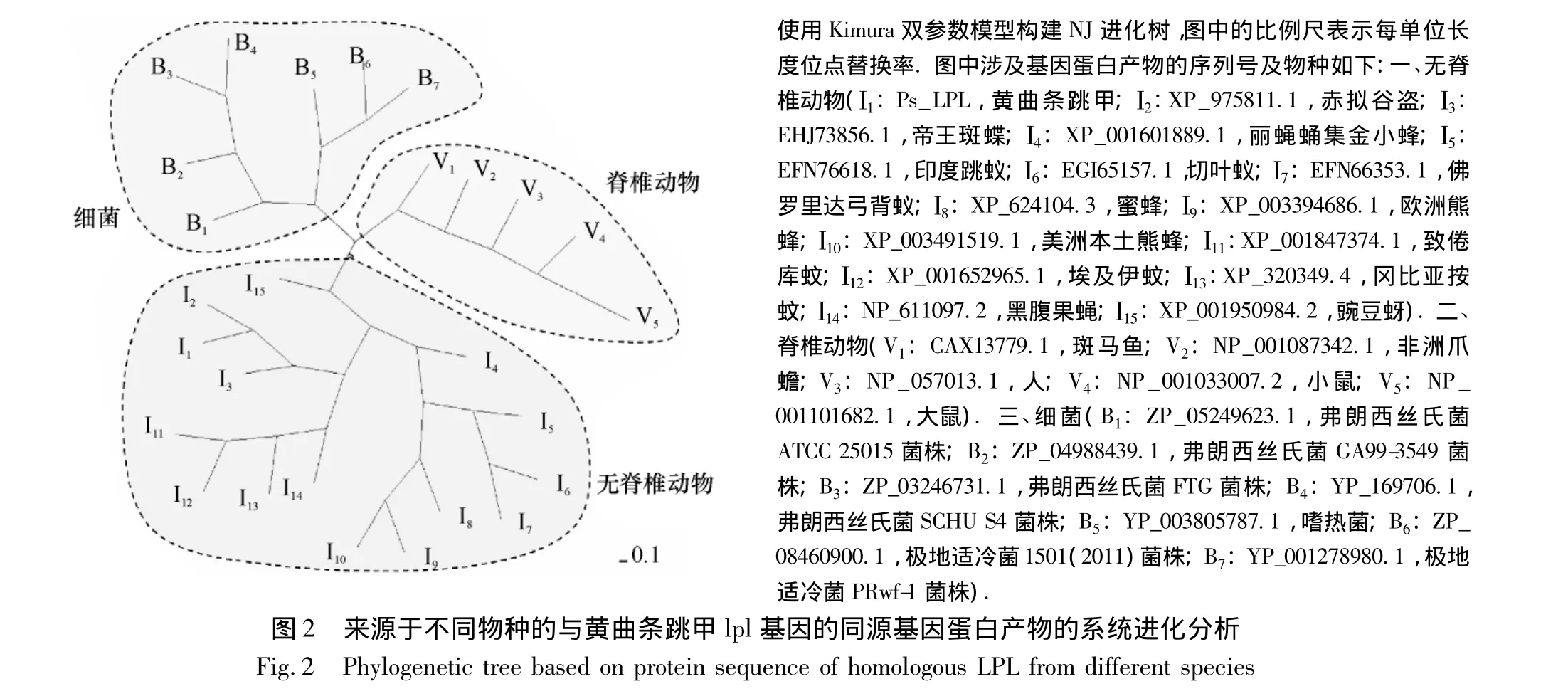
另外,在其他昆虫、细菌及脊椎动物等物种中也可找到Pslpl基因的同源基因.从图2中可以看出,细菌类、脊椎动物的LPL都各自聚类为一支;黄曲条跳甲的LPL(图2中I1)明显与其他昆虫的同源基因蛋白产物聚为一大支.图2中涉及的无脊椎动物主要涉及昆虫纲的几个目,包括:膜翅目的丽蝇蛹集金小蜂、美洲本土熊蜂、欧洲熊蜂、蜜蜂、印度跳蚁、切叶蚁和佛罗里达弓背蚁;双翅目的致倦库蚊、埃及伊蚊、冈比亚按蚊和黑腹果蝇;鞘翅目的赤拟谷盗;鳞翅目的帝王斑蝶;同翅目的豌豆蚜.相对来说,在膜翅目昆虫和双翅目昆虫中已报道的lpl基因的同源基因较多,而在鞘翅目中目前只在赤拟谷盗中报道了lpl同源基因.因此,黄曲条跳甲中lpl基因的鉴定,为研究昆虫的蛋白分子硫辛酸修饰提供了更有利和丰富的信息资源.

图1 6种昆虫LPL序列之间相同氨基酸的具体分布位置Fig.1 Location of identify amino acids of LPL between six different insects
2.3 Pslpl基因表达分析
参考贺华良等[10]前期的黄曲条跳甲转录组的结果,Pslpl基因cDNA的计算表达量为6.47拷贝数.结合转录组数据的整体分析结果表明,mRNA表达量在5.0~9.9拷贝数的基因数量占黄曲条跳甲转录组数据总和的29.5%.因此,Pslpl基因属于细胞中常规性表达基因类群的可能性较高.本文主要对Pslpl基因在不同组织中的表达量进行了分析.由图3可见,Pslpl基因的mRNA在黄曲条跳甲雌、雄成虫的不同组织器官中都有表达,且表现出一定的特点:1)雌、雄成虫各组织器官之间表达量相比发现,头部和中肠的表达量相对较高,而触角、前足、中足和后足的表达量相对较低.另外,雄虫睾丸中Pslpl基因的表达量比雄虫中肠的表达量要高,而雌虫卵巢Pslpl基因的表达量则低于其中肠的表达量.2)雌、雄成虫之间对比分析发现,除睾丸外,雄虫的其他组织器官Pslpl基因的表达量均比雌虫对应的组织器官中的表达量要低.荧光定量PCR数据分析表明,雄虫睾丸中Pslpl基因的表达量为雌虫卵巢中Pslpl表达量的2.5倍.
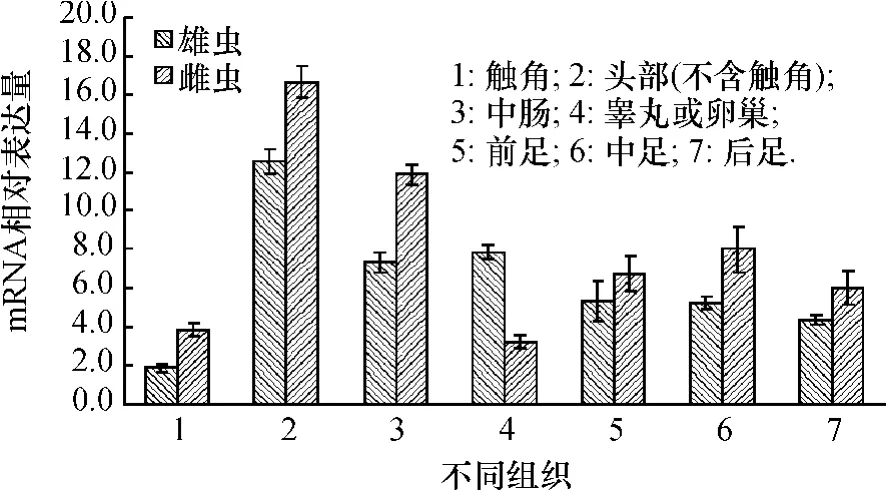
图3 黄曲条跳甲成虫不同组织中Pslpl基因mRNA的表达量Fig.3 mRNA relative levels in different tissues of adults of Phyllotreta striolata
3 讨论
对于LA,早先主要关注其作为辅酶所发挥的作用,到1990年以来,研究人员逐步发现LA具有强大的抗氧化能力、螯合重金属的能力以及再生其他抗氧化剂的能力.最近,研究还发现LA能起到延缓衰老的作用[11-12].动植物组织中LA通常与蛋白质分子共价结合,以酰胺键的形式存在[2].LPL对于LA在细胞中的存在状态及功能发挥可能起到了非常关键的作用.因此,Pslpl基因序列的鉴定及分析,对于在分子水平研究黄曲条跳甲不同组织器官内蛋白硫辛酸修饰具有促进作用.
LA含量最高的植物是菠菜,其次是番茄和甘蓝.有研究推测,人体LPL同系物蛋白可能能够将外源(例如食物)提供的LA直接连接到需要硫辛酰化的蛋白质上,从而不受体内LA合成途径的限制[13].甘蓝、芥菜和白菜等十字花科蔬菜是黄曲条跳甲的自然寄主,但目前寄主蔬菜的LA与黄曲条跳甲的蛋白硫辛酸修饰是否具有关联还不确定.因此,Pslpl基因的鉴定有助于研究寄主蔬菜LA含量变化和黄曲条跳甲蛋白硫辛酸修饰水平之间的关系.
有研究报道,在脊椎动物体内肝脏和肾脏组织中LA含量最高[2],但没有相关研究分析与其相关的LPL表达是否也在肝脏和肾脏中最高.本文对黄曲条跳甲Pslpl基因的表达谱研究发现,雌虫Pslpl基因在头部和中肠的表达量相对较高,而雄虫除在头部和中肠表达量较高外,其睾丸中的表达量也较高,初步推测与黄曲条跳甲精子发生相关的蛋白硫辛酸修饰需求相对较高.因此,结合LPL的功能,了解黄曲条跳甲生殖系统硫辛酸修饰的变化,深入探索对精子发生具关键作用的影响因子,可为黄曲条跳甲综合防治新策略研发提供新的思路.
[1]REED L J.A trail of research from lipoic acid to alpha-keto acid dehydrogenase complexes[J].JBiol Chem,2001,276(42):38329-38336.
[2]黄涛,黄开勋.α-L硫辛酸的生物医学功能[J].生命的化学,2004,24(1):58-60.
[3]崔高峰.生物素/硫辛酸结合蛋白和RNA剪切因子Sans-Fille结构与功能的多维核磁共振研究[D].北京:北京大学.2005.
[4]O’RIORDAN M,MOORSM A,PORTNOY D A.Listeria intracellular growth and virulence require host-derived lipoic acid [J].Science,2003,302:462-464.
[5]杨晓亮,尹楠林,庞丹,等.假想的脂蛋白连接酶对肺炎链球菌毒力的影响[J].微生物学报,2010,50(6):774-779.
[6]黄涛,黄开勋.硫辛酸修饰胰岛素与胰岛素受体的结合能力[J].中国生化药物杂志,2006,27(2):65-68.
[7]赵善欢.植物化学保护[M].3版.北京:中国农业出版社,2000.
[8]FEENY P,PAAUKE KL,DEMONG NJ.Flea beetles and mustard oils:Host plant speecificity of Phylloterta cruciferae and P.striolata adults(Coleoptera:Chrysomelidae)[J].Ann Entomol Soc Am,1970,63(3):832-841.
[9]张茂新,凌冰,梁广文.十字花科蔬菜上黄曲条跳甲种群动态调查与分析[J].植物保护,2000,26(4):1-3.
[10]贺华良,宾淑英,吴仲真,等.基于solexa高通量测序的黄曲条跳甲转录组学研究[J].昆虫学报,2012,55(1):1-11.
[11]SMITHA R,SHENVISV,WIDLANSKY M,et al.Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress[J].Curr Med Chem,2004,11:1135-1146.
[12]叶文锐,仲伟鉴,肖萍,等.硫辛酸延缓衰老作用的研究进展[J].环境与职业医学,2009,26(3):308-311.
[13]JOHNW,CAMPELL JE.CRONAN JR.Bacterial fatty acid biosynthesis:Targets for antibacterial drug discovery[J].Ann Rev Microb,2001,55:305-332.
【责任编辑周志红】
