犬瘟热病毒水貂株H与F蛋白基因原核表达重组质粒的构建及表达
2012-03-05苏凤艳温铁峰王全凯
苏凤艳,温铁峰,宗 颖,王全凯
(吉林农业大学中药材学院,吉林长春 130118)
犬瘟热(Canine distemper,CD)系由副粘病毒科麻疹病毒属犬瘟热病毒(Canine distemper virus,CDV)引起的一种急性、热性、高度接触性传染病.由于CDV呈世界性分布,自然感染宿主种类广泛,且可在大量不相关的动物种类间交叉感染,因此,消灭CDV几乎是不可能的[1],但可以利用疫苗进行人工主动免疫控制犬瘟热.目前常用的犬瘟热疫苗有CDV灭活疫苗、MV疫苗、CDV弱毒疫苗,但是CDV灭活疫苗和MV疫苗不能给动物提供持久的保护力,而CDV弱毒疫苗的稳定性较差,接种后易受母源抗体的干扰,对某些免疫缺陷动物和野生动物不安全,具有散毒的危险[2-4].特别是近年来研究表明CDV在不断发生变异,具有基因多样性[5].现已证明,目前流行的野毒株与标准的Covac、OP等疫苗株的抗原性、致细胞病变(CPE)类型、毒力等生物学特性方面存在部分差异[2-3,6].欧洲和日本等地区均有已免疫过的犬再次爆发犬瘟热[1,3,7]的现象.所以研制新型、安全、高效的疫苗以及检测犬瘟热的特异性诊断试剂已成为控制水貂犬瘟热的研究热点[8-9].CDV主要由6种结构蛋白构成,其中附着蛋白或血凝蛋白(Attachment protein or Hemagglutinin protein,H)在吸附和侵入宿主细胞过程中起重要作用,它介导融合蛋白(Fusion protein,F)与细胞发生融合反应,而F蛋白可介导囊膜与细胞膜囊合[10-11],是感染性病毒粒子进入宿主细胞所必需的,是犬瘟热病毒的主要保护性抗原.因此,本研究构建了水貂源犬瘟热病毒H和F蛋白基因原核表达质粒,并在大肠埃希菌Escherichia coli中进行表达,对其反应原性进行了研究,为进一步研究其作为疫苗候选分子的可能性奠定基础.
1 材料与方法
1.1 毒株、菌株和质粒
CDV由吉林农业大学经济动物基因工程实验室利用Vero传代细胞,从1只临床疑似犬瘟热的病死水貂肝脏中分离获得,经系统的病毒学鉴定后保存[12];均 E.coli JM109 由吉林农业大学中药材学院经济动物基因工程实验室保存;pMD-18T克隆载体和pET28a(+)原核表达载体为TaKaRa公司产品.
1.2 工具酶、试剂和抗体
Bam HⅠ、KpnⅠ、XhoⅠ、RT-PCR 试剂盒和核酸相对分子质量标准为TaKaRa公司产品;RNAgentsRTotal RNA Isolation System Kit为Promega公司产品;IPTG为Sigma公司产品;DNA凝胶回收纯化试剂盒、质粒DNA回收和纯化试剂盒为杭州维特洁生化技术有限公司产品;PVDF转移膜为Gleman公司产品.兔抗CDV阳性血清由吉林省左家特产研究所赠送.
1.3 引物的设计与合成
根据GeneBank中 Messling等[13]发表的 Onderstempoort疫苗株(AF378705)H基因序列和F基因序列,利用Gene runner软件设计引物,预期扩增的H基因和F基因片段长度分别为843和1 067 bp.H基因上游引物:5'-CGGATCCAGGATAATGCAAGAGCC-3';H基因下游引物:5'-GCTCGAGAAGCCAGTGTCAACTCAC-3'.F基因上游引物:5'-GGGTACCTCCAACCTCAATGCTCAAG-3';F基因下游引物:5'-CGGATCCAGAGCGCCTAACCGTCTC-3'.
在H基因上、下游引物5'端分别引入Bam HⅠ和XhoⅠ酶切位点.在F基因上、下游引物5'端分别引入KpnⅠ和Bam HⅠ酶切位点.引物由上海生物工程生物技术服务有限公司合成.
1.4 CDV的增殖及RNA的提取
将长满单层的非洲绿猴肾(Vero)细胞培养液弃去,接种CDV水貂分离株,37℃感作1 h后,弃去病毒液.加入含体积分数为2%胎牛血清的RPMI 1640培养液,37℃条件培养72 h.按试剂盒说明提取CDV总RNA,-20℃条件保存.
1.5 CDV H和F蛋白基因的扩增及纯化
以犬瘟热病毒RNA为模板,对H和F基因进行扩增.RT反应总反应体系为10.00μL:MgCl22.00 μL,10× RT 缓冲液 1.00 μL,ddH2O 0.75 μL,dNTP 1.00 μL,RNase抑制剂0.25 μL,AMV 0.50 μL ,下游引物0.50μL,模板RNA 4.00μL.反转录条件:42℃ 20 min,99℃ 5 min,5℃ 5 min.PCR反应体系为50.00μL:5×PCR缓冲液10.00μL,Ex Taq E 0.25 μL,上游引物0.50 μL,ddH2O 34.25 μL,RT 产物5.00 μL.反应条件:94℃预变性2min;94℃热变性30 s,60℃退火30 s,72℃延伸1min,共35个循环;最后72℃延伸10 min.扩增产物用10 g/L琼脂糖凝胶电泳鉴定,并以DNA凝胶回收纯化试剂盒进行纯化.
1.6 重组克隆质粒pMD-18T-H和pMD-18T-F的构建与鉴定
纯化的PCR产物与pMD-18T simple vector于16℃连接8 h,构建重组质粒pMD-18T-F和pMD-18TH,连接产物转化E.coli JM109.E.coli JM109感受态的制备(CaCl2法)和转化参照文献[9]进行.通过α-互补法挑取白色菌落,接种于含Amp的液体培养基中,37℃振荡培养过夜.碱裂解法小量提取质粒,并进行双酶切鉴定,选取阳性克隆送至大连宝生物公司测序.
1.7 原核表达重组质粒pET28a-H和pET28a-F的构建与鉴定
以Bam HⅠ和XhoⅠ双酶切重组克隆质粒pMD-18T-H和pET28a(+)载体,以KpnⅠ和Bam HⅠ双酶切重组克隆质粒pMD-18T-F和pET28a(+)载体,切胶回收后,按照体积比(载体∶插入片段=1∶3)取适量线性化载体pET28a(+)和CDV H和F基因片段混匀,加入T4DNA连接酶于连接反应体系中,16℃连接8 h,构建原核表达质粒pET28a-H和pET28a-F.连接产物转化E.coli DH5α感受态细菌,转化产物涂布于LB琼脂平板.以碱裂解法小量提取质粒进行双酶切鉴定.
1.8 目的基因的诱导表达
将阳性原核表达质粒pET28a-H和pET28a-F转化至E.coli Rosetta2(DE3)宿主菌感受态细胞,均匀涂于含Kan的LB琼脂平板上,37℃条件培养过夜.
挑取单个转化菌落接种于5 mL含Kan的LB液体培养基中,37℃ 200 r/min培养过夜.取2 mL接种于100 mL含Kan的LB液体培养基中,37℃ 250 r/min培养至D600nm为0.6~0.8.加IPTG至终浓度为1mmol/L诱导表达,37℃ 250 r/min振荡培养,分别于诱导前、诱导后5 h、诱导后10 h收集菌液.以同样的方法诱导含空载体 pET28a(+)的 E.coli Rosetta2(DE3)10 h作对照.收集的菌液进行SDSPAGE和Western-blot分析.
2 结果与分析
2.1 CDV H和F蛋白基因的获得
利用所设计的引物,采用RT-PCR反应分别扩增出了840 bp左右的CDV H基因片段(图1a)和1 060 bp左右的CDV F基因片段(图1b),与预期DNA片段大小相符.
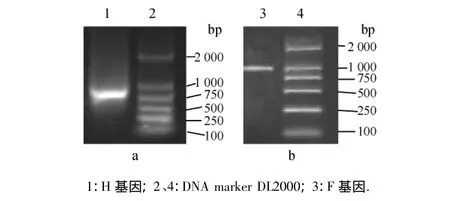
图1 分离株的H和F基因片段RT-PCR扩增结果Fig.1 RT-PCR products of H and F genes fragments from isolated strains
2.2 克隆质粒的酶切鉴定
以KpnⅠ和Bam HⅠ限制性内切酶双酶切重组质粒pMD-18T-F,得到约2 700 bp的pMD18-T线性片段和约1 000 bp的插入片段(图2a).以Bam HⅠ和XhoⅠ限制性内切酶双酶切重组质粒pMD-18T-H,得到约2 700 bp的pMD18-T线性片段和约850 bp的插入片段(图2b).序列分析结果表明,成功地克隆了CDV H蛋白基因和F蛋白基因.
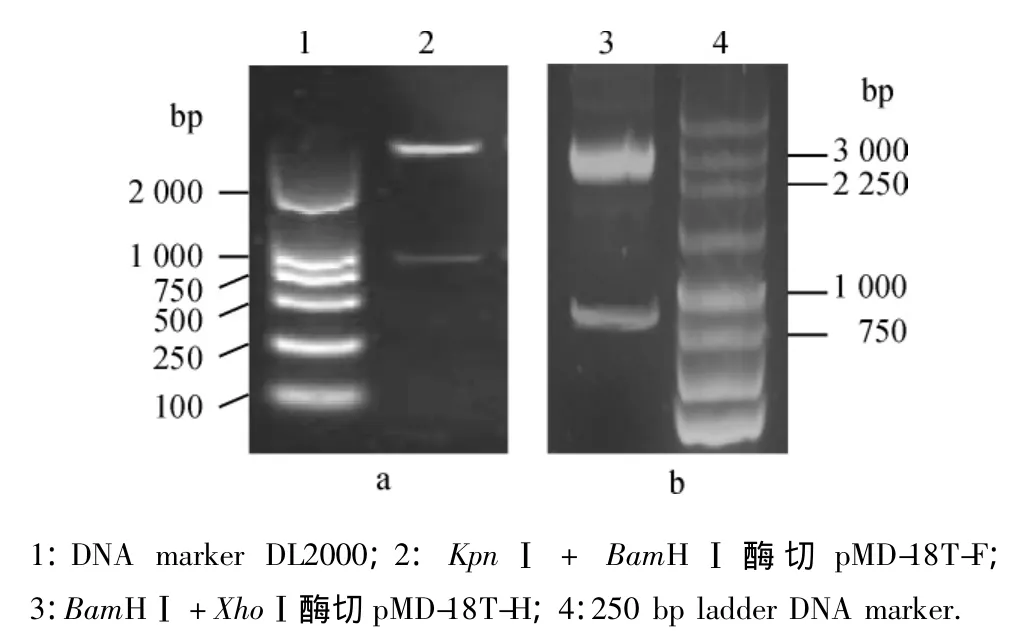
图2 pMD-18T-F和pMD-18T-H的酶切鉴定结果Fig.2 Restriction endonudeases analysis of pMD-18T-F and pMD-18TH
2.3 原核重组表达质粒pET28a-H和pET28a-F的酶切鉴定
对pET28a-H和pET28a-F质粒分别进行双酶切后,得到了约5 400 bp的pET-28a(+)的线性片段及约850和1 000 bp的插入片段(图3).说明成功地构建了原核重组表达质粒pET28a-H和pET28a-F.
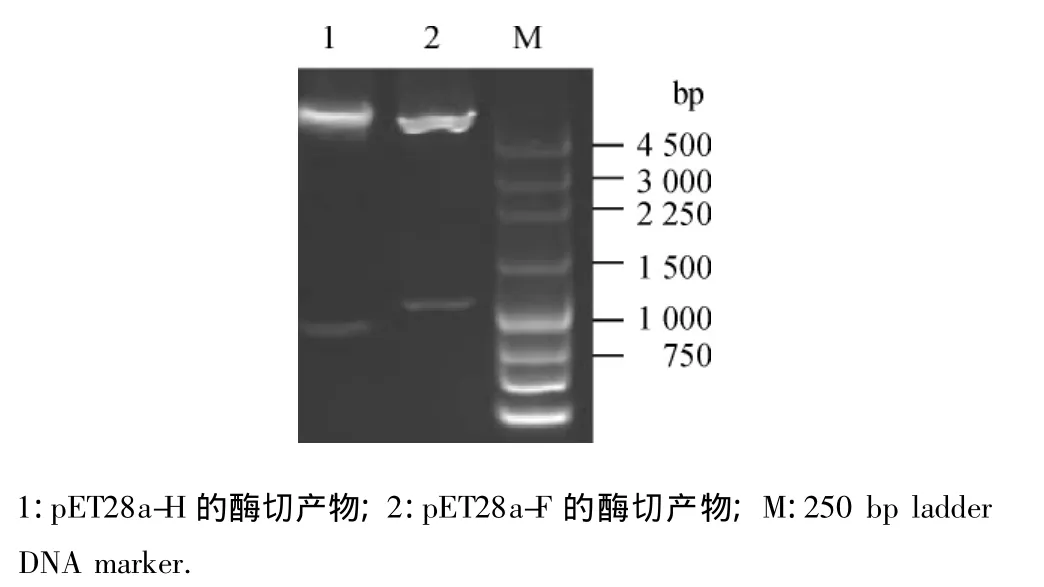
图3 原核重组表达质粒的酶切鉴定Fig.3 Analysis of recombinant prokaryotic expression plasmids by restriction enzyme cleavge
2.4 SDS-PAGE 分析
在E.coli BL21(DE3)中,重组表达质粒pET28a-H和pET28a-F由IPTG诱导表达,经SDS-PAGE电泳分析,重组表达质粒在E.coli BL21中均表达融合蛋白,其相对分子质量分别约为31 400和38 200,与预测大小相符(图4).
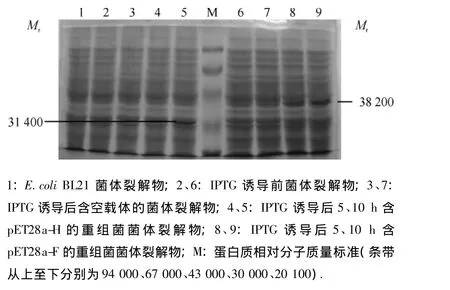
图4 重组表达质粒在Escherichia coli BL21中的表达Fig.4 Recombinant expression plasmids expressed in E.coli BL21
2.5 W estern-blot分析
表达产物经SDS-PAGE后,电转移至PVDF膜上,以犬瘟热多克隆抗体为一抗,HRP标记的山羊抗兔IgG为二抗,联苯胺(DAB)为底物,进行蛋白印迹分析,结果如图5,在相对分子质量为31 400和38 200处分别有1条明显的蛋白印迹带,表明H和F蛋白基因片段经原核表达后,表达产物具有与CDV抗血清结合的反应原性.
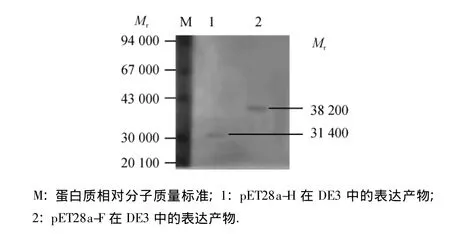
图5 表达产物的Western-blot分析Fig.5 Western-blot analysis of expression products
3 讨论
犬瘟热在世界分布广泛,不仅影响动物养殖业的发展,而且给经济贸易带来了严重影响.因此,建立一种快速、准确的诊断方法及研制更为安全有效的疫苗迫在眉睫.
CDV结构蛋白中,F蛋白位于CDV囊膜上,呈纤突状,是CDV病毒感染细胞所必须的成分,是刺激机体产生中和抗体的重要抗原,F蛋白诱导的免疫反应能阻止病毒感染,并且在有病毒增殖的情况下可抑制症状的发生.而且该蛋白基因相对比较保守[14],在诊断上亦具有一定的价值,其抗体可用于CDV感染的诊断或流行病学调查.CDV的H蛋白决定着病毒感染的趋向性和致细胞病变[15],是决定融合效率的主要决定因子.
本试验以CDV的H、F蛋白基因为研究对象,采用PET-28a原核表达系统成功表达了H蛋白和F蛋白.Western-blot检测结果显示,重组融合蛋白能够被CDV阳性血清识别,而与阴性血清无反应,表明重组融合蛋白具有良好的反应原性,可作为CDV ELISA检测法包被抗原.该结果为下一步研究CDV基因结构及其蛋白功能,以及利用所表达的蛋白研制基因工程亚单位疫苗等工作奠定了基础.
[1]LAN N T,YAMAGUCHIR,INOMATA A,et al.Comparative analyses of canine distemper viral isolates from clinical cases of canine distemper in vaccinated dogs[J].Vet Microbiol,2006,115(1/2/3):32-42.
[2]HARDER TC,KENTER M,VOSH,et al.Canine distemper virus from diseased large felids:Biological properties and phylogenetic relationships[J].JGen Virol,1996,77(3):397-405.
[3]IWATSUKIK,MIYASHITA N,YOSHIDA E,et al.Molecular and phylogenetic analyses of the haemgglutinin(H)proteins of field isolates of canine distemper virus from naturally infected dogs[J].JGen Viro1,1997,78(2):373-380.
[4]BOLTG,JENSEN T D,GOTTSCHALCK E,et al.Genetic diversity of the attachment(H)protein gene of current filed isolates of canine distemper virus[J].JGen Virol,1997,78(2):367-372.
[5]苏凤艳,宗春苗,王卓聪,等.水貂株犬瘟热病毒H基因的遗传多样性分析[J].上海交通大学学报,2009,28(6):541-547.
[6]何洪彬,李金中,夏咸柱,等.犬瘟热病毒小熊猫株附着蛋白基因的序列分析[J].中国预防兽医学报,1999,21(6):423-427.
[7]BLIXENKRONE-MØLLER M,SVANSSON V,HAVE P,et al.Studies on manifestations of canine distemper virus infection in an urban dog population[J].Vet Microbiol,1993,37(1/2):163-173.
[8]苏凤艳,宗春苗,王卓聪,等.水貂株犬瘟热病毒F基因工程疫苗的免疫特性研究[J].上海交通大学学报,2010,28(2):102-106.
[9]BERGMAN JG,MUNIZM,SUTTON D,etal.Comparative trial of the canine parvovirus,canine distemper virus and canine adenovirus type 2 fractions of two commercially availablemodified live vaccines[J].Vet Rec,2006,159(22):733-736.
[10]HORVACH C M,PATERSON R G,SHAUGNESSY M A,et al.Biological activity of paramyxovirus fusion proteins:Factors influencing formation of syncytia[J].J Virol,1992,66(7):4564-4569.
[11]WILD T F,FAYOLLE I,BEAUVERGER P,et al.Measles virus fusion:role of the cysteine-rich region of the fusion glycoprotein[J].JVirol,1994,68(11):7546-7548.
[12]苏凤艳,魏吉祥,王卓聪,等.犬瘟热病毒水貂株的分离与鉴定[J].东北林业大学学报,2010,38(2):79-82.
[13]VON MESSLING V,ZIMMER G,HERRLER G,et al.The hemagglutinin of canine distemper virus determines tropism and cytopathogenicity[J].J Virol,2001,75(14):6418-6427.
[14]MERZ D C,SCHEID A,CHOPPIN PW.Importance of antibodies to the fusion glycoproteins of paramyxoviruses in the prevention of spread of infection[J].JExp Med,1980,151(2):275-288.
[15]GILLESPIE JH,TIMONCY J F.家畜传染病[M].胡祥壁等译.7版.北京:农业出版社,1998:770-784.
【责任编辑 李晓卉】
