Wistar大鼠卵巢颗粒细胞的分离、培养与鉴定
2012-11-10文利新李荣芳
肖 娟 邬 静,2 屠 迪,2 袁 慧,2 文利新,3 李荣芳※,2
由于卵巢颗粒细胞通过凋亡和激素分泌在生殖过程中起着非常重要的作用,因此对颗粒细胞的研究越来越受到人们的重视,加上生殖系统的调控机制相当复杂,很难直接通过动物实验探讨相关受试化合物的毒理学作用机制。因此,本次实验建立大鼠卵巢颗粒细胞体外原代培养体系,为研究毒物对生殖系统造成毒性的作用机理提供有效的体外模型。
1.材料与方法
1.1 实验动物 (21~29)天龄未成熟雌性wistar大鼠,体重80±20g,SPF级,由湖南斯莱克景达实验动物有限公司提供。
1.2 主要试剂 DMEM培养基购自Gibco公司。胎牛血清(FBS)购自四季青公司。孕马血清(PMSG)购自北京海德创业。四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)购自Amresco公司。大鼠孕酮(P)和雌二醇(E2)ELISA检测试剂盒购自Rapidbio.Lab公司。卵泡刺激素受体(FSHR)免疫组化检测试剂盒购自博士德公司。
1.3 主要仪器 倒置显微镜、生物显微镜,CO2培养箱、全自动高压灭菌器,超净工作台,台式离心机,多功能酶标仪。
2.方法
2.1 Wistar大鼠卵巢颗粒细胞的分离和培养 每只wistar大鼠一次性皮下注射PMSG 40IU,作用48小时,颈椎脱臼处死。打开腹腔,在无菌条件下迅速取出双侧卵巢,40倍解剖显微镜下眼科剪剪破有腔卵泡,轻轻拍打与挤压,使卵母细胞及颗粒细胞同时逸出,反复轻轻吹打使颗粒细胞释放进入预冷的DMEM培养基中。200目不锈钢细胞筛过滤,1000rpm、10分钟离心后,在含10%FBS的DMEM培养基中重悬并记数,苔盼蓝染色检测细胞活力,细胞活力>90%,调整细胞密度为1×105cells/ml,接种于6孔板,置于37℃,5%CO2浓度,饱和湿度培养箱中培养,每隔48小时更换培养液,倒置显微镜下观察、拍照。
2.2 Wistar大鼠卵巢颗粒细胞的鉴定
2.2.1 颗粒细胞的HE染色 取重悬的颗粒细胞接种于24孔板中,每孔接种1×105个细胞,放入CO2培养箱中,在37℃,5%CO2浓度,饱和湿度下进行培养,当细胞长至铺满盖玻片70%~80%时取出玻片;用PBS洗玻片,5分钟×3次;4%多聚甲醛固定20分钟,取出玻片,PBS洗玻片,5分钟×3次;苏木素染色2分钟,流水冲去浮色;入盐酸酒精中分色数秒,流水小心冲洗;显微镜下观察细胞核清晰,胞浆不着色;5%伊红染色(2~3)分钟,流水冲去浮色;梯度酒精脱水,二甲苯透明,中性树脂封面后显微镜下观察细胞形态,拍照。
2.2.2 免疫细胞化学法观察FSHR蛋白表达 用于检测的细胞爬片制作同前,4%多聚甲醛固定20分钟,固定好的玻片,PBS洗涤5分钟×3次;3%双氧水于室温下孵育5分钟,PBS洗涤5分钟×3次;加正常的山羊血清,封闭无关的抗原,室温下孵育20分钟,倾去不洗;于玻片上滴加一抗FSHR兔多克隆抗体(1∶200),置于湿盒中4℃过夜,PBS洗涤5分钟×3次;滴加二抗IgG,37℃孵育60分钟;PBS洗涤5分钟×3次。滴加辣根过氧化酶标记的链霉素工作液50μl,37℃孵育30分钟;PBS洗涤5分钟×3次。于玻片上滴加DAB显色液,在显微镜下观察控制显色时间;流水冲洗,苏木素复染(5~10)分钟;流水冲洗3次;常规梯度酒精脱水,二甲苯透明,中性树脂封片后显微镜下观察细胞形态,拍照。
2.2.3 颗粒细胞生长曲线的测定 取重悬的颗粒细胞接种于96孔板内,每孔接种2×104个细胞,每天接种4孔,连续接种8天,于第9天加入 MTT溶液10μL,置于CO2培养箱,37℃培养4小时后取出,小心用移液枪吸出上清液,每孔加入DMSO 150μL,于振荡器震荡10分钟,使细胞内MTT蓝紫色结晶完全溶解,在酶标仪570nm波长处进行比色、读数,测出每孔吸光度值(OD值),取4孔平均值,实验重复3次。以培养时间为横轴,吸光值为纵轴,绘制细胞生长曲线。
2.2.4 颗粒细胞激素分泌情况的测定 取重悬的颗粒细胞接种于24孔板内,每孔接种1×105个细胞,共接种3孔,加入不含血清的DMEM培养基(含有10ng/ml FSH、3ng/ml雄烯二酮),置于CO2培养箱中,在37℃,5%CO2浓度,饱和湿度下进行培养,每隔24小时更换并收集培养液放于-80℃保存,连续收集8天,最后进行孕酮(P)和雌二醇(E2)含量的检测,按照ELISA检测试剂盒的说明书进行操作。
3.结果
3.1 Wistar大鼠卵巢颗粒细胞的分离和培养 颗粒细胞从卵泡中释放出来时,镜下观察呈圆形,表面可见黑色颗粒,约(4~6)小时贴壁,48小时后置于倒置显微镜下观察,可见细胞生长呈星状或梭状,细胞与细胞间有延长的丝状伪足相互连接,细胞核大而圆,胞质富含空泡及颗粒,细胞聚集生长,96小时左右基本铺满培养瓶底部,见图1。
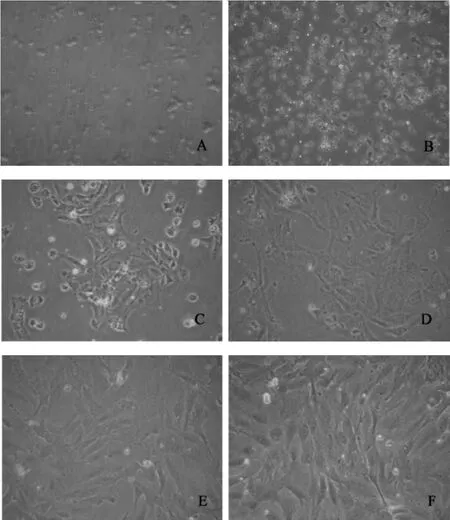
图1 大鼠卵巢颗粒细胞原代培养图(200×)
3.2 Wistar大鼠卵巢颗粒细胞体外生长曲线 MTT法测得的细胞生长曲线见图2。由图可见,卵巢颗粒细胞培养初期随着培养时间的延长而增殖,培养24小时内细胞处于贴壁生长适应期,24小时后OD值开始大幅度的增高,判断细胞迅速进入对数生长期,到120小时细胞生长极度旺盛,OD值达到最大值;随后逐渐下降,第168小时开始,出现类似成纤维细胞的形态,培养168小时以后,细胞开始退化,第192小时结束时的吸光度测定。
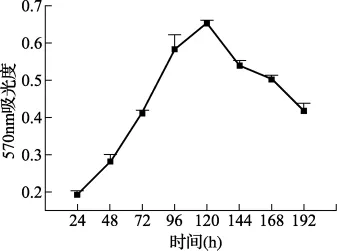
图2 颗粒细胞体外生长曲线
3.3 Wistar大鼠卵巢颗粒细胞的鉴定
3.3.1 HE染色 HE染色在镜下可见贴壁细胞形态完整,体积较大,边缘清晰,大小均一,呈多角形或梭形,细胞浆和细胞核染色均匀,核染深蓝色呈卵圆形或不规则形,位于细胞中央,胞浆淡红色并含有许多颗粒,见图3。
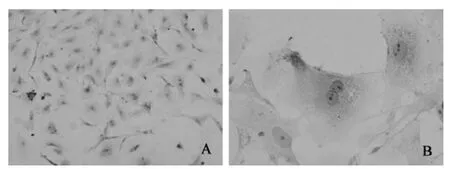
图3 颗粒细胞HE染色
3.3.2 FSHR免疫细胞化学法 FSHR阳性染色主要位于细胞胞浆,呈棕褐色着染,细胞核呈深蓝色,镜下可见FSHR的阳性率>90%(见图4),由此表明分离培养的颗粒细胞纯度达到90%以上。
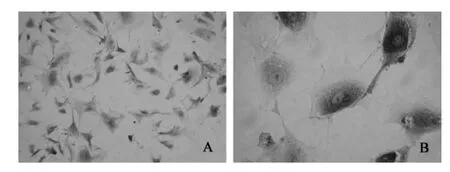
图4 颗粒细胞免疫细胞化学染色
3.3.3 颗粒细胞的激素分泌 ELISA法测得颗粒细胞P和E2的体外分泌情况见图5,激素的分泌趋势与细胞的生长情况基本一致,于在(96~120)小时左右达到峰值,随后逐渐下降。
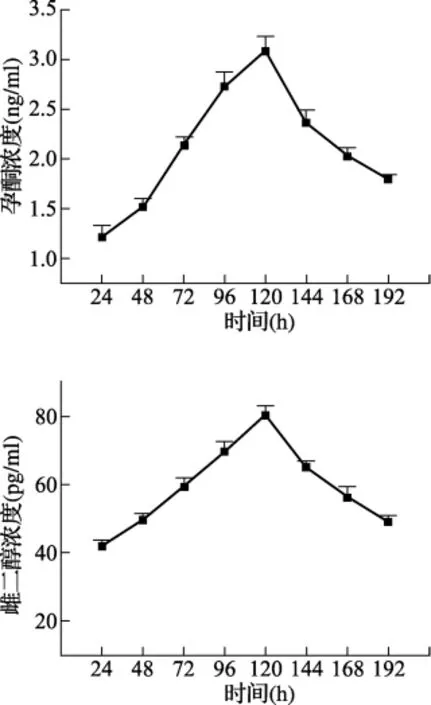
图5 颗粒细胞体外激素分泌情况
4.讨论
目前,研究者对卵巢细胞的培养已不仅仅应用于生殖生理方面的研究,在生殖病理、毒理等的研究方面也有重大的作用[1]。因此,研究颗粒细胞是研究卵母细胞成熟的一个很好的切入点[2]。体外培养的卵巢细胞为研究毒物对生殖系统造成毒性的作用机理提供了有效的体外模型。新生大鼠颗粒细胞在离体前未接触过内源性促性腺激素的刺激,采用PMSG刺激雌性wistar大鼠使之处于动情前期,获得大量相同发育阶段的颗粒细胞。体外培养(4~6)小时后颗粒细胞开始贴壁生长,(48~96)小时内细胞大量增殖,生长旺盛,并可获得较高的细胞存活率,实验结果与文献报道一致[3]。原代细胞培养的优势在于最大程度地保存了细胞的特性,使体外实验结果更符合于体内的情况。
卵巢颗粒细胞是雌性动物卵巢内唯一表达FSHR的细胞[4],可以应用FSHR免疫细胞化学染色对卵巢颗粒细胞的进行特异性染色。因此,本研究采用免疫细胞化学法鉴定颗粒细胞表面FSHR的表达,以此作为原代培养颗粒细胞的鉴定标准。研究结果表明,于体外建立的卵巢颗粒细胞培养体系中,FSHR的阳性率可达到90%以上,可以进行相关实验,所获得的实验数据也相对可信。
颗粒细胞是卵泡内的最大细胞群,也是主要的功能细胞,卵泡发育的显著标志之一就是颗粒细胞迅速生长及增殖,而成年动物的卵泡闭锁主要是由颗粒细胞凋亡引起,尤其在卵泡发育后期,此外,颗粒细胞还与卵泡膜细胞共同完成卵巢激素的合成,维持着有利于卵母细胞生长和成熟的微环境[5~8]。雌激素在体内有着广泛的效应,包括:调控性成熟,控制排卵,调节生殖行为,建立和维持妊娠,调节乳腺发育等。而孕激素能拮抗雌激素的作用,孕激素对E2生殖效应的拮抗作用涉及到多个方面,包括抑制雌激素诱导的细胞周期调节因子的转位、改变雌激素受体的表达,并能诱导雌激素分解代谢的酶[9]。由此可见,颗粒细胞与卵泡膜细胞之间的相互作用是卵泡发育和卵巢激素合成的基础[10],它们可通过间隙连接,以自分泌和旁分泌的方式,维持有利于卵母细胞生长和成熟的微环境,提示颗粒细胞在卵巢局部微环境调节系统中发挥着重要作用。实验过程中,在FSH作用下,颗粒细胞维持着一定的孕酮和雌二醇分泌水平,在(96~120)小时达到峰值,与体内生理情况相符,说明原代培养的颗粒细胞保持了原有细胞的特性。
综上所述,卵巢颗粒细胞体外培养技术在生殖毒性研究方面有良好的应用前景。本实验所建立的细胞培养体系是可行的、理想的,适合进行相关的毒理学实验。如果可获得人的卵巢组织并进行培养,可直接用于对人体生殖毒性的研究,无疑意义重大。
1 张天宝综述,杨在昌,孙棉龄审校.大鼠卵巢细胞体外培养及生殖毒理研究中的应用[J].卫生毒理学杂志,1997,11(2):128-130.
2 白晓红,糜若然,岳天孚,等.体外培养人卵巢黄素化颗粒细胞的鉴定及其分泌功能变化[J].中华妇产科杂志,2005,40(5):351-352.
3 Lovekamp TN,Davis BJ.Mono-(2-ethylhexyl)phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J].Toxicol Appl Pharmacol,2001,172(3):217-224.
4 Simoni M,Gromoll J,Nieschlag E.The follicle-stimulating hormone receptor:biochemistry,molecular biology,physiology and pathophysiology[J].Endocr Rev,1997,18(6):739-773.
5 吴际,张丽珠,李潭,等.性激素对人卵巢颗粒细胞凋亡的作用[J]. 中华妇产科杂志,1998,33(3):157 -159.
6 Erickson GF.An analysis of follicle development and ovum maturation[J].Seminars ReProd Endoerinol,1986,4:233 -254.
7 桑润滋主編.动物繁殖生物技术[M].北京:中国农业出版社,2002.
8 Eriekson GF.Physiologic basis of ovulation induetion[J].Seminars ReProd Endoerinol,1996,14(4):287 -297.
9 许振成,许虹,张素坤,等.2,3,7,8-四氯二苯并对二噁英对大鼠卵巢颗粒细胞雌二醇和孕酮分泌的影响[J].生态毒理学报,2009,4(1):131 -135.
10 莫中福,殷秀玲,徐素欣,等.DahlS高血压大鼠卵巢的细胞凋亡研究[J].中国医师杂志,2002,12(4):1328-1331.
