水滑石类化合物-氧化铈催化剂的制备及其光降解甲基橙的性能研究
2012-11-09田志茗高艳丽
田志茗,高艳丽
(齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006)
环境与化工
水滑石类化合物-氧化铈催化剂的制备及其光降解甲基橙的性能研究
田志茗,高艳丽
(齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006)
采用共沉淀法制备了LDHs-CeO2(LDHs为水滑石类化合物)催化剂,并将其用于光催化降解甲基橙溶液,考察了催化剂的原料配比、反应时间、甲基橙初始含量、甲基橙溶液的pH和催化剂用量对甲基橙降解率的影响;同时采用FTIR,XRD,SEM,TEM,EDS,TG等方法对催化剂进行了表征。实验结果表明,n(Mg)∶n(Al)∶n(Ce)=2∶1∶0.50的LDHs-CeO2催化剂活性最高,用该催化剂光催化降解甲基橙溶液的适宜条件为:250 mL甲基橙溶液,甲基橙初始质量浓度40 mg/L,pH=5,反应时间80 min(暗处静置20 min,光照时间60 min),催化剂用量0.3 g;在此条件下,甲基橙降解率达到98.69%。表征结果显示,LDHs-CeO2晶相单一,晶体结构一致,结晶度好,属于六方晶系,形貌为规则的片状结构,分散性较好。
水滑石类化合物-氧化铈催化剂;光催化降解;甲基橙
光催化剂[1-2]大多是N型半导体,CeO2是目前一种廉价而用途广泛的新型功能材料,它的禁带宽度为2.94 eV,光吸收阈值约为420 nm[3-5],可用于催化剂、抛光粉和紫外吸收材料等,其纳米化后出现许多新的性质和用途,在化学工业和环境污染控制方面有着广泛的应用前景[1-7]。
水滑石类化合物(LDHs)又称层状双羟基复合金属氢氧化物[6],由这些化合物插层组装的一系列超分子材料称为插层LDHs。插层LDHs具有层间阴离子的组成和结构的可调控性、层间阴离子的可交换性、碱性、热稳定性和记忆效应等性质[7]。它具有插层客体和LDHs的许多优点[5-8],且二者协同作用产生了许多新的功能,因此其在催化、吸附、光化学和电化学等领域具有广阔的应用前景[8]。插层LDHs能有效去除水相中的有机及无机污染物,可被作为污水的过滤剂[9-11],同时它具有的特殊层状结构有利于多种功能性离子的引入[12],扩大了此类材料的应用领域,尤其是作为催化剂和催化剂前体的应用[13]。我国拥有丰富的稀土矿,而稀土因特殊的电子结构排布使其在催化、发光、磁性材料等领域具有广泛的应用[14-18]。
本工作采用共沉淀法制备了LDHs-CeO2催化剂;以甲基橙为目标污染物,以LDHs-CeO2为催化剂,考察了LDHs-CeO2光催化降解甲基橙溶液的效果;并对催化剂试样进行了FTIR、XRD、SEM、TEM及N2吸附-脱附的表征。
1 实验部分
1.1 试剂
甲基橙、Ce(NO3)3·6H2O、Al(NO3)3·9H2O、Mg(NO3)2·6H2O、NaOH、Na2CO3:分析纯,天津市科密欧化学试剂开发中心;无水乙醇:分析纯,天津市富宇精细化工有限公司。
1.2 LDHs-CeO2催化剂的制备
采用共沉淀法合成LDHs-CeO2催化剂。溶液A的制备:将一定量的Mg(NO3)2·6H2O,Al(NO3)3·9H2O,Ce(NO3)3·6H2O溶解于180 mL去离子水中,分别配成n(Mg)∶n(Al)∶n(Ce)=2∶1∶0,2∶1∶0.25,2∶1∶0.50,2∶1∶0.75,2∶1∶1.00的溶液;溶液B的制备:称取13.64 g NaOH和11.31 g Na2CO3溶于80 mL去离子水中。在室温下,将溶液A和溶液B分别滴入高速搅拌的250 mL去离子水中,控制两者的滴加速率,使混合后的溶液pH为10,滴加完毕后继续搅拌3 h,得到浆状混合物。过滤浆状混合物,洗涤滤饼至中性,将滤饼置于烘箱中于80 ℃下烘干,研磨,得到LDHs-CeO2催化剂。
1.3 光催化降解实验
光催化降解实验在光催化反应器中进行,用催化降解甲基橙溶液来评估LDHs-CeO2催化剂的活性。以1 000 W氙灯为模拟外照光源,光照时维持反应体系温度在25 ℃左右。室温下,将250 mL质量浓度为40 mg/L的甲基橙溶液和0.3 g光催化剂加入到光催化反应器中,搅拌形成悬浮液,将悬浮液放在暗处静置20 min,达到吸附-解离平衡,然后在磁力搅拌和光照条件下搅拌60 min (反应时间为80 min,包括静止时间和光照时间)。离心分离所得溶液,移取上层清液,用山东高密彩虹分析仪器有限公司752型紫外-可见分光光度仪在甲基橙的最大吸收波长465 nm处测定吸光度。
1.4 分析方法
1.4.1 降解率的测定
采用紫外分光光度法测定溶液中甲基橙的吸光度。根据降解前后甲基橙的吸光度变化来计算甲基橙的降解率,计算公式为:

式中,D为甲基橙的降解率,%;A0,At分别为降解前后甲基橙的吸光度。
1.4.2 催化剂的表征
采用PerkinElmer公司Thermo Nicolet370型傅里叶变换红外光谱仪对催化剂进行FTIR表征;采用BRUKER-AXS公司D/max-ⅢC型X射线衍射仪对催化剂进行XRD表征;采用HITACHI公司S-4300型扫描电子显微镜对催化剂进行SEM表征;采用PE公司H-7650型电子显微镜观察催化剂的形貌;采用PE公司S-4300型能谱仪分析催化剂的元素组成;采用PE公司Diamond TG/DTA型热重/差热综合分析仪对催化剂进行TG分析。
2 结果与讨论
2.1 催化剂中原料配比对降解率的影响
催化剂中n(Mg)∶n(Al)∶n(Ce)对降解率的影响见图1。由图1可见,采用共沉淀法在催化剂中引入CeO2后,催化剂活性急剧升高;随催化剂中CeO2含量的增加,降解率呈现先增大后减小的趋势。但当反应时间为90 min时,与n(Mg)∶n(Al)∶n(Ce)=2∶1∶0.50的催化剂相比,n(Mg)∶n(Al)∶n(Ce)=2∶1∶0.75,2∶1∶1.00的两种催化剂的降解率略有降低,表明催化剂中CeO2含量存在最佳值。因此,选择催化剂中n(Mg)∶n(Al)∶n(Ce)=2∶1∶0.50较合适。
2.2 反应时间与甲基橙初始含量对降解率的影响
反应时间和甲基橙初始含量对降解率的影响见图2。由图2可见,随甲基橙初始含量的增加,降解率呈现先增大后减小的趋势。由图2还可见,对于不同初始含量的甲基橙溶液,在很短时间内降解率均可达到很高,这是因为在吸附和光催化氧化作用下,甲基橙在较短的时间内即可大量降解,反应80 min后,降解率接近最大值。由此可见,选择甲基橙初始质量浓度为40 mg/L、反应时间为80 min较适宜。
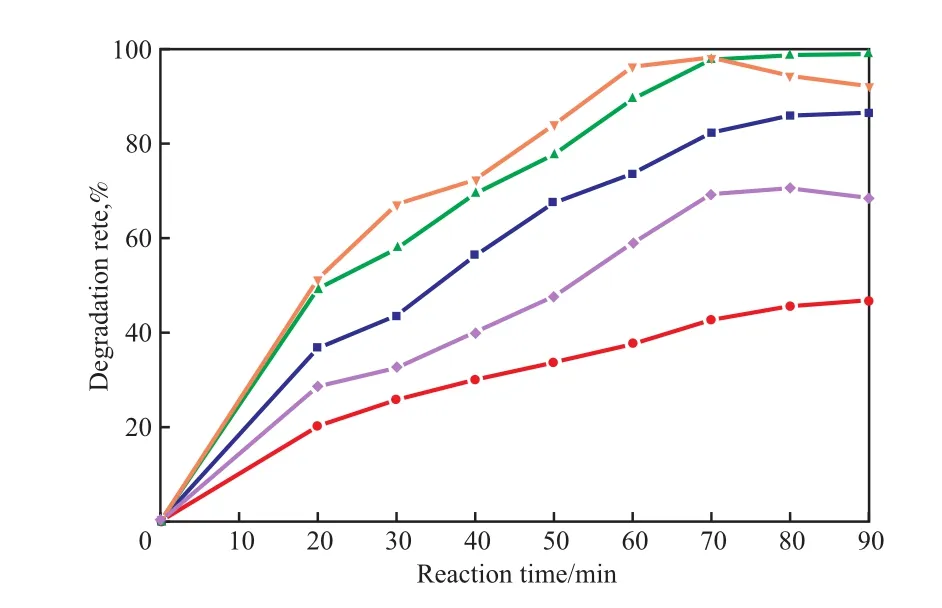
图 1 n(Mg)∶n(Al)∶n(Ce)对降解率的影响Fig.1 The effect of n(Mg)∶n(Al)∶n(Ce) of layered double hydroxides-cerium oxide(LDHs-CeO2) catalyst on the degradation rate of methyl orange.
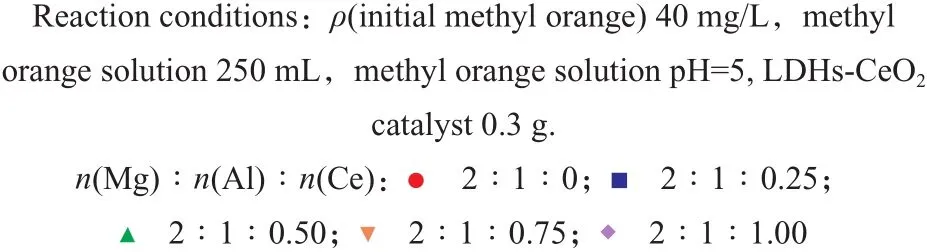
图 2 反应时间和甲基橙初始含量对降解率的影响Fig.2 The effects of reaction time and initial methyl orange concentration on the degradation rate.
2.3 甲基橙溶液的pH对降解率的影响
pH对降解率的影响见图3。由图3可见,随pH的增大,降解率呈现先增大后减小的趋势。甲基橙带负电,在不同的酸碱条件下,甲基橙具有不同的结构,在酸性环境中甲基橙呈醌式结构,在碱性环境中甲基橙呈偶氮结构。酸性条件下,光催化剂催化降解甲基橙,降解率较高,特别是在pH=5、反应进行到80 min时降解率高达98.69%。而在中性和碱性条件下,光催化降解反应则不理想,反应80 min后,pH=7的甲基橙溶液中降解率为61.34 %,pH=9的甲基橙溶液中降解率仅为53.52%。由此可见,甲基橙在酸性条件下的醌式结构比中性、碱性条件下的偶氮结构更容易降解。因此,选择pH=5较适宜。
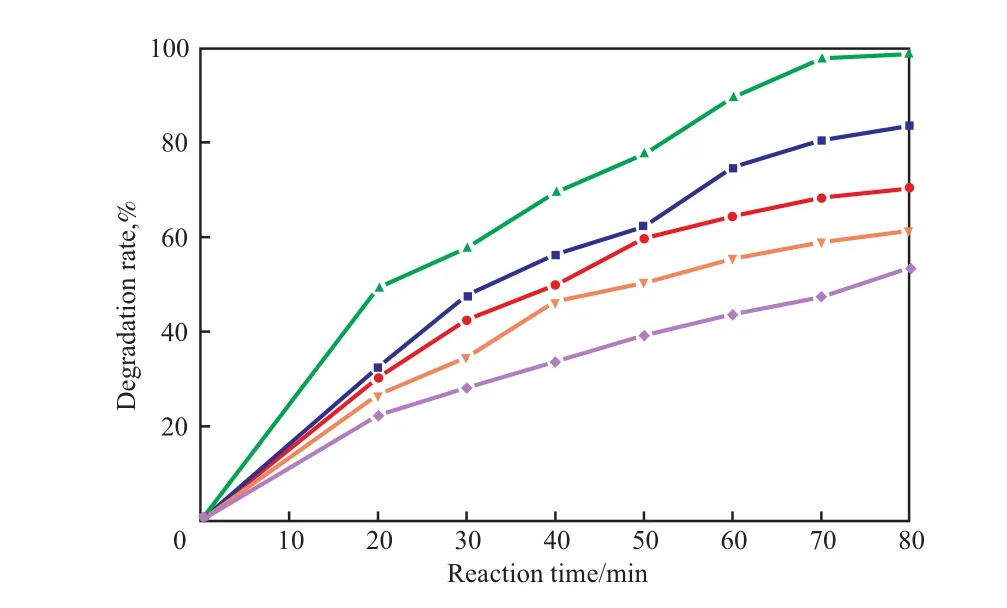
图 3 pH对降解率的影响Fig.3 The effect of pH of the methyl orange solution on the degradation rate.

2.4 催化剂用量对降解率的影响
催化剂用量对降解率的影响见图4。
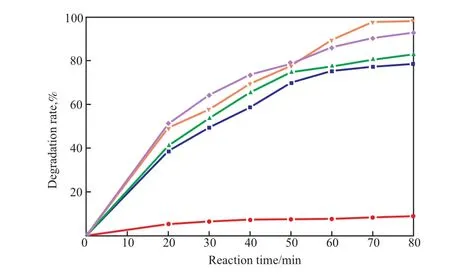
图 4 催化剂用量对降解率的影响Fig.4 The effect of the catalyst dosage on the degradation rate.
由图4可见,随催化剂用量的增加,降解率呈现先增大后减小的趋势。在反应时间80 min、催化剂用量0.3 g时,降解率最大。这是由于当催化剂用量较少时,溶液中催化剂颗粒的含量较低,溶液的光催化反应不完全;但当催化剂用量过多时,过多的悬浮催化剂颗粒阻挡了光的照射,减小了光透射率,从而使降解率降低。因此,选择催化剂用量为0.3 g较适宜。
综上所述,催化反应的最佳反应条件为:甲基橙溶液的pH=5,甲基橙初始质量浓度40 mg/L,n(Mg)∶n(Al)∶n(Ce)=2∶1∶0.50的催化剂用量0.3 g,反应时间80 min(即暗处静置20 min,光照时间60 min)。
2.5 催化剂的重复使用性能
在最佳反应条件下对甲基橙溶液进行催化降解实验,反应结束后,将催化剂用无水乙醇洗涤、抽滤、干燥后再用于下一次降解实验,以考察催化剂的重复使用性能。实验结果发现,催化剂重复使用5次,甲基橙的降解率分别为86.78%,75.11%,63.93%,55.35%,48.24%。由此可见,随使用次数的增多,降解率明显减小,催化剂活性有所降低,但重复使用5次后催化剂仍具有一定的活性。
2.6 表征结果
2.6.1 FTIR表征结果
LDHs-CeO2催化剂的FTIR谱图见图5。由图5可知,3 445.79 cm-1处的强吸收峰归属于层间羟基(包括吸附水和游离水中的羟基)中O—H键的伸缩振动,表明H2O分子在粒子表面形成了氢键;1 576.09 cm-1处的吸收峰归属于结合水中的H—O—H键的弯曲振动;1 487.44,1 433.83 cm-1处的吸收峰归属于C中的C—O键的不对称伸缩振动,1 384.56 cm-1处的吸收峰归属于CeO2晶体中Ce—O键的伸缩振动。
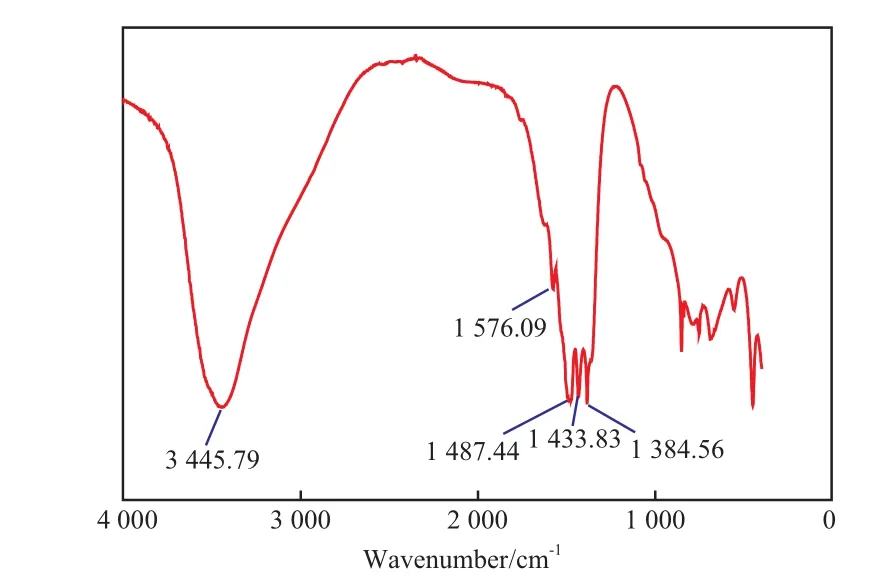
图 5 LDHs-CeO2催化剂的FTIR谱图Fig.5 FTIR spectrum of LDHs-CeO2 catalyst.
2.6.2 XRD表征结果
LDHs-CeO2催化剂的XRD谱图见图6。由图6可见,LDHs-CeO2催化剂具有典型水滑石的特征结构,在2θ=11.540°,23.403°,34.749°,60.860°,62.471°处出现水滑石的特征衍射峰,表明LDHs-CeO2属于六方晶系结构。同时谱图基线低且平稳,衍射峰的峰型窄且尖,表明晶面生长的有序程度较高,结晶度较好,形成了晶相单一、晶体结构一致的水滑石。由图6还可见,在2θ=28.60°处出现较小的衍射峰,该衍射峰为CeO2的特征衍射峰。
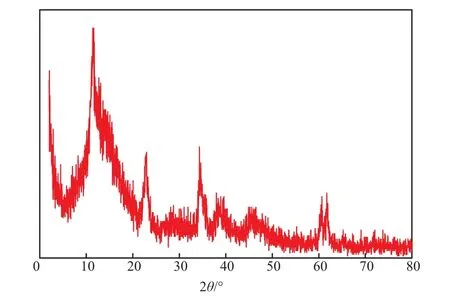
图 6 LDHs-CeO2催化剂的XRD谱图Fig.6 XRD spectrum of LDHs-CeO2 catalyst.
2.6.3 SEM和TEM表征结果
LDHs-CeO2催化剂的SEM照片和TEM照片见图7。

图 7 LDHs-CeO2催化剂的SEM(a)和TEM(b)照片Fig.7 SEM(a) and TEM(b) images of LDHs-CeO2 catalyst.
由图7(a)可见,LDHs-CeO2催化剂的形貌为片状结构,片与片之间层叠在一起且大小均匀,类似于玫瑰花瓣形状,分散性较好,每片厚度约为30 nm,宽度约为500 nm。
由图7(b)可见,LDHs-CeO2片状结构内部有CeO2小颗粒,表明CeO2已完全进入水滑石的晶体结构内部,且分布较均匀。结晶趋于规整,晶格更加完善,催化剂中存在疏松的聚集结构,其粒径达到纳米级。
2.6.4 元素分析结果
测定LDHs-CeO2催化剂的元素组成和含量。实验结果表明,LDHs-CeO2催化剂的组成和含量(质量分数)为C 9.78%,O 40.03%,Na 0.64%,Mg 12.89%,Al 9.95%,Ce 26.71%,表明Ce元素已成功引入到水滑石结构中。
2.6.5 TG-DTG分析结果
LDHs-CeO2催化剂的TG-DTG曲线见图8。由图8可见,在0~900 ℃内,催化剂试样出现两次明显的失重,100~200 ℃为第一失重阶段,由催化剂外表面的物理吸附水和层间结构水的脱除引起;200~400 ℃为第二失重阶段,由层间羟基的脱除、层间CO32-的分解及分子内部结合水的脱除引起。当温度达到450 ℃时,层间CO32-几乎全部分解,残余羟基脱除完全,表明LDHs-CeO2催化剂已分解完全。
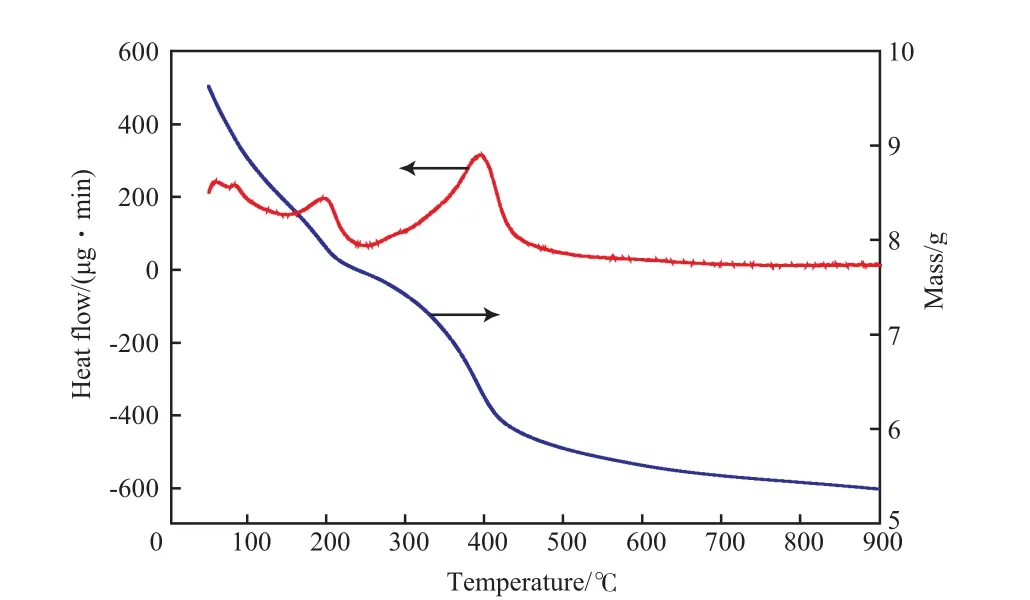
图 8 LDHs-CeO2催化剂的TG-DTG曲线Fig.8 TG-DTG curves of LDHs-CeO2 catalyst.
3 结论
(1)采用共沉淀法制备了n(Mg)∶n(Al)∶n(Ce)=2∶1∶0.50的LDHs-CeO2催化剂,用该催化剂光催化降解甲基橙溶液,最佳反应条件为:250 mL甲基橙溶液,甲基橙初始质量浓度40 mg/L,甲基橙溶液的pH=5,反应时间80 min(暗处静置20 min,光照时间60 min),催化剂用量0.3 g。在此条件下,甲基橙降解率达98.69%。该催化剂在降解甲基橙溶液的反应中具有很高的催化活性,且能重复使用多次。
(2)表征结果表明,LDHs-CeO2晶相单一,晶体结构一致,结晶度好,属于六方晶系;LDHs-CeO2的形貌为规则的片状结构,类似于玫瑰花瓣形状,分散性较好,每片厚度约为30 nm,宽度约为500 nm;LDHs-CeO2由C,O,Na,Mg,Al,Ce 6种元素组成;在0~900 ℃内的程序升温过程中,LDHs-CeO2催化剂试样的TG/DTG曲线出现两次明显的失重过程。
[1]郑修成,王向宇,王淑荣,等.Cu/CeO2催化剂的制备、表征及催化性能研究[J].石油化工,2005,34(增刊):413 - 415.
[2]李占双,闫慧君,尤佳,等.水热法合成纳米CeO2及其光催化性质研究[J].化学试剂,2008,30(4):340 - 343.
[3]张欣,董秀芹,姜浩锡,等.MnO2- CeO2催化超临界水氧化苯胺废水[J].石油化工,2006,35(12):1184 - 1187.
[4]曾俐,于然波,邓金侠,等.掺杂二氧化铈多孔微球对水溶液中Cr6+去除作用[J].中国稀土学报,2010,28(7):251 - 254.
[5]沈小女,蔡国辉,肖益鸿,等.CeO2修饰的Pt/SiC催化剂催化CO氧化反应的性能[J].石油化工,2008,37(3):300 - 304.
[6]Valente J S,Manuel S C, Lima E, et al.Method for Large-Scale Production of Multimetallic Layered Double Hydroxides: Formation Mechanism Discernment[J].Chem Mater,2009,21(24):5809 - 5818.
[7]Perruchot C,Chehimi M M,Vaulay M J,et a1.Characterization of the Surface Thermodynamic Properties of Cement Components by Inverse Gas Chromatography at In fi nit Dilution[J].Cem Concr Res,2006,36(2):305 - 319.
[8]张峰,曹晓霞,倪哲明,等.镁铝水滑石及其改性产物的表面性质的研究[J].无机化学学报,2009,25(2):271 - 277.
[9]牛向楠,朱洪涛,赵毅,等.水滑石类材料的制备及在水污染治理中的应用[J].电力科技与环保,2010,26(4):27 - 30.
[10]肖杰,赖喜德,钱骏,等.镁-铝水滑石的制备及其脱色性能[J].化工环保,2006,26(2):145 - 147.
[11]姚铭,杜莉珍,王凯雄,等.合成水滑石治理水体阴离子染料污染研究[J].环境科学学报,2005,25(8):1034 -1040.
[12]郭军,孙铁,沈剑平,等.杂多阴离子柱撑水滑石类层柱材料的合成及其催化性能的研究[J].石油化工,1995,24(12):861-864.
[13]Das J,Patra B S,Baliarsingh N,et a1.Adsorption of Phosphate by Layered Double Hydroxides in Aqueous Solutions[J].Appl Clay Sci,2006,32(34):252 - 260.
[14]Valente J S,Tzompantzi F,Prince J.Highly Ef fi cient Photocatalytic Elimination of Phenol and Chlorinated Phenols by CeO2/MgAl Layered Double Hydroxides[J].Appl Catal,B,2011,102(1/2):276 - 285.
[15]张永,张延武,朱艳青,等.水滑石类化合物的研究进展[J].河南化工,2007,24(12):9 - 12.
[16]陈伟,李旦振,何顺辉,等.Mg/Al类水滑石/二氧化钛异质复合纳米晶光催化氧化苯的性能[J].催化学报,2010,31(8):1037 - 1043.
[17]陆军,史文颖,卫敏.水滑石类插层组装功能材料[J].石油化工,2008,37(6):539 - 547.
[18]张军,赵宁,肖福魁.NiMgAlO-F催化剂的物化性能及其在甲烷部分氧化制合成气中的应用[J].石油化工,2010,39(12):1319 - 1325.
Preparation of Layered Double Hydroxides-CeO2Catalyst and Degradation of Methyl Orange
Tian Zhiming,Gao Yanli
(Qiqihar University of Chemistry and Chemical Engineering,Qiqihar HeiLongjiang 161006,China)
Layered double hydroxides-CeO2(LDHs-CeO2) catalysts were prepared by coprecipitation method. Its photocatalytic properties for the degradation of methyl orange solution were tested. The effects of raw material ratio of the catalyst,reaction time, initial methyl orange solution concentration,methyl orange solution pH and catalyst dosage on the degradation were studied. The catalysts were characterized by means of FTIR,XRD,SEM,TEM,EDS and TG. The results showed that the photocatalytic activity of LDHs-CeO2catalyst withn(Mg)∶n(Al)∶n(Ce) 2∶1∶0.50 in the photocatalytic degradation were the highest. Under the optimal reaction conditions of the initial methyl orange solution concentration 40 mg/L,its pH 5, the reaction time 80 min(dark standing 20 min and then irradiation 60 min) and the catalyst dosage 0.3 g,the methyl orange degradation rate could reach 98.69%. The characterization results revealed that the catalysts were high crystalline with hexagonal system,full layered structure and good dispersity.
layered double hydroxides-cerium oxide catalyst;photocatalytic degradation;methyl orange
1000 - 8144(2012)02 - 0204 - 06
TQ 426.81
A
2011 - 08 - 27;[修改稿日期]2011 - 10 - 24。
田志茗(1964—),女,黑龙江省齐齐哈尔市人,博士,教授,电话 0452-2738220,电邮 tianzm@sina.com。联系人:高艳丽,电话 15845640121,电邮 qqhrugaoyanli@163.com。
(编辑 李明辉)
