ZnO的合成及其在油品脱硫中应用的研究进展
2012-11-09柳云骐佘南南刘晨光
田 双,柳云骐,佘南南,刘晨光
(中国石油大学(华东) 重质油加工国家实验室 CNPC 催化重点实验室,山东 青岛 266555)
ZnO的合成及其在油品脱硫中应用的研究进展
田 双,柳云骐,佘南南,刘晨光
(中国石油大学(华东) 重质油加工国家实验室 CNPC 催化重点实验室,山东 青岛 266555)
在分析ZnO晶体的生长习性及合成方法的基础上,分述了近年来对不同形貌纳米ZnO的合成研究进展。介绍了ZnO基脱硫剂的脱硫机理,为ZnO在油品脱硫中的应用提供理论基础。采用不同的制备方法可以得到不同物化性质(包括形貌、孔结构等)的ZnO;而在脱硫过程中,ZnO作为主要的脱硫剂成分,它的物化性质及硫容对提高脱硫效果具有重要意义。在此基础上,分析了目前ZnO用于反应吸附脱硫技术中S-Zorb工艺脱硫剂的发展现状,提出了研制具有特殊性能的纳米ZnO是提高脱硫剂性能的重要研究方向。
氧化锌;吸附脱硫;S-Zorb;镍; 脱硫机理
日益严格的环保法规,对生产低硫、超低硫清洁油品技术提出了更高的要求[1]。ZnO脱硫技术是在20世纪50年代开发的,其脱硫精度高的特性一直是脱硫技术的研究中心。ZnO基脱硫剂广泛应用于合成氨、合成甲醇、煤化工、石油炼制等行业,主要用于脱除天然气、油田气、炼厂气等原料中的H2S及某些有机硫。ZnO基脱硫剂的脱硫精度高,可将原料气中的硫脱除到0.1~0.5 μg/g[2]。吸附脱硫技术具有投资少、操作费用低等优点,是一种竞争力强、市场前景广阔的新技术。目前典型的工业化反应吸附脱硫工艺是美国康菲公司的S-Zorb工艺,该工艺中的Phillips专利吸附剂采用ZnO复合载体,以Co和Ni等为活性组分,用于FCC汽油和柴油脱硫,可在辛烷值损失较小的情况下使汽油产品的硫含量降至10 μg/g以下,是目前工业化推广较好的反应吸附脱硫技术。国内外有很多关于反应吸附脱硫剂研究的报道,但有关Ni/ZnO体系反应吸附脱硫的研究刚刚起步,其中ZnO的物化性质是影响吸附剂活性的重要因素之一。
本文介绍了ZnO的生长习性、制备方法及其物化性质对反应吸附脱硫性能的影响,为新型反应吸附剂的开发提供理论依据。
1 ZnO材料的合成
1.1 ZnO的生长习性及合成条件的影响
ZnO晶粒的结晶形态与晶体结构密切相关,生长时的物理、化学条件也有一定的影响,ZnO的结构如图1所示[3]。
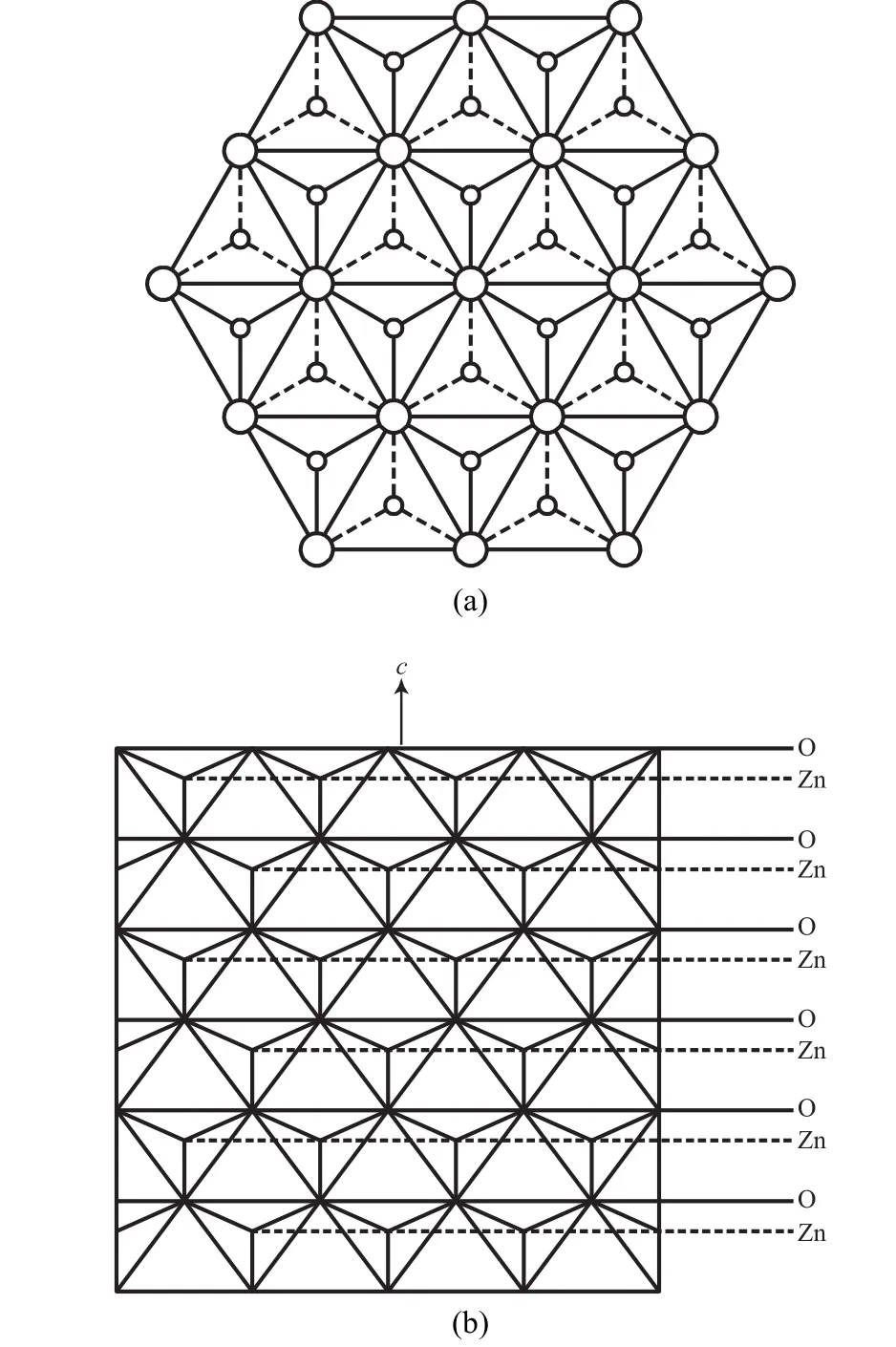
图1 ZnO晶体结构Fig.1 ZnO crystal structure.
图1(a)为ZnO晶体结构在c(0001)面上的投影,由图1(a)可看出,在ZnO晶体结构中,每个Zn原子周围有4个氧原子,构成Zn-O4配位四面体结构,四面体的一个顶角指向-c(000)面,四面体的底面平行于+c(0001)面。图1(b)是Zn-O4四面体在(110)面上的投影,由图1(b)可看出,Zn原子在c轴方向上不是对称分布的,ZnO晶体的+c(0001)面表现为正极面,而-c(000)面表现为负极面,Zn原子的分布偏向正极面而远离负极面。每个Zn-O4四面体在正极轴方向上显露其顶角,在负极轴方向上显露其底面。正极轴方向生长速率较快,难以显露;而负极轴方向生长速率慢,易显露。实际上在ZnO晶体的生长过程中,正极面经常消失,而负极面却顽强显露。
ZnO晶体生长时的物理化学条件对晶粒的结晶形貌有显著影响。碱性强、反应温度高、反应时间长,微晶形态趋向球形;碱性弱、反应温度低、反应时间短,微晶形态趋向长柱状;在居于两者之间的碱性水热条件下,ZnO晶粒则呈明显的极性生长。水热条件下ZnO晶粒的结晶习性可大致分为:在中性或弱碱性条件下以长柱状结晶,在强碱性溶液中和高的反应温度下以短柱状和规则多面体的颗粒状结晶,在碱度适中的水热条件下呈极性生长(见图2[4])。这一规律反映了ZnO微晶特定的结晶习性,这也是一些极性晶体固有的习性特征,这一特征可用来指导实际的晶体生长和ZnO超细微晶的制备。
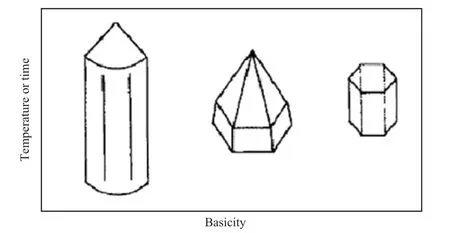
图2 碱度、温度和时间对ZnO晶体形态的影响Fig.2 Effects of alkalinity,temperature and time on the morphology of ZnO crystals.
1.2 ZnO的合成方法
制备纳米ZnO的方法有物理法和化学法。化学法可分为固相法、气相法(化学气相氧化法、激光诱导化学气相沉淀法、喷雾热解法)和液相法(直接沉淀法、均匀沉淀法、溶胶凝胶法、水热合成法)。与其他方法相比,液相法设备简单,原料易得,能准确控制粒子的化学组成,且粒子大小及形状容易控制,在反应中还可采用精制手段,因而得到的ZnO纯度高、活性好、成本低。下面介绍几种主要的液相法。
1.2.1 均匀沉淀法
均匀沉淀法是利用中间反应产物使溶液中的构晶离子由溶液中缓慢、均匀地释放出来[5]。均匀沉淀法的特点:(1) 由于构晶离子的过饱和度在整个溶液中较均匀,所以沉淀物的颗粒均匀而致密,容易洗涤;(2)反应条件温和易控,产品粒子分布均匀;(3)能避免杂质的共沉淀。
在均匀沉淀法中,以尿素为沉淀剂时所得产品的平均粒径最小。以尿素为沉淀剂制备纳米ZnO的原理见式(1)~(3)。
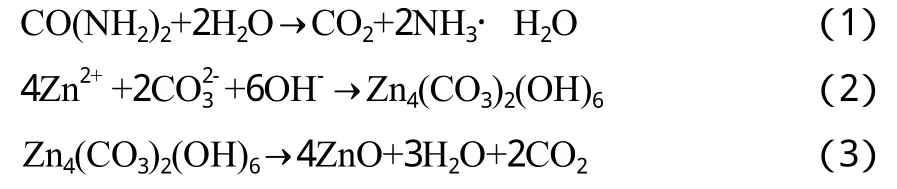
以尿素为沉淀剂制备纳米ZnO的过程中,沉淀剂不是直接与Zn(NO3)2反应,而是通过尿素水解生成的构晶离子OH-和CO32-与Zn(NO3)2反应。反应(1)是慢反应,反应(2)是快反应,尿素溶液在加热下缓慢水解是整个反应的控制步骤,因而不会造成溶液中反应物浓度突然增大,构晶离子均匀地分布在溶液的各部分,与反应物Zn(NO3)2可达到分子水平的混合,因而能确保在整个溶液中均匀地反应生成沉淀。
1.2.2 溶胶凝胶法
溶胶凝胶法不仅可用于制备粉体,还可用于制备薄膜、纤维和复合材料。该方法在实验初期就能对反应进行控制,使产物的均匀性可达到亚微米级、纳米级甚至分子级水平。该方法的优点:高纯度粉体制备过程中无需机械混合,不容易引进杂质;溶胶由溶液制成,化合物在分子水平上混合,故胶粒内及胶粒间的化学成分完全一致;可溶性微量掺杂组分分布均匀,不会分离、偏析;工艺设备简单,成分容易控制。
姜秀平等[6]采用溶胶凝胶法,以Zn(Ac)2、草酸为主要原料,制得球形纳米ZnO。在该反应体系中加入一定量的有机物乙二胺后,得到棒状结构的纳米ZnO。这是因为乙二胺分子中含有配位基团,在棒状纳米ZnO的生长过程中能选择性地吸附于某一特定的ZnO晶面上,从而抑制该晶面方向上ZnO晶体的生长,改变ZnO晶体的形貌。由此可见,乙二胺的加入改变了金属离子的反应历程、改变了晶核生长基元及其维度和连接方式,从而促进了纳米粒子沿着某一方向定向排列生长,最终得到棒状结构的纳米ZnO。
1.2.3 水热合成法
水热合成是指在高于水的正常沸点的条件下,在一个密闭的压力容器内进行的反应。水热合成法的主要特点:反应在相对高的温度和压力下进行;晶体的结构、组成、形貌和颗粒的尺寸对反应条件极其敏感,改变反应条件(如温度、酸碱度、原料配比等)可改变晶体特征;产物不需要经过焙烧晶化,直接为晶态,因而可减少在焙烧过程中晶粒的团聚,使晶粒尺寸较小,对制备纳米氧化物有利。
张经纬等[7]在反应体系中加入乙醇,利用水热合成法制备了棒状纳米ZnO。加入乙醇的作用:(1)采用水热合成法制备ZnO,必须保持体系处于沸腾状态,加入乙醇后溶液的沸点可降至90~92℃,低的生长温度有利于得到尺寸较小的ZnO;(2)乙醇作为弱的表面活性剂,有可能影响ZnO形成初期的成核过程及其后期的生长。
1.3 不同形貌纳米ZnO的组装
1.3.1 空心球状、花状纳米ZnO
利用不同表面活性剂,采用水热合成法可以合成多种形貌的纳米ZnO。Bitenc等[8]以Zn(NO3)2和尿素为原料,分别以聚乙烯吡咯烷酮-K30、十二烷基磺酸钠、聚乙二醇辛基苯基醚、β-环糊精、L-氨基酸为表面活性剂合成了各种不同形貌的纳米ZnO。虽然纳米ZnO微晶的形貌受多种因素的影响,但表面活性剂的种类是影响纳米ZnO微晶形貌的主要因素。
徐志兵等[9]采用强酸型阳离子树脂模板剂,通过常压离子交换、高温焙烧制备出空心的球形ZnO微球,球体直径为200~600 μm。强酸型阳离子树脂中的H+与Zn(NO3)2溶液中的Zn2+进行充分交换反应,交换后的强酸型阳离子树脂经干燥后,在空气中焙烧形成空心的ZnO微球。该方法成本较低且操作简单,在材料、催化等领域有较好的应用前景。
王佳等[10]制备了花状ZnO。制备方法为:将Zn(Ac)2·6H2O固体溶解到去离子水中,在充分搅拌下缓慢滴加浓氨水,至生成的沉淀恰好消失为止;将得到的Zn(NH3)4(Ac)2前体溶液转移到衬聚四氟乙烯内胆的高压釜中,在60 ℃下晶化。不同反应时间下得到的ZnO微晶的形貌见图3。由图3可看出,所得ZnO形貌均呈花形,分布较均匀,花瓣均为多层且呈锥形;但不同反应阶段的产物形貌和尺寸有差别。当反应时间为30 min时,产物已形成花形,尺寸为3~4 μm;当反应时间延长至60 min和180 min时,花形更加完美,尺寸增大到4~6 μm。由此可见,延长反应时间对产物形貌和结构没有明显的影响,但产物聚集态的尺寸有所增加。
1.3.2 一维纳米ZnO
一维纳米ZnO由于其良好的结晶性和取向性,备受关注。目前,利用不同的制备方法,已得到了多种形貌的一维ZnO[11],包括纳米带、纳米棒、纳米管等。
娄天军等[12]用ZnCl2和氨水制备一维ZnO纳米棒。具体步骤为:称取一定量的ZnCl2溶于适量的蒸馏水中,在磁力搅拌下滴加浓氨水,直至生成的Zn(OH)2沉淀完全消失;加入表面活性剂十六烷基三甲基溴化铵(CTAB),搅拌溶解;转移至衬聚四氟乙烯的高压容器中,在180 ℃下晶化20 h。反应结束后,过滤,洗涤,放入60 ℃的烘箱中烘干,得ZnO纳米棒。所得ZnO纳米棒的SEM图像见图4。

图3 不同反应时间下得到的ZnO微晶的SEM图像Fig.3 SEM images of ZnO microcrystals at different reaction times.

图4 ZnO纳米棒的SEM图像Fig.4 SEM images of nano ZnO rods.
向群等[13]以Zn(NO3)2和NaOH为原料,表面活性剂CTAB为形貌控制剂,采用水热合成技术制备了一维纳米ZnO。表面活性剂CTAB对一维ZnO纳米棒的影响很大,它可以通过静电引力和Zn(OH)24-发生作用,因而CTAB可以吸附在纳米晶的晶面上并形成有序的疏水膜。当表面活性剂运送生长基元在晶核上生长时,由于疏水膜的存在使得生长基元很难达到纳米晶表面,因而导致生长过程中具有各向异性,所以纳米晶(0001)晶面的生长速度大于径向的生长速度。Bitenc等[14]用Zn(NO3)2·6H2O和尿素水热合成棒状ZnO时发现,溶剂对颗粒大小和形状有重要影响,在水溶剂中加入多元醇可以改变粒径分布。
此外,朱汉财等[15]以Zn(Ac)2为原料,采用丙三醇常压回流法制备了二维片状纳米ZnO。二维片状ZnO类似于镜片,有利于吸光,具有比粉末更容易分离等优点,因此,二维片状ZnO主要应用在光催化领域。而作为脱硫吸附剂,具有特殊形貌的ZnO受到广泛的关注。
2 ZnO的脱硫性能及其在S-Zorb工艺中的应用
2.1 ZnO的脱硫机理
2.1.1 无机硫化物的脱除
ZnO是吸附性脱硫剂,和硫有很强的亲和力,在脱除无机硫化物(主要是H2S)时,反应生成具有很高稳定性的硫化锌。ZnO脱除H2S的反应方程式如下:

该反应为放热反应,温度升高不利于反应向生成产物的方向进行,平衡常数减小,脱硫精度下降;降低温度可提高脱硫精度。因此,ZnO脱硫剂用于中、高温脱硫时硫容较高;而低温脱硫时硫容较低,但脱硫精度较高。ZnO脱除H2S反应的平衡常数很大,反应进行得十分彻底,可认为反应不可逆。实际应用时,脱硫反应都是动力学控制,而不是平衡控制。反应时吸附在ZnO晶体表面的H2S发生去质子反应,生成硫离子,使表面电子浓度发生改变[16],影响ZnO的吸附容量。对于表面分子数只占固体总数百分之几的ZnO,若仅有这部分ZnO分子与H2S反应,硫容不过1%左右,因此必须使固相内部的ZnO分子也参与反应,使H2S不仅进入ZnO固体颗粒孔隙在内表面吸附,而且渗透到ZnO晶粒内部进行反应,脱硫剂才可获得较高的硫容[17-19]。在ZnO表面未形成ZnS覆盖膜之前,脱硫总反应速率受孔扩散的控制;形成ZnS膜后,受固体扩散的控制。此时表层ZnS膜阻止了H2S与ZnO的进一步反应,因此比表面积大小与孔结构会影响脱硫反应的进行。
2.1.2 有机硫化物的脱除
最近,国内外开始研究应用ZnO来脱除噻吩及其衍生物等有机硫,但噻吩及其衍生物在ZnO上与氢发生转化反应的能力很低,因此单独用ZnO难以脱除噻吩类硫化物,需借助于Co, Mo, Ni等具有较强加氢性能的金属作为反应活性组分,将噻吩类硫化物转化成H2S后才能被脱除。如S-Zorb工艺中使用的Ni/ZnO吸附剂,Ni作为加氢活性组分,ZnO作为硫载体,硫以ZnS的形式固定在吸附剂上。
ZnO也能和某些有机硫化物(如甲硫醇)反应。Dvorak等[20]的研究表明,甲硫醇在ZnO上的反应产物是CO,CH4,HCHO,C2H6,C2H4,C2H2的混合物,甲硫醇盐是反应中间体。当温度低于227℃时,吸附在ZnO 上的硫醇盐中间体是稳定的;当温度高于227 ℃时,C—S 键断裂生成甲基中间体和硫原子,如果向ZnO中加入Cs可明显降低C—S键断裂的能垒,加速反应的进行。
2.2 ZnO在S-Zorb工艺中的应用
2.2.1 S-Zorb工艺研究进展
美国康菲公司开发的S-Zorb工艺是一种反应吸附脱硫工艺[21]。它组合了流化床反应器和连续再生技术,成功应用于FCC汽油和柴油脱硫,是目前工业化推广较好的吸附脱硫技术。康菲公司在催化汽油脱硫处理、催化剂研发和生产等领域有几十年的经验,早期开发出了用于气体净化的Z-Sorb技术。S-Zorb工艺是在Z-Sorb技术基础上最新研究开发的一种燃油脱硫技术。该技术对反应活性较低的噻吩类硫化物同样具有较高的脱除活性,因而可达到深度脱硫的目的[22]。
S-Zorb工艺使用的 Phillips专利吸附剂[23],是以ZnO、硅石、氧化铝制备复合载体,Co,Ni,Cu等为活性组分,呈灰绿色的微球。其脱硫机理为反应吸附机理,如图5所示。
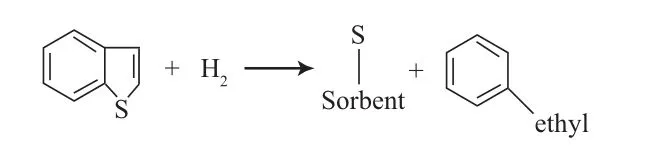
图5 S-Zorb工艺的吸附机理Fig.5 Adsorption mechanism of S-Zorb process.
临氢条件下,含硫化合物吸附在吸附剂表面,进而发生化学反应,硫原子留在吸附剂表面,烃类部分回到液流中。
S-Zorb工艺流程包括3个组成单元[24]:吸附反应器、再生器和还原系统,如图6所示[25]。原料油进入吸附反应器后,在温度343~413 ℃、压力0.7~2.1 MPa和临氢的操作条件下进行脱硫反应。S-Zorb工艺的独特之处是借鉴了FCC工艺的CCR技术,采用了流化床反应器和吸附剂连续再生系统。该技术已日趋成熟,汽油的脱硫率可达99%,并且可以实现最小的辛烷值损失。原料进入吸附反应器后,在所需压力、温度和临氢操作条件下进行脱硫反应,部分吸附剂循环。大部分待生吸附剂进入再生系统,在空气气氛中焙烧,脱除吸附的硫化物,含硫尾气排入硫磺回收装置。焙烧后的吸附剂再进入还原系统用氢气还原,以提高其表面还原态Ni活性组分的含量,保证脱硫效果。最后,再生吸附剂返回反应器系统循环使用。H2S并不释放到产品中,因此,防止了H2S与烯烃结合生成硫醇。同时,吸附剂的低烯烃加氢饱和性能和高α-烯烃骨架异构化能力也使汽油产品的抗爆指数损失远远低于选择性加氢脱硫工艺[21]。采用该技术可将汽油中的硫含量从800 μg/g降至25 μg/g以下,而抗爆指数损失小于1.0。目前该技术已进入工业化阶段[26]。
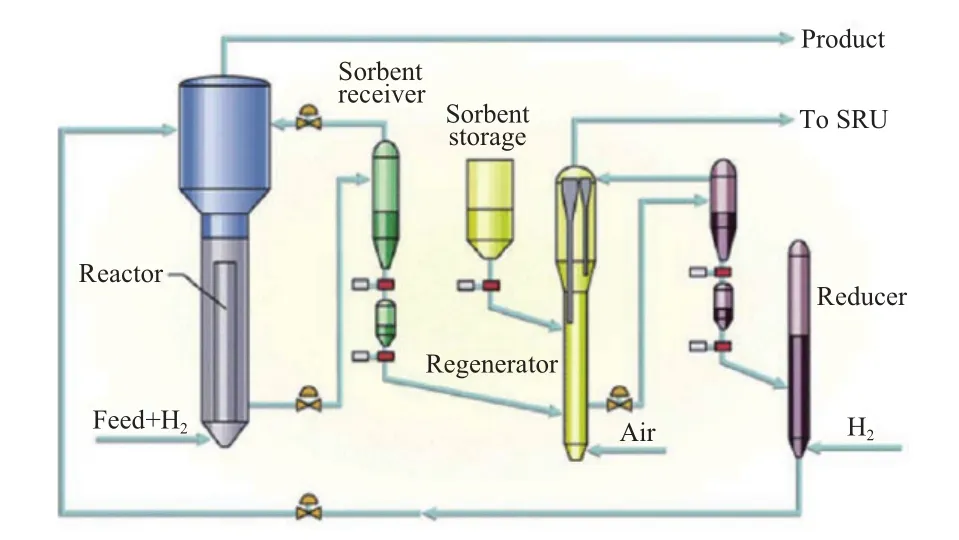
图6 S-Zorb工艺流程Fig.6 S-Zorb technological process.
S-Zorb工艺在FCC汽油脱硫方面具有明显优 势,脱硫率高,烯烃饱和率低(3%(w)左右),同时收率接近100 %;此外,氢耗远低于加氢脱硫反应,且对氢气纯度要求不苛刻(体积分数大于50%)[27],因而运行成本可大幅降低。目前已有数套工业装置在运转。第一套装置建于康菲公司得克萨斯州Borger炼油厂[28],处理硫含量200~1 400 μg/g的全馏分FCC汽油,产品硫含量小于10 μg/g,且几乎没有辛烷值损失;第二套装置于2003年11月在康菲公司华盛顿州Farndale炼油厂投入运行,可将全馏分FCC汽油的硫含量从1 500 μg/g降至10 μg/ g。中国石化燕山石化公司已于2008年引进了该技术并投产使用,首套装置设计加工能力为1.2 Mt/ a,可生产硫含量小于10 μg/g的低硫汽油,以满足北京市对欧Ⅴ标准清洁汽油的需求[29]。
最近,康菲公司对S-Zorb工艺的反应器系统、再生系统、吸附剂硫化系统和操作稳定性等进行了优化,推出第二代S-Zorb工艺[30]。与原工艺相比,将FCC汽油的硫含量从1 000 μg/g脱至10 μg/g时,新工艺的反应压力提高了1.03 MPa,反应温度提高了31.7~45.5 ℃,氢烃摩尔比减小了0.1~0.3,再生压力降低了0.27 MPa,吸附剂循环量下降了50%。反应压力的提高延长了气相原料在反应器中的停留时间,增大了重时空速,降低了吸附剂的用量,从而降低了循环氢的补充量或纯度。吸附剂用量的减少又可有效地缩小再生系统的设备体积以及降低汽提氮气和还原氢气的用量。总之,在相同原料处理能力和同等产品质量要求的前提下,第二代S-Zorb工艺的装置总投资可下降28%,且更适合于现有固定床加氢脱硫工艺的改造。
2.2.2 Ni/ZnO吸附剂的制备及应用
近年来,国内外已公开了大量关于Ni/ZnO反应吸附剂制备方面的专利,制备方法主要包括等体积浸渍法和干湿法。在康菲公司S-Zorb工艺使用的Phillips专利吸附剂的基础上,新一代吸附剂中加入了分子筛助剂,可达到异构化的目的,生成高辛烷值汽油。添加分子筛的吸附剂已用于Borger炼油厂汽油脱硫装置中,(R+M)/2(R:研究法辛烷值,M:马达法辛烷值)提高了0.5~1.0个单位,汽油收率达到99.8%。
菲利浦石油公司[31]公布了一种吸附剂的制备步骤:首先将ZnO、氧化铝和一种分散剂组分混合以形成淤浆混合物,然后喷雾干燥形成颗粒,再喷雾浸渍Ni(NO3)2水溶液,635 ℃下焙烧1 h,得成型吸附剂。该公司还公布了一系列专利[32-34],以ZnO、硅藻土和氧化铝混合物为载体,调节ZnO和黏结剂含量以提高其耐磨性,延长使用寿命。等体积浸渍金属活性组分Ni,Co,Ni-Co或Ni-Cu,得成型吸附剂。其中双金属体系更有利于抑制烯烃加氢。
徐文清等[22]采用等体积浸渍法制备了Ni含量为4%(w)的Ni/ZnO吸附剂,以FCC汽油为原料,选用固定床反应器评价了该吸附剂对FCC汽油的吸附脱硫性能和再生性能。在温度370~380 ℃、压力2.0 MPa、氢油摩尔比1.5和体积空速4.0 h-1的条件下,吸附剂的穿透硫容为2.54%,汽油辛烷值损失了1.1。吸附剂多次循环使用后其吸附脱硫性能基本保持不变。
杨静等[35]考察了ZnO-Al2O3,ZnO-ZrO2,ZnO-TiO2复合载体负载Ni催化剂脱除噻吩的性能,Ni/ZnO-ZrO2的活性最好,这归因于ZnO-ZrO2复合载体具有更大的比表面积和活性组分分散性,使催化剂具有更多的吸附中心。助剂的引入可在一定程度上提高Ni/ZnO吸附剂的脱硫活性。Co的引入提高了Ni的分散性,使得Ni更容易被还原,同时增大了催化剂表面的酸强度;而添加Mo的效果相反[25]。Nd的添加使得Ni/ZnO的比表面积和活性中心数量增加,酸强度和总酸量增大,因而催化性能优于未改性的Ni/ZnO[28]。
2.2.3 Ni/ZnO吸附脱硫机理
还原态的Ni基吸附剂具有较高的选择吸附有机硫化物的活性,但硫容受限于表层Ni原子的硫化,增大活性Ni比表面积可提高硫容。Ko等[36-37]对比了不同Ni负载量的介孔氧化硅SBA-15对工业柴油的脱硫性能,Ni负载量为30%(w)的Ni/SBA-15的穿透硫容达到1.7 mg/g,明显高于Ni负载量为40%(w)的Ni/SBA-15。这是因为:前者的Ni颗粒粒径小于5 nm,远小于后者的10 nm,因而具有更大的Ni比表面积和更多的Ni活性位。
通过引入硫载体恢复表层Ni原子的脱硫活性,是提高Ni基吸附剂硫容的另一有效途径。合适的硫载体成为开发高效Ni基吸附剂的关键。Tawara等[38-40]研究发现,在氢-氮气氛中,金属氧化物(如ZnO,MoO3,NiO,Co3O4,MnO2)均具有良好的载硫能力。对不同复合氧化物脱硫活性的测试结果表明,Ni/ZnO体系具有最好的效果。Ni与ZnO之间存在协同作用,即所谓“自动再生”现象[38]。依据硫化和再生速率平衡推算,Ni/ZnO体系的Ni含量以13%(w)为最佳。在温度270~290 ℃、体积空速0.25 h-1的反应条件下,Ni/ZnO吸附剂用于处理含硫量51 μg/g的煤油[38],在长达一年的时间里,可稳定获得硫含量小于0.03 μg/g的符合燃料电池硫含量要求的超清洁油品。
Babich等[1]对Ni/ZnO体系的反应吸附脱硫机理进行了推测,见图7[1]。ZnO作为硫载体,提供较高的硫容,还原态的Ni0为脱硫活性位。首先,吸附剂氧化态前体NiO/ZnO中的NiO在氢的作用下转变成还原态活性Ni0;由于含硫化合物分子中的硫原子相对呈现电负性,诱导作用下逐渐接近Ni原子,与Ni的轨道电子形成配价键,吸附在Ni表面上,形成过渡状态[41];随后,在两者间强吸附势能的作用下,硫化物中的C—S键断裂,硫原子脱离烃类部分,与Ni形成类NiS状态;最后,在氢的作用下,硫原子向ZnO表面转移形成ZnS,Ni恢复脱硫活性,即“硫转移”机理。
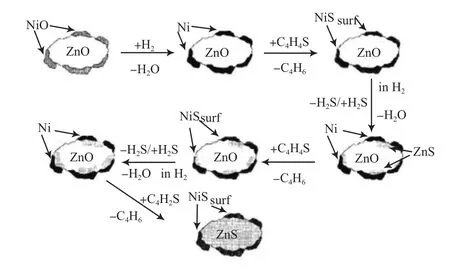
图7 Ni/ZnO体系的反应吸附脱硫机理Fig.7 Mechanism of reactive adsorption desulfurization for thiophene on Ni/ZnO.
Huang等[42]采用XANES和XRD技术研究了柴油中的有机硫化物在Ni/ZnO上的反应吸附过程。有机硫化物首先在Ni0表面分解,硫与Ni0结合生成Ni3S2;然后Ni3S2在氢气氛下被还原产生H2S,进而被吸附剂吸收,ZnO转化为ZnS。Siriwardane等[43]采用XPS、SEM-EDX、TG和原子吸收技术研究了Ni/ZnO吸附剂在含硫高温煤气的脱硫过程中元素组成的变化。硫化过程中,在吸附剂小球的外层部分,发生明显的Ni向颗粒外表面迁移的现象,引起外表面Ni浓度变化;硫主要集中在小球外表面,形成一层致密的Ni3S2层,从而阻止了硫向内层的扩散;而小球内层则不存在上述现象,表明小球内层的气体扩散阻力较大。
Bezverkhyy等[44]采用TG,XRD,TEM技术,研究了噻吩在Ni/SiO2和Ni/ZnO表面的反应吸附行为。在反应温度280~360 ℃,噻吩-氢混合气中噻吩分压0.5~4.0 MPa的条件下,噻吩在Ni/SiO2上的吸附过程包括以下步骤:首先是迅速的表面反应,随后是缓慢的体相转变生成Ni3S2,Ni的最大转化率取决于反应条件;噻吩的转化和活性位Ni0的硫化反应均符合一级动力学方程。而噻吩与Ni/ZnO的相互作用与之有较大不同:首先发生类似于Ni/ SiO2体系的迅速的硫化学吸附,随后是受成核机理控制的ZnO的表面硫化,与Ni/SiO2吸附剂不同,Ni/ZnO中Ni的体相硫化反应没有发生,噻吩分解产生的含硫物种优先与ZnO发生反应;表面ZnS覆盖层形成后,总反应速率迅速下降。氢还原处理对Ni/ZnO吸附剂的活性有一定影响[45]。吸附剂氧化态前体NiO/ZnO可在不经任何预处理的情况下与噻吩发生反应,这归因于Ni0可在噻吩-氢气氛中原位生成,而预还原的Ni/ZnO的硫化速率反而较低,这是因为还原过程中Ni-Zn合金的生成使得Ni0活性位数量减少。固定床评价结果表明,脱硫过程中不存在H2S,表明H2S可迅速与ZnO反应,Ni催化分解噻吩为整个反应的决速步骤。因此,预还原Ni/ZnO吸附剂较低的反应速率归因于可利用的Ni活性位较少。吸附剂部分硫化后,决速步骤发生改变,对于预还原Ni/ZnO体系变为噻吩的扩散,而氧化态NiO/ ZnO体系的反应速率受扩散和加氢脱硫双重控制。
3 结语
随着环保法规的日益严格,世界各国对燃油标准特别是硫含量提出更加严格的要求,超清洁燃油生产已是大势所趋。吸附脱硫作为新兴的脱硫技术,因其投资和操作费用低、脱硫效率高、能在缓和条件下生产硫含量在50 μg/g以下的低硫车用燃油而备受关注。尽管吸附脱硫技术在整体上还处于研发阶段,但其工业化前景为业内人士所看好。由ZnO脱硫机理可知,把ZnO制成纳米级颗粒,粒径的减小使比表面积增大,表面活性位增多,这些特殊的性质是普通材料所不具备的。在Ni/ZnO反应吸附脱硫体系中,ZnO起到硫载体的作用,如何提高ZnO的载硫能力,对开发高活性的Ni/ZnO吸附剂至关重要。近年来纳米技术的研究发展日新月异,这也为脱硫剂的研究提供了更广阔的发展空间。所以,研究纳米ZnO晶体的合成方法及生长习性对提高ZnO基脱硫剂的性能具有重要意义。
[1] Babich I V,Moulijn J A. Science and Technology of Novel Processes for Deep Desulfurization of Oil Refinery Streams:A Review[J].Fuel,2003,82(6):607 - 631.
[2] 冯续,赵素云,李博. 影响氧化锌脱硫的因素[J]. 化学工业与工程技术,2010,31(4):31 - 34.
[3] Yang Liu,Zhou Jianer,Larbot A,et al. Preparation and Characterization of Nano-Zinc Oxide[J].J Mater Process Technol,2007,189(1/3):379 - 383.
[4] 王步国,施尔畏,仲维卓. 水热条件下ZnO微晶的结晶习性及其形成机理[J]. 硅酸盐学报,1997,25(2):223 - 228.
[5] 王久亮,刘宽,秦秀娟. 常压下均匀沉淀法纳米氧化锌的制备与表征[J]. 化学工程师,2004,100(1):11 - 13.
[6] 姜秀平,高艳阳,贾素云. 乙二胺对溶胶-凝胶法制备纳米ZnO形貌的影响研究[J]. 化学工程师,2007,136(1):14 - 16.
[7] 张经纬,王伟,吴志申. 均匀沉淀法制备一维结构的氧化锌[J]. 化学研究,2008,19(2):84 - 87.
[8] Bitenc M,Marinšek M,Crnjak Z. Preparation and Characterization of Zinc Hydroxide Carbonate and Porous Zinc Oxide Particles[J].J Eur Ceram Soc,2008,28(15):2915 - 2921.
[9] 徐志兵,陈金龙,胡智东. ZnO微球的制备及表征[J]. 石油化工,2007,36(1):83 - 87.
[10] 王佳,高峰. ZnO微晶的水热合成及形貌控制研究[J]. 化学研究,2007,18(1):23 - 27.
[11] 杨森,倪永红. 低维ZnO纳米材料[J]. 化学进展,2007,19(10):1510 - 1516.
[12] 娄天军,王天喜,王璐. ZnO一维纳米棒的水热法控制合成[J]. 河南科技学院学报,2007,35(2):35 - 37.
[13] 向群,刘荣利,施利毅. 水热合成一维氧化锌及其影响因素[J]. 上海大学学报,2006,12(3):283 - 287.
[14] Bitenc M,Crnjak Z. Synthesis and Characterization of Crystalline Hexagonal Bipods of Zinc Oxide[J].Mater Res Bull,2009,44(2):381 - 387.
[15] 朱汉财,王红娟,彭峰. 纳米ZnO薄片的制备、表征及其光催化降解性能[J]. 石油化工,2006,35(9):886 - 890.
[16] 李维华,张文慧,汤效平. 氧化锌的脱硫性能及其在工业中的应用[J]. 齐鲁石油化工,2004,32(2):100 - 102.
[17] 樊惠玲,郭汉贤,上官炬. 氧化锌颗粒脱硫中固体扩散动力学分析[J]. 燃料化学学报,2000,28(4):368 - 371.
[18] Li L,King D L. H2S Removal with ZnO During Fuel Processing for PEM Fuel Cell Applications[J].Catal Today,2006,116(4):537 - 541.
[19] Lee Y J,Park N K,Han G B,et al. The Preparation and Desulfurization of Nano-Size ZnO by a Matrix-Assisted Method for the Removal of Low Concentration of Sulfur Compounds[J].Curr Appl Phys,2008,8(6):746 - 751.
[20] Dvorak J,Jirsak T,Rodriguez J A. Fundamental Studies of Desulfurization Processes:Reaction of Methanethiol on ZnO and Cs/ZnO[J].Surf Sci,2001,479(1/3):155 - 168.
[21] Ito E,van Veen J A R. On Novel Processes for Removing Sulphur from Refinery Streams[J].Catal Today,2006,116(4):446 - 460.
[22] 徐文清,熊纯清,周广林. Ni/ZnO吸附剂脱除催化裂化汽油中的硫[J]. 石油学报:石油加工,2008,24(6):739 -743.
[23] 杨永兴,张玉良,王璐. Ni/ZnO吸附剂上溶剂油的超深度吸附脱硫[J]. 石油化工,2008,37(3):2 - 3.
[24] 张景成,柳云骐,安高军,等. 吸附脱硫技术生产清洁油品[J]. 化学进展,2008,20(11):1834 - 1845.
[25] 范景新,王刚,张文慧. Ni基吸附剂上催化裂化汽油反应吸附深度脱硫性能研究[J]. 现代化工,2009,29(增刊1):207 - 209.
[26] 李宝忠,张忠清,王凤秀. 汽油与柴油吸附脱硫技术研究与开发:Ⅰ.国内外发展现状[J]. 石油化工高等学校学报,2002,15(3):1 - 2.
[27] 石秋杰,杨静,李包友. Co、Mo掺杂对Ni/ZnO-ZrO2催化剂催化噻吩加氢脱硫性能的影响[J]. 分子催化,2009,23(2):130 - 134.
[28] 李治俊,石秋杰,李彬. 钕对Ni/ZnO催化剂催化噻吩加氢脱硫的改性研究[J]. 中国稀土学报,2008,26(5):521 -524.
[29] Khare G P,Greenwood G J. Hot Gas Desulfurization with Z-Zorb Sorbents[J].Prepr-Am Chem Soc Div Fuel Chem,1999,44(3):711 - 715.
[30] 刘文勇,张文成,刘玉鹏. 吸附脱硫技术在清洁燃料生产中的研究与应用进展[J]. 工业催化,2005,13(增刊):2 -4.
[31] 菲利浦石油公司.吸附剂组合物:中国,1147979 A [P]. 1997-04-23.
[32] 菲利浦石油公司. 吸附剂组合物、其生产方法及其在脱硫中的用途:中国,1382071 A[P]. 2002-11-27.
[33] 菲利浦石油公司. 脱硫方法及用于脱硫的双金属吸附剂体系:中国,1382199 A[P]. 2002-11-27.
[34] 菲利浦石油公司. 脱硫和用于脱硫的吸附剂:中国,1422177 A[P]. 2003-06-04.
[35] 杨静,石秋杰,李包友. ZnO基复合载体负载Ni催化剂催化噻吩加氢脱硫[J]. 南昌大学学报,2009,33(1):42 - 45.
[36] Ko C H,Park J G,Park J C,et al. Surface Status and Size Influences of Nickel Nanoparticles on Sulfur Compound Adsorption[J].Appl Surf Sci,2007,253(13):5864 - 5867.
[37] Park J G,Ko C H,Yi K B,et al. Reactive Adsorption of Sulfur Compounds in Diesel on Nickel Supported on Mesoporous Silica[J].Appl Catal,B,2008,81(3/4):244 - 250.
[38] Tawara K,Nishimura T,Iwanami H,et al. New Hydrodesulfurization Catalyst for Petroleum-Fed Fuel Cell Vehicles and Cogenerations[J].Ind Eng Chem Res,2001,40(10):2367 - 2370.
[39] Tawara Kinys,Imai Jun,Iwanami Hikoichi. Ultra-Deep Hydrodesulfurization of Kerosene for Fuel Cell System: Part 1. Evaluations of Conventional Catalysts[J].Sekiyu Gakkaishi,2000,43(2):105 - 113.
[40] Tawara Kinys,Nishimura Takeshi,Iwanami Hikoichi. Ultra-Deep Hydrodesulfurization of Kerosene for Fuel Cell System: Part 2. Regeneration of Sulfur-Poisoned Nickel Catalyst in Hydrogen and Finding of Auto-Regenerative Nickel Catalyst[J].Sekiyu Gakkaishi,2000,43(2):114 - 120.
[41] Song C. An Overview of New Approaches to Deep Desulfurization for Ultra-Clean Gasoline,Diesel Fuel and Jet Fuel[J].Catal Today,2003,86(1/4):211 - 263.
[42] Huang Lichun,Wang Guofu,Qin Zhangfeng,et al. A sulfur K-Edge XANES Study on the Transfer of Sulfur Species in the Reactive Adsorption Desulfurization of Diesel Oil over Ni/ZnO[J].Catal Commun,2010,11(7):592 - 596.
[43] Siriwardane R V,Gardner T,Poston J A,et al. Spectroscopic Characterization of Nickel Containing Desulfurization Sorbents[J].Ind Eng Chem Res,2000,39(4):1106 - 1110.
[44] Bezverkhyy I,Ryzhikov A,Gadacz G,et al. Kinetics of Thiophene Reactive Adsorption on Ni/SiO2and Ni/ZnO[J].Catal Today,2008,130(1):199 - 205.
[45] Ryzhikov A,Bezverkhyy I,Bellat J P. Reactive Adsorption of Thiophene on Ni/ZnO:Role of Hydrogen Pretreatment and Nature of the Rate Determining Step[J].Appl Catal,B,2008,84(3/4):766 - 772.
Research Progress in the Synthesis of ZnO and Its Application in Oil Desulfurization
Tian Shuang,Liu Yunqi,She Nannan,Liu Chenguang
(State Key Laboratory of Heavy Oil,Key Laboratory of Catalysis,CNPC,China University of Petroleum(East China),Qingdao Shandong 266555,China)
Based on the analysis of the growth habit and synthetic methods for ZnO crystals,the research on the synthesis of ZnO with different morphologies in recent years is described. And the desulfurization mechanism on ZnO-based sorbents is introduced,which provides a theoretical basis for the application of ZnO in oil desulfurization. ZnO with different physicochemical properties including morphology,pore structure and so on can be obtained by different preparation methods. In the desulfurization processes,the effects of the physicochemical properties and sulfur capacity of ZnO as a main ingredient in the sorbents on improving the desulfurization are significant. ZnO is used in S-Zorb reactive desulfurization technological process and its development is analyzed. It is proposed that the research on ZnO with special features is an important direction to improve the performance of ZnO-based sorbents.
zinc oxide;adsorption desulfurization;S-Zorb;nicekl;desulfurization mechanism
1000 - 8144(2012)08 - 0965 - 09
TQ 624.431
A
2012 - 12 - 20;[修改稿日期]2012 - 06 - 11。
田双(1986—),女,辽宁省营口市人,硕士生。电话 13854244063,电邮 upctians@163.com。联系人:柳云骐,电话 0532 - 86981861,电邮 liuyq@upc.edu.cn。
(编辑 安 静)
