阿魏酸过渡金属配合物的合成及抗凝血作用研究
2012-11-09王璞玉卞常鑫姚小强宋玉民
王璞玉 吴 冰 卞常鑫 姚小强 宋玉民*,
(1西北师范大学化学化工学院,兰州 730070)(2兰州军区陆军总医院血液科,兰州 730050)
阿魏酸过渡金属配合物的合成及抗凝血作用研究
王璞玉1吴 冰2卞常鑫1姚小强1宋玉民*,1
(1西北师范大学化学化工学院,兰州 730070)(2兰州军区陆军总医院血液科,兰州 730050)
用阿魏酸与Fe、Co、Ni、Cu、Zn的硝酸盐制备了5种过渡金属配合物,通过红外光谱、热重-差热分析、元素分析、荧光和紫外光谱的方法对配合物进行了表征,确定了配合物的组成。并对配体和配合物进行了全血凝血时间、复钙时间、活化部分凝血活酶时间、凝血酶原时间的测定,结果表明5种配合物具有较好的抗凝血性质。通过荧光光谱、紫外光谱、圆二色谱研究了配合物与人血清白蛋白(HSA)的相互作用,HSA的荧光光谱表明配合物对其有荧光猝灭作用并使其发射峰位置红移,紫外光谱表明配合物的加入导致HSA吸收强度增加且吸收峰位置紫移,圆二色谱表明配合物的存在可引起HSA构象的变化。推测配合物抗凝血作用的起效与其和血清白蛋白之间的相互作用有一定的联系。
阿魏酸配合物;合成与表征;抗凝血作用;人血清白蛋白
近年来,血栓栓塞性疾病越来越受到人们的关注,它是一类严重危害人类健康和生命的疾病,可发生于静脉、动脉和微血管,从而表现出各种症状,是致病、致残、死亡的直接原因之一[1-2]。华法灵钠、肝素、枸橼酸钠是常用的抗凝血药物,长期服用容易导致自发性出血。故研究和开发新的抗凝血药物,不仅有药物学家的参与,而且吸引了生物和化学家的关注与参与,如焦天权,蒋德炉等曾研究过稀土元素配合物的抗凝血性质[3-5]。本课题组研究了过渡金属华法灵配合物、稀土元素华法灵配合物、过渡金属华法灵水杨酸配合物、稀土元素华法灵水杨酸配合物、肝素过渡金属纳米氧化物材料、肝素稀土金属纳米氧化物材料的抗凝血性能,研究结果表明配合物的抗凝血性能均优于配体[6-9]。为了解配合物的抗凝血作用机理,还对配合物与血液中最丰富的蛋白质人血清白蛋白之间的作用进行过探讨[10-11]。
广泛存在于当归、川穹、阿魏、升麻中的阿魏酸(Ferulic acid,化学名称为4-羟基-3-甲氧基肉桂酸(图1)),具有抗氧化、抗动脉粥样硬化、抗炎、抗凝血等多种药理学作用,因此广泛应用于医药、食品、化妆品等领域,如临床上可用于冠心病、脑血管病、白细胞和血小板减少症等疾病的治疗[12-14]。但由于阿魏酸分子中含有双键,属于亲水基团,很难透过生物膜双分子层,因此对阿魏酸进行修饰以得到阿魏酸衍生物成为研究的热点之一,而且阿魏酸衍生物具有更强的药理活性[15]。微量元素虽然在人体内的含量不多,但与人的生存和健康息息相关,对人的生命起至关重要的作用。它们的摄入过量、不足、不平衡或缺乏都会不同程度地引起人体生理的异常或发生疾病。而有关阿魏酸过渡金属配合物合成和性能的研究少见报道。因此,合成阿魏酸过渡金属配合物,并研究其性质,在发挥抗凝血性能的同时,又可为人体提供必需的微量元素,具有较强的理论和实际意义。本文报道了阿魏酸与过渡金属Fe、Co、Ni、Cu、Zn配合物的合成及其抗凝血性能,采用荧光光谱、紫外吸收光谱和圆二色谱的方法对配合物与人血清白蛋白之间的作用进行了研究。为开发新的抗凝血药物和研究其抗凝血作用机理提供了一定的实验基础。

图1 阿魏酸的分子结构Fig.1 Molecular structure of ferulic acid
1 实验部分
1.1 仪器和试剂
Agilent-8453紫外分光光度计 (美国Agilent公司);FTS-3000型红外光谱仪 (美国PE公司,KBr压片,摄谱范围 4 000~400 cm-1);TG/DTA-6300 热重-差热分析仪 (美国PE公司);PerkinElmer 2400 CHN型元素分析仪 (美国PE公司);LS-55荧光分光光度计(美国PE公司);J-810圆二色谱仪 (日本Jasco公司)数显智能控温磁力搅拌器(巩义市英峪予华仪器厂);恒温水浴锅(郑州长城科工贸有限公司);KQ-100M超声波清洗器(东莞市科桥超声波设备有限公司)。
人血清白蛋白(HSA)(国药集团化学试剂有限公司);阿魏酸(上海中秦化学试剂有限公司);配制10 mmol·L-1Tris-HCl 缓 冲 溶 液 ,pH=7.47(内 含 50 mmol·L-1的NaCl溶液维持离子强度);其余试剂均为分析纯。
1.2 实验方法
1.2.1 配合物的合成
分别称取 0.75 mmol阿魏酸,0.5 mmol六次甲基四胺和0.25 mmol的过渡金属硝酸盐于圆底烧瓶中,用15 mL 95%的乙醇溶液进行溶解,在80℃条件下加热回流搅拌12 h,最后将沉淀过滤,洗涤,烘干,得到粉末状产物。
1.2.2 配合物溶液的配制、荧光光谱及紫外光谱的测定
配体及配合物用二次蒸馏水和0.10 mL的吐温-80 溶解,并超声 10 min,配制成 2.0 mmol·L-1的溶液待用。实验时的溶液浓度分别为0.2 mmol·L-1,20 μmol·L-1,2.0 μmol·L-1。
移取 3 mL 2.0 μmol·L-1的阿魏酸及阿魏酸配合物溶液于1 cm石英比色池中,在25℃下,以λex=310 nm为激发波长,记录320 nm~390 nm波长范围的荧光光谱。
移取 3 mL 2.0 μmol·L-1的阿魏酸及阿魏酸配合物溶液于1 cm石英比色池中,以二次蒸馏水为参比,扫描200~400 nm的紫外光谱。
1.2.3 全血凝血实验
取7组干净的试管,每组3支。第1组为空白组,第 2、3、4、5、6、7 组分别为阿魏酸(FA)、阿魏酸合铁(FA-Fe)、阿魏酸合钴(FA-Co)、阿魏酸合镍(FA-Ni)、阿魏酸合铜(FA-Cu)、阿魏酸合锌(FA-Zn)(加入溶液的浓度均为 2.0 mmol·L-1,体积为 0.25 mL)。将空白组试管和加好样品的6组试管放入37℃水浴中进行恒温,之后沿各试管壁加入1 mL人血,继续在水浴中恒温2 min,同时开启秒表,每隔30 s以30°倾斜度轻轻倾斜试管进行观察,直至血液不再流动为止,记录该时间为全血凝血时间。
使用上述实验方法测定 0.2 mmol·L-1和 20 μmol·L-1溶液的凝血时间。
1.2.4 复钙实验
将配体及配合物固体放入 0.154 mol·L-1的生理盐水中浸泡24 h,烘干。取7组洁净的试管,每组3 支。第 1 组为空白组,第 2、3、4、5、6、7 组分别加入0.1 g 的 FA,FA-Fe,FA-Co,FA-Ni,FA-Cu,FA-Zn,37℃水浴恒温2 min。向7组试管中分别加入人血0.3 mL,0.025 mol·L-1的 CaCl2溶液 0.3 mL, 置于 37 ℃水浴中恒温,同时开启秒表,将一根不锈钢小钩伸入溶液中均匀缓慢地搅动,并检查是否有纤维蛋白的形成。当小钩上刚出现丝状物时,记录时间,此时间即为复钙时间。
1.2.5 抗凝血活性实验
采用活化部分凝血活酶时间(APTT)和凝血酶原时间(PT)2个指标[16]来考查配体和配合物对凝血系统的影响。取13支洁净的试管,第1支为空白样, 第 2~13 支分别加入浓度为 0.2 和 2.0 mmol·L-1的阿魏酸及阿魏酸过渡金属配合物溶液0.25 mL。向13支试管中分别加入0.5 mL血浆,快速加入CaCl2溶液,37℃水浴恒温后,记录出现纤维蛋白丝的时刻,该时间为APTT。凝血酶原时间实验中,快速加入PT试剂,记录凝固时间,该时间为PT。
1.2.6 阿魏酸配合物与人血清白蛋白的荧光光谱
用 Tris-HCl缓冲溶液配制 100 μmol·L-1的HSA溶液,移取该溶液3 mL于1 cm石英比色池中,用微量进样器加入不同体积的阿魏酸配合物溶液,在25℃下反应5 min后,以λex=290 nm为激发波长,记录300~420 nm波长范围的荧光光谱。
1.2.7 阿魏酸配合物与人血清白蛋白的紫外光谱
移取 3 mL 100 μmol·L-1的 HSA 溶液于 1 cm石英比色池中,用微量进样器加入不同体积的阿魏酸配合物溶液,在25℃下反应5 min后,以Tris-HCl缓冲溶液为参比溶液,扫描260~300 nm的紫外光谱。
2 结果与讨论
2.1 配合物表征
2.1.1 红外光谱
图2为FA与配合物的红外图谱。从图中可以看出,FA分子羧酸中O-H的面外变形振动吸收峰出现在950 cm-1~900 cm-1[17],羰基振动峰出现在1 686 cm-1,而配合物红外吸收曲线在1 000 cm-1~900 cm-1范围无吸收峰,羰基振动峰出现在1 637~1 660 cm-1,初步推测配体的羧酸失去质子,羧基的羟基氧和羰基氧与金属离子发生配位。配体在3 425 cm-1处的酚羟基伸缩振动吸收峰,形成配合物后变成了一个平滑的宽峰(3400cm-1~3600 cm-1),是配体酚羟基振动吸收峰与水分子羟基的对称和反对称伸缩振动吸收峰的叠加结果[18],说明在配合物中存在有水分子。
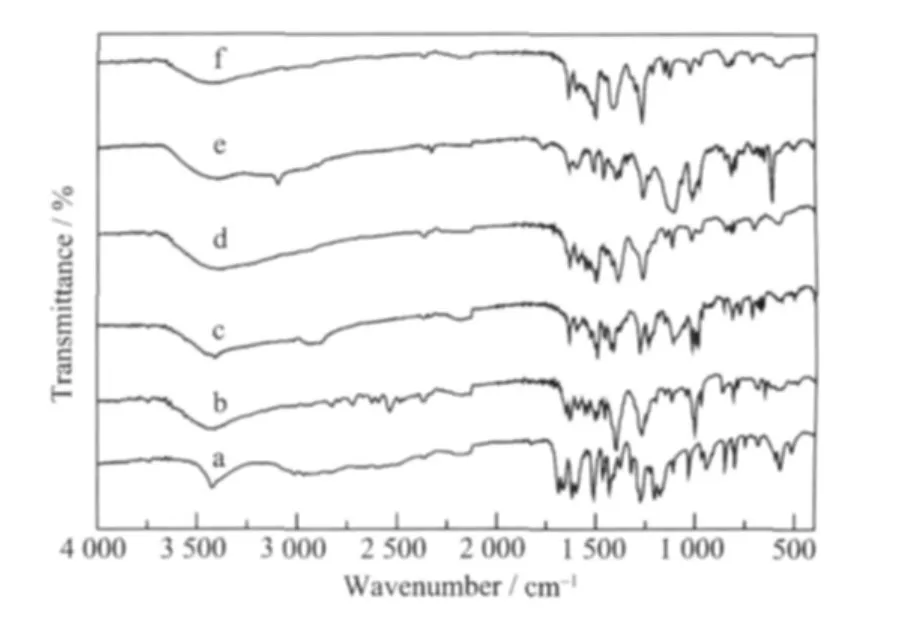
图2 红外光谱图Fig.2 IR of compounds
2.1.2 配合物的热分析
以α-Al2O3为参比,以10℃·min-1为升温速率,在N2气保护下从室温升至750℃,得配合物热重-差热(TG-DTA)曲线。表1列出了配合物的TG-DTA数据。图3为阿魏酸铜(FA-Cu)配合物的TG-DTA曲线图。
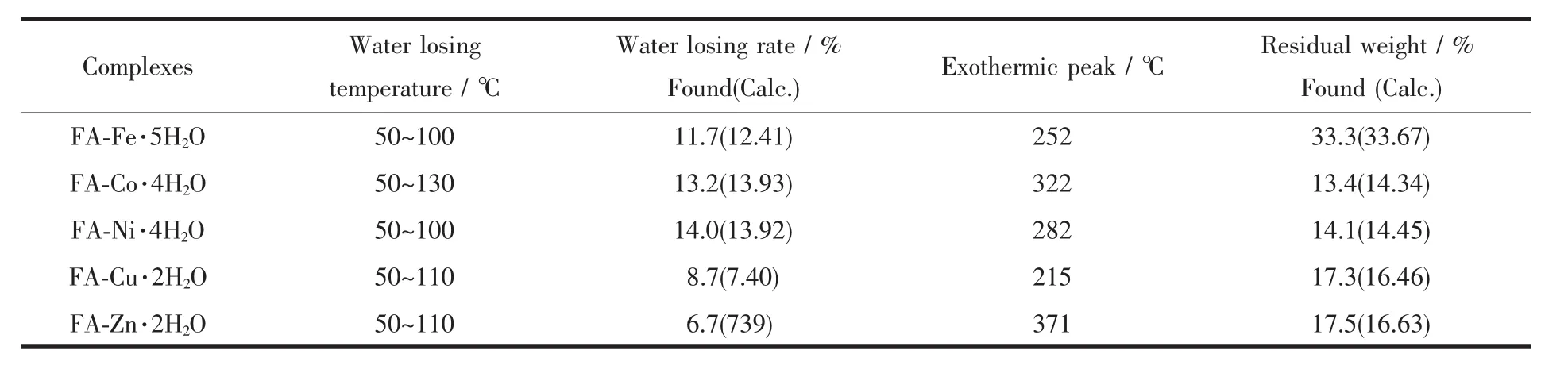
表1 配合物的TG-TDA数据Table 1 TG-TDA Data of Complexes
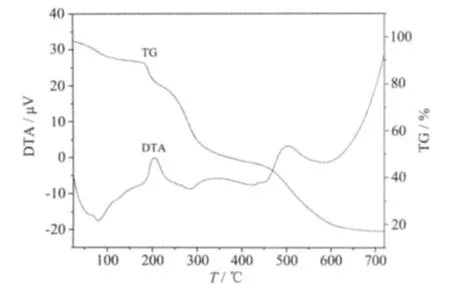
图3 热重-差热谱图(FA-Cu)Fig.3 TG-DTA curve of Compound(FA-Cu)
从图3中可以看出,100℃以下失重的吸热峰是配合物失去结晶水的表现,通过计算,失重量近似于2个结晶水的质量分数。随着温度的升高,DTA曲线向上移动,在200~550℃产生的2个放热小峰为配合物骨架断裂、配体分解的结果。600℃左右分解完全,最终产物为金属氧化物。通过配合物的热重曲线,初步推算了配合物所含的结晶水分子数目(表1)。与文献报道的阿魏酸分解温度190℃相比[19],配合物的分解温度在200℃以上,表明配合物的稳定性大于配体。
2.1.3 配合物的光谱性质
以λex=310 nm为激发波长,阿魏酸及配合物在λem=342 nm附近有荧光发射峰。图4为在室温条件下,2.0 μmol·L-1阿魏酸与配合物的荧光光谱图。 配合物与配体的荧光发射峰位置相同,而配合物的荧光发射峰强度均比配体阿魏酸的荧光发射峰强度为低。荧光强度的变化,说明过渡金属离子和阿魏酸发生了配位作用[20-22],配合物均有一定程度的荧光猝灭作用,其中FA-Co的荧光猝灭作用最强。
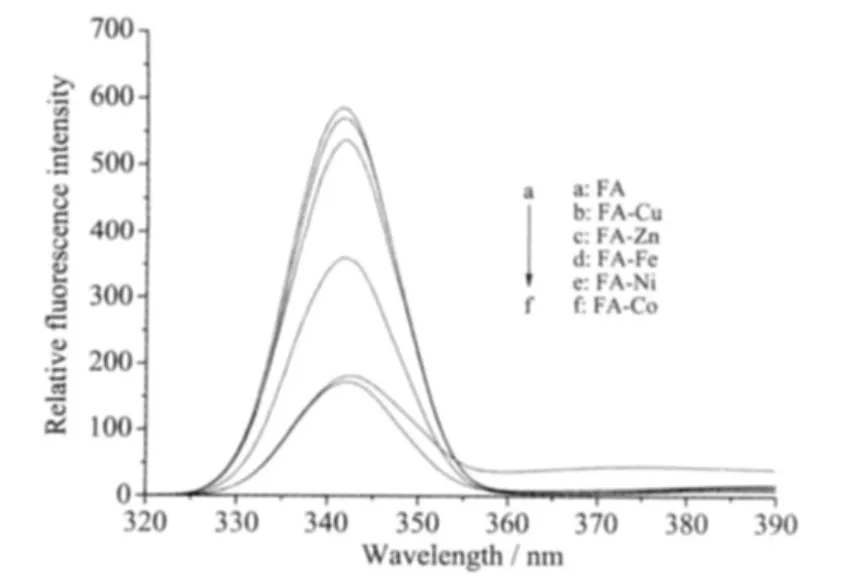
图4 阿魏酸和配合物的荧光光谱Fig.4 Emission spectra of ferulic acid and complexes
图5为阿魏酸与阿魏酸过渡金属配合物的紫外光谱图。由图可知,配合物与配体相比,吸收强度略微降低,这可能是由于阿魏酸和金属配位后,使得配位原子周围的电子云密度发生变化,从而影响了共轭分子轨道的能级状态[23]。这也进一步说明阿魏酸与金属离子发生了配位作用。
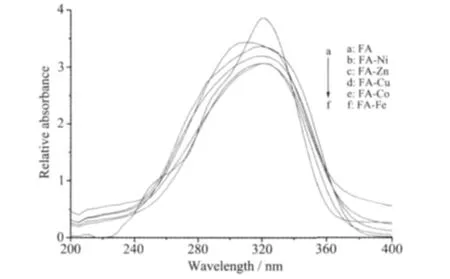
图5 阿魏酸和配合物的紫外光谱Fig.5 UV absorption spectra of ferulic acid and complexes
2.1.4 配合物的组成
配合物的元素分析实验结果与理论值基本吻合,结合热重分析测试结果,推测配合物的组成及元素分析结果如表2所示。
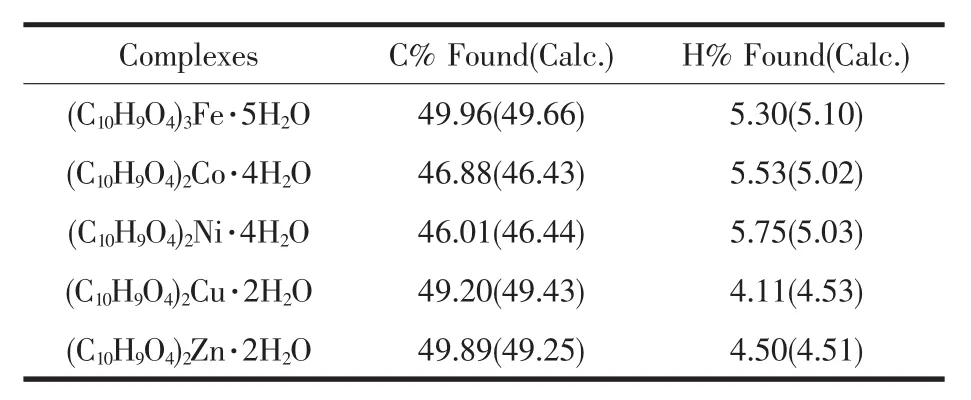
表2 配合物的元素分析Table 2 Elemental analysis of complexes
2.2 抗凝血实验
2.2.1 全血凝血实验
表3是空白样、阿魏酸与配合物的凝血时间。从表中可以看出,空白样的凝血时间最短,其次是配体阿魏酸,5种配合物的凝血时间均大于配体,这说明过渡金属与阿魏酸形成的配合物具有较好的抗凝血性质,其中阿魏酸钴的抗凝血时间最长。在人体凝血体系中,凝血因子Ⅳ(Ca2+)几乎参与了血液凝固的整个过程[24]。本实验合成的阿魏酸配合物加入血液后,由于过渡金属离子和Ca2+的拮抗作用[25],使得凝血过程中的有效Ca2+减少,进而影响凝血过程中其它必需Ca2+参与的凝血因子的激活及凝血复合物的形成,阻止了凝血酶原转化为凝血酶,因此,配合物的有效抗凝血时间得以延长。
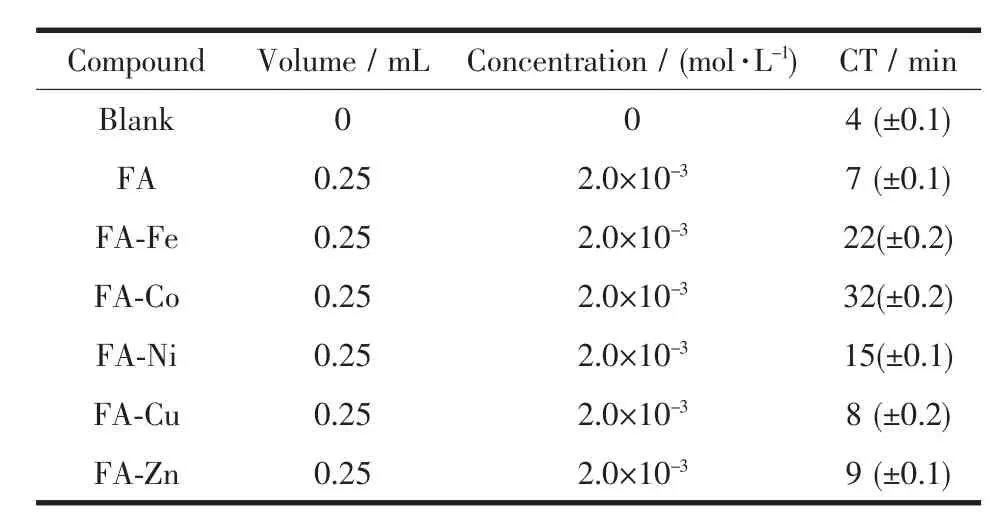
表3 配体和配合物的凝血时间Table 3 Coagulation time of ligand and complexes
2.2.2 浓度对凝血时间的影响
表4为不同浓度的阿魏酸及配合物的凝血时间。从表中可以看出,随着浓度的增加,配体和配合物的凝血时间均有延长。但是如果浓度过大,离子会在人体内大量累计,不利于新陈代谢,甚至会危害健康[7]。在同一浓度时,与配体相比,5种配合物的凝血时间稍有延长,且在相同浓度时阿魏酸钴的凝血时间较其它配合物为长。
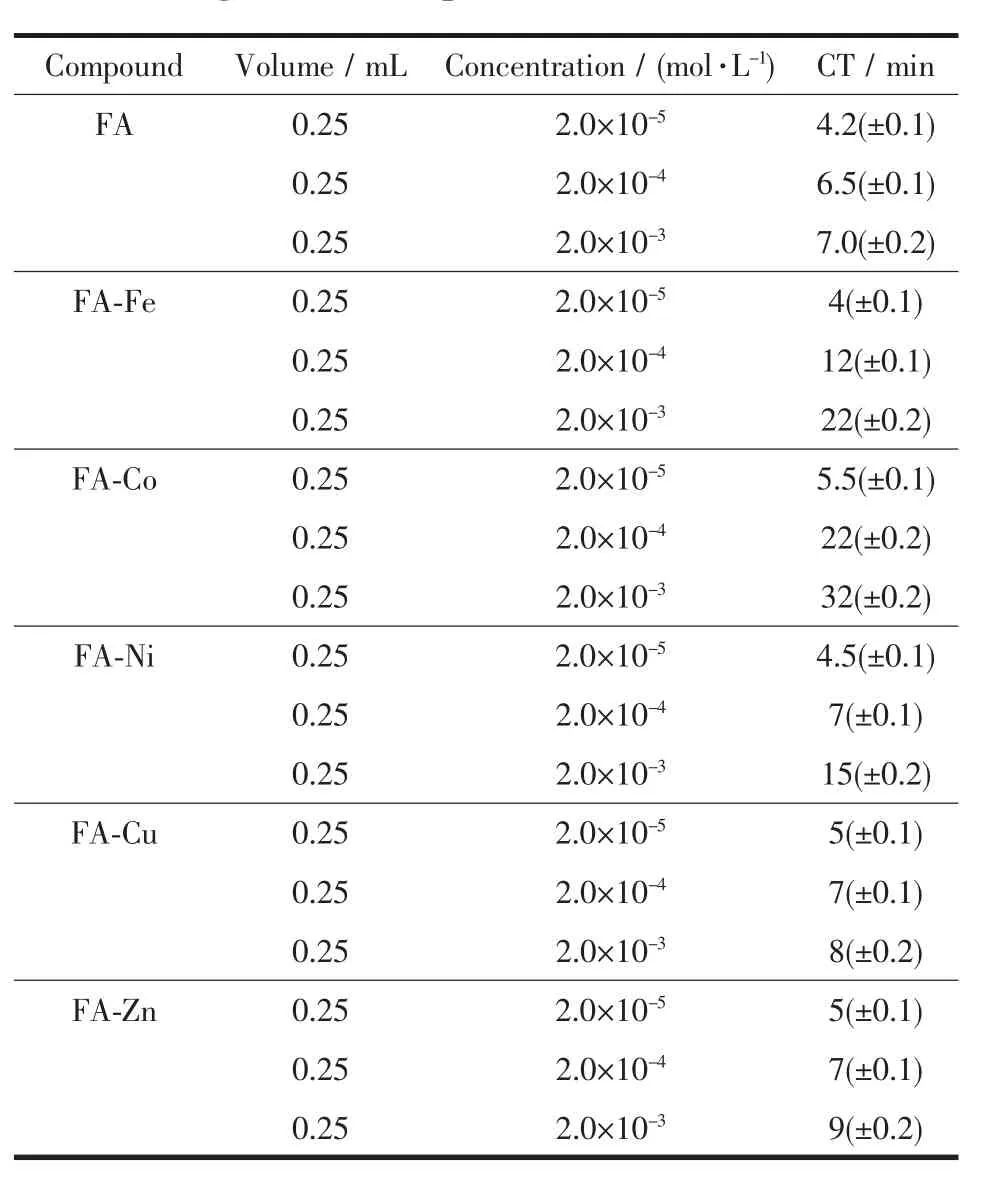
表4 不同浓度的阿魏酸及配合物的凝血时间Table 4 Coagulation time of different concentrations′ligand and complexes
2.2.3 复钙实验
表5为阿魏酸及配合物的复钙时间。从表中数据可知,不加任何物质的空白样的复钙时间最短,其次是阿魏酸,这说明配体阿魏酸具有抗凝血作用,5种配合物的复钙时间均长于配体,因此,配合物的抗凝血性优于配体,其中阿魏酸钴的性质最好,这与前面所做的凝血时间实验相一致。

表5 配体及配合物的复钙时间Table 5 Recalcification time of ligand and complexes
2.2.4 凝血活性综合实验
活化部分凝血活酶时间和凝血酶原时间是内源性凝血活性和外源性凝血活性的综合性检查。二者的延长表明存在先天性凝血因子异常或多种凝血因子的缺乏及循环抗凝血素的增加的可能性。从表6的实验结果可以看出:(1)与对照组相比,配体及5种过渡金属配合物的APTT、PT时间有所延长,这是由于在实验组的血液中加入了配体或配合物,说明配体及配合物都存在一定的抗凝血作用。(2)同等实验条件下,浓度较大的配合物溶液比浓度较小的配合物溶液的APTT、PT时间稍有延长,这表明抗凝作用与浓度有关,浓度越大,抗凝时间越长。(3)在表中所列的实验条件下,配体及配合物的APTT、PT测试时间结果均符合正常值,因此,少量配合物在体外血液中的加入并没有引起血液性质的较大变化,此种配合物可为临床抗凝血药物的筛选提供实验依据。
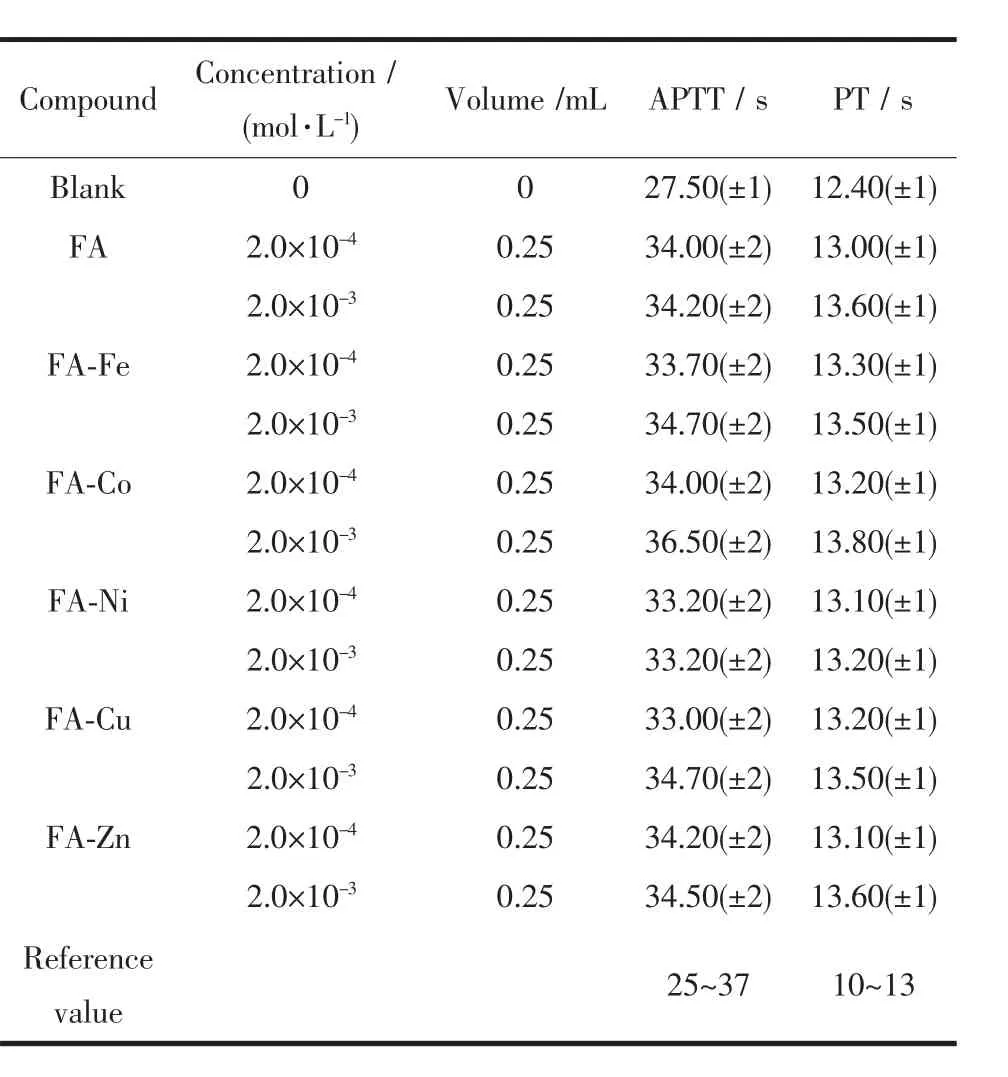
表6 配体及配合物的凝血活性实验Table 6 Coagulant activity of ligand and complexes
2.3 阿魏酸配合物与人血清白蛋白的相互作用
2.3.1 阿魏酸配合物与人血清白蛋白的荧光光谱
蛋白质中存在3种芳香氨基酸:色氨酸、酪氨酸、苯丙氨酸,它们荧光强度比为 100∶9∶0.5,因此主要考虑色氨酸、酪氨酸这两种氨基酸对人血清白蛋白荧光强度的贡献。
图6为阿魏酸铜配合物在20℃时对HSA溶液荧光光谱的影响。以λex=290 nm为激发波长,HSA在λem=339 nm附近有荧光发射。固定HSA溶液的浓度,依次加入配合物溶液,随着配合物浓度的增加,HSA体系在λem=339 nm处的荧光强度没有因为与配合物的发射峰位置几乎相同而增加,而是有规律的减小,且发射峰位置有一定程度的红移 (从339 nm移至350 nm),这说明配合物与人血清白蛋白发生一定作用,从而产生了荧光猝灭。(由于HSA溶液的体积3 mL远大于配合物累加的最大体积90 μL,故忽略稀释效应对HSA荧光强度的影响。)HSA在λem=339 nm产生荧光是由蛋白质中的色氨酸残基导致的。色氨酸残基的发射波长与它所处的环境有关,荧光发射峰略有红移,这可能是由于HSA的空间构象发生了较小变化,色氨酸残基周围的疏水性降低而引起的[26]。配体和其它配合物与HSA作用的荧光光谱图与铜配合物的相似,说明配合物对HSA荧光强度的猝灭主要是配体引起的。
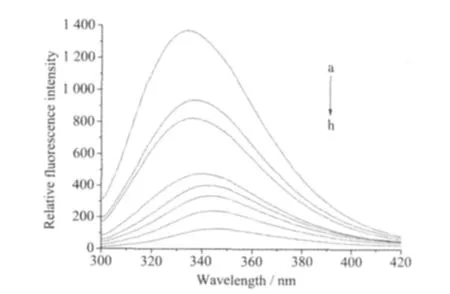
图6 FA-Cu对HSA荧光光谱的影响Fig.6 Effect of FA-Cu on fluorescence spectra of HSA from a to h curves cFA-Cu/(μmol·L-1):0,5,10,20,30,40,50,60
2.3.2 阿魏酸配合物与人血清白蛋白的紫外光谱
图7为不同浓度的阿魏酸铜配合物对HSA紫外光谱的影响。从图中可知,HSA在280 nm处有吸收峰,是由其肽链上的色氨酸和酪氨酸的苯杂环ππ*跃迁引起的。当在HSA的溶液中加入铜配合物溶液时,随着配合物浓度的增加,HSA溶液的吸收峰强度逐步增加,吸收峰位置略有紫移(从280 nm移至275 nm),说明过渡金属配合物与HSA分子发生了作用,诱导HSA分子发生类似降低pH值出现的蛋白质肽链伸展现象[27],使包围在HSA分子内部的色氨酸和酪氨酸残基的芳杂环疏水基团裸露出来,导致HSA构象发生了小的变化,从而使吸收强度增强,吸收峰略微紫移。配体和其它配合物对HSA紫外光谱的影响与铜配合物的影响类似。
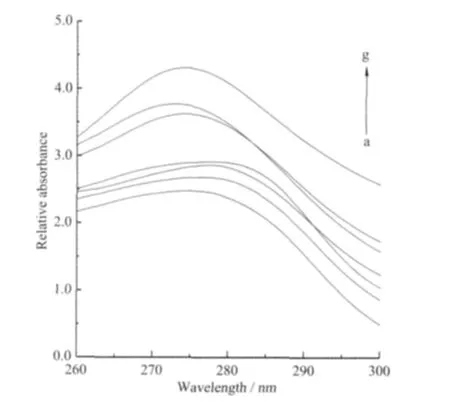
图7 FA-Cu对HSA紫外光谱的影响Fig.7 Effect of FA-Cu on the absorption spectra of HSA from a to g curves cFA-Cu/(μmol·L-1):0,5,10,20,30,40,50
2.3.3 阿魏酸配合物与人血清白蛋白的圆二色谱
HSA是具有光学活性的物质,所以通过测量HSA的CD图谱,可以了解HSA的构象[28]。当在HSA的溶液中加入其它物种之后,可以通过观察其CD图谱的变化进一步了解其结构的变化。
图8所示,随着铜配合物浓度的增加,HSA分子典型的二级结构α-螺旋在209 nm和222 nm处的负峰略微向低波数方向移动[29],并且相应的振幅也逐渐地减弱。表明配合物与HSA分子发生了较强的相互作用,相应振幅的减弱,说明α-螺旋结构部分减少,从而导致HSA肽链有一定程度的伸展,HSA的二级结构有所变化[30]。其它配合物对HSA圆二色光谱的影响与铜配合物的影响类似。
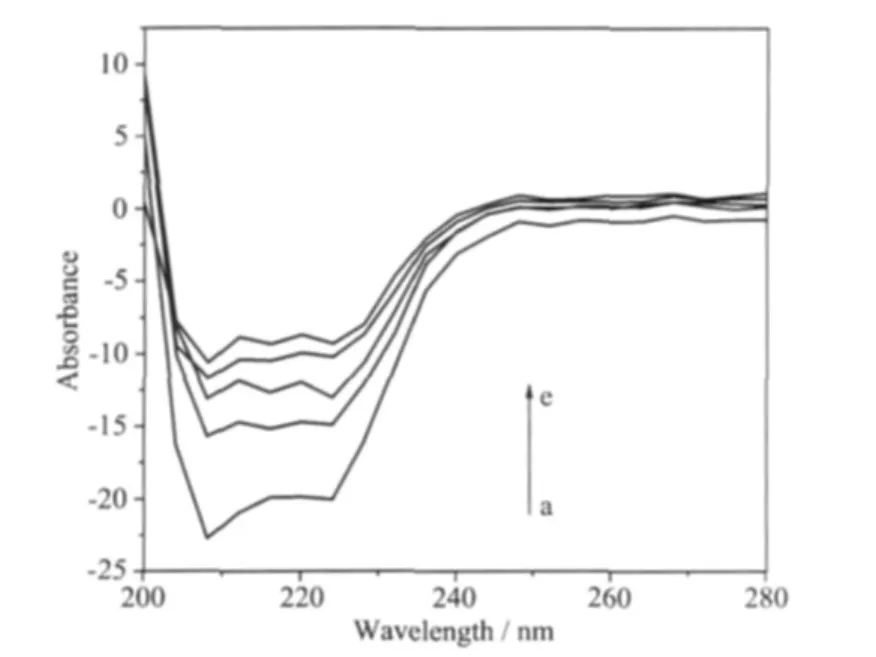
图8 FA-Cu对HSA溶液的CD光谱的影响Fig.8 Effect of FA-Cu on the CD spectra of HSA solution CHSA=0.1 μmol·L-1;pH=7.34 from a to e curves CFA-Cu(0.01 μmol·L-1):0,0.5,1.2,3.0,6.0,respectively
3 结 论
用阿魏酸与过渡金属硝酸盐合成了5种配合物。通过元素分析、热重-差热分析、红外光谱、荧光光谱、紫外吸收光谱,初步确定阿魏酸与金属离子发生了配位,并确定了配合物的组成。抗凝血实验表明配合物较配体具有好的抗凝血性质,配合物浓度与配合物的抗凝血时间长短有直接的联系,浓度越大,抗凝时间越长。阿魏酸配合物对HSA溶液荧光光谱和紫外光谱的影响表明,阿魏酸配合物对HSA溶液的荧光有一定的猝灭作用并使发射峰位置有一定的红移,可使HSA溶液的紫外吸收强度有所增加并使吸收峰位置有些紫移。由阿魏酸配合物对HSA溶液的圆二色谱的影响,推测配合物的抗凝血作用是通过与HSA分子发生了作用,并使HSA的构象发生变化导致蛋白质溶解性能变化而实现。少量配合物在体外血液中的加入并没有引起血液性质的较大变化,此种配合物的抗凝血性能可为临床抗凝血药物的筛选提供实验依据。
[1]HU Da-Yi(胡大一),SUN Yi-Hong(孙艺红).Chin.J.Pract.Inter.Med.(Zhongguo Shiyong Neike Zazhi),2006,26(16):1293-1294
[2]WANG Yi-Long(王伊龙),WANG Chun-Xue(王春学),WANG Yong-Jun(王拥军).Cerebrovas,Diseases Foreign Med.Sci.(Guowai Yixue Naoxueguan Fence),2005,13(6):418-421
[3]Jiao T Q,Wu J G,Zeng F L,et al.Synth.React.Inorg.Met.-Org.Chem.,1999,29(5):725-735
[4]JIANG De-Lu(蒋德炉),ZHU Guang-Jun(朱广军),DENG Ru-Wen(邓汝温),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),1995,11(1):15-18
[5]ZHU Yuan-Cheng(朱元成),YAO Ka-Ling(姚卡玲),LI Ying(李英),et al.J.Lanzhou Univ.(Lanzhou Daxue Xuebao),2005,41(6):61-64
[6]SONG Yu-Min(宋玉民),XIAN Ping(缐萍).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(4):631-636
[7]WANG Kun-Jie(王坤杰),LUAN Ni-Na(栾尼娜),SONG Yu-Min(宋玉民).Acta Chim.Sin.(Huaxue Xuebao),2009,67(10):1042-1046
[8]DONG Yin-Long(董银龙),SONG Yu-Min(宋玉民).Acta Chim.Sin.(Huaxue Xuebao),2008,66(12):1497-1500
[9]SONG Yu-Min(宋玉民),DONG Yin-Long(董银龙),FU Yun-Long(付云龙),et al.Acta Chim.Sin.(Huaxue Xuebao),2007,65(8):678-682
[10]ZHANG Qiong(张琼),SONG Yu-Ming(宋玉民),LIU Jia-Cheng(刘家成),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(9):1772-1780
[11]SONG Yu-Min(宋玉民),LIU Zhe(刘哲),WANG Kun-Jie(王坤杰),et al.Acta Chim.Sin.(Huaxue Xuebao),2010,68(21):2191-2198
[12]YIN Hua-Fang(殷华芳),QIAN Xiao-Ping(钱晓萍),LIU Bao-Rui(刘宝瑞).Mod.J.Integ.Trad.Chin.West.Med.(Xiandai Zhongxiyi Jiehe Zazhi),2010,19(32):4238-4240
[13]ZHAODong-Ping(赵东平),YANGWen-Yu(杨文钰),CHENG Xin-Fu(陈兴福).Lishizhen Med.Mater.Medic.Res.(Shizhen Guoyi Guoyao),2008,19(8):1839-1841
[14]Zhao H,Moghadasian H.Food Chemistry,2008,109:691-702
[15]MA Feng-Shi(马逢时),LI Jia-Ming(李家明).Asia-Pac.Med.Trad.(Yatai Chuantong Yiyao),2008,4(5):55-57
[16]CHEN Yu(陈于),XU Can(徐灿),SU Jia-Can(苏佳灿),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(4):625-630
[17]NING Yong-Cheng(宁永成).Structural Identification of Organic Compounds and Organic Spectroscopy(有机化合物结构鉴定与有机波谱学).Beijing:Science Press,2000:368-382
[18]DENG Su-Jun(邓苏君),LIU Yan-Zhu(刘艳珠),FU Mao-Sheng(傅毛生),et al.Chin.J.Rare Metals(Xiyou Jinshu),2009,33(1):114-118
[19]ZHOU Cai-Rong(周彩荣),AN Na(安娜),SHI Xiao-Hua(石晓华),et al.J.Zhengzhou Univ.(Zhengzhou Daxue Xuebao),2007,28(2):47-48
[20]YANG Pin(杨频),GAO Fei(高飞).Principles of Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:329-331
[21]CHEN Guo-Zhen(陈国珍),HUANG Xian-Zhi(黄贤智),XU Jin-Gou(许金鈎),et al.Fluofescence Analysis.2nd Ed.(荧光分析.2版).Beijing:Scince Press,1990:201-212
[22]LU Yan(卢雁),GAO Sheng-Hua(高胜华),WANG Yun-Lai(王运来),et al.Chin.Sci.Bull(Kexue Tongbao),2009,54(14):2071-2075
[23]YANG Xiao-Na(杨晓娜),JIANG Heng(姜恒),GONG Hong(宫红).Appl.Chem.Ind.(Yingyong Huagong),2007,36(11):1058-1060
[24]FAN Xiao-Li(樊小力).Physiology(生理学).Beijing:People′s Medical Publishing House,2002:54-60
[25]ZHONG Hong-Hao(周宏灏).Pharmacology(药理学).Beijing:Science Press,2007:318-329
[26]CHEN Ke-Hai(陈克海),ZHENG Xue-Fang(郑学仿),GUO Ming(郭明).Acta Chim.Sin.(Huaxue Xuebao),2007,65(7):1887-1891
[27]LI Xiao-Jing(李晓晶),WANG Zhi-Qiang(王志强),CHEN Ji(陈继).Chinese.J.Appl.Chem.(Yingyong Huaxue),1998,15(1):5-8
[28]YANG Pin(杨频),GAO Fei(高飞).Principles of Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:45-59
[29]ZONG Xiao-Hong(宗小红),ZHOU Ping(周平),SHAO Zeng-Zhong(邵正中),et al.Chin.Sci.Bull.(Kexue Tongbao),2005,50(11):1080-1084
[30]SHEN Xin-Cang(沈星灿),LIANG Hong(梁宏),HE Xi-Wen(何锡文),et al.Chin.J.Anal.Chem.(Fenxi Huaxue),2004,33(3):388-394
Synthesis and Anticoagulant Properties of Transition Metal Complexes with Ferulic Acid
WANG Pu-Yu1WU Bing2BIAN Chang-Xin1YAO Xiao-Qiang1SONG Yu-Min*,1
(1College of Chemistry and Chemical Engineering,Northwest Normal University,Lanzhou 730070,China)
(2Department of Hematology,General Hospital of Lanzhou Military District of PLA,Lanzhou 730050,China)
The complexes of(C10H9O4)xM·mH2O(M=Fe,Co,Ni,Cu,Zn)were obtained by the reaction of ferulic acid with metal ions in ethanol solution by solvent-thermal method.The composition of this complexes were characterized by IR,UV,fluorescence spectra,TG-DTA and elemental analysis methods.Meanwhile,the anticoagulant properties of ferulic acid and its complexes were tested by coagulation time (CT),recalcification time(RT),activated partial thromboplastin time(APTT),and prothrombin time(PT).The results showed that the complexes all have better anticoagulant action than that of ferulic acid in related anticoagulant experiments.It was observed that ferulic acid and the complexes could reduce the fluorescence intensity and enhanced the UV intensity of human serum albumin (HSA).The precense of complexes can cause a change of the human serum albumin conformation.The interaction between HSA and the complexes may be the one of reasons for anticoagulant function of the complexes.
complexes of ferulic acid;synthesis and characterization;anti-clotting properties;human serum albumin
O614.121;O614.81
A
1001-4861(2012)08-1609-08
2012-03-08。收修改稿日期:2012-04-06。
国家自然科学基金(No.21062017),甘肃省教育厅(1101-05),甘肃省高分子材料重点实验室资助项目。*
。 E-mail:songym@nwnu.edu.cn;会员登记号:S06N8225M1006。
