2-(2′-吡啶基)苯并噁唑和甘氨酸铜配合物的结构、抑菌活性及与DNA作用
2012-11-09区志镔黄山华乐学义
区志镔 黄山华 乐学义*,,2
(1华南农业大学理学院应用化学系,广州 510642)
(2华南农业大学生物材料研究所,广州 510642)
2-(2′-吡啶基)苯并噁唑和甘氨酸铜配合物的结构、抑菌活性及与DNA作用
区志镔1黄山华1乐学义*,1,2
(1华南农业大学理学院应用化学系,广州 510642)
(2华南农业大学生物材料研究所,广州 510642)
本文以2-(2′-吡啶基)苯并噁唑、甘氨酸和高氯酸铜(Ⅱ)为原料合成了新的三元配合物:[Cu(PBO)(Gly)(H2O)]ClO4(PBO=2-(2′-吡啶基)苯并噁唑,Gly=甘氨酸根)。应用元素分析、红外光谱、紫外可见光谱、摩尔电导率等方法对配合物进行了表征。X-射线单晶衍射测得该配合物晶体属正交晶系,Pca21空间群,晶胞参数:a=1.029 2(2)nm,b=1.032 9(2)nm,c=1.566 8(3)nm;Z=4,V=1.665 6(6)nm3,Dc=1.800 g·cm-3,F(000)=916。最终偏离因子:R1=0.042 6,wR2=0.101 3。利用试管二倍稀释法测定了配合物的抗菌活性,通过电子吸收光谱、荧光光谱和粘度测定研究了配合物与DNA的作用。结果表明,与2-(2′-吡啶基)苯并噁唑相比较,该配合物对枯草杆菌(B.subtilis,G+),金黄色葡萄球菌(S.aureus,G+),苏云金芽孢杆菌(B.thuringiensis,G+),水稻条斑病细菌(X.oryzae,G-),大肠杆菌(E.coil,G-)和沙门氏杆菌(Salmonella,G-)具有良好的抑制活性,并且以插入方式与DNA作用。
铜(Ⅱ)配合物;2-(2-吡啶基)苯并噁唑;甘氨酸;抗菌活性;DNA
0 引 言
2-取代苯并噁唑衍生物是一类重要的杂环化合物,具有抗菌、抗病毒、抗氧化、抗癌等生物活性,其作用机制可能与化合物对DNA的作用有关[1-5]。并且发现当这类化合物与金属离子形成配合物时可进一步提高其生物活性,因此研究2-取代苯并噁唑衍生物金属配合物有重要意义[6-8]。
2-(2′-吡啶基)苯并噁唑(PBO)(Scheme 1)是一类重要的2-取代苯并噁唑衍生物,具有良好的抗菌、抗真菌和抗寄生物等活性[3],铜是重要的生命元素,参与生物体中许多生命过程,而L-α-氨基酸是重要的生物配体,当在金属配合物中插入这类氨基酸时,可以增加配合物对生物细胞膜的渗透性,降低药物的毒性,有助于细胞对药物吸收而提高其生物活性[9],故本文以 2-(2′-吡啶基)苯并噁唑、甘氨酸和高氯酸铜(Ⅱ)为原料合成了新的三元配合物[Cu(PBO)(Gly)(H2O)]ClO4(PBO=2-(2′-吡啶基)苯并噁唑,Gly=甘氨酸根)。用试管二倍稀释法测定了该配合物的抑菌活性,并应用电子吸收光谱、荧光光谱和粘度测定等方法研究了配合物与DNA的作用。
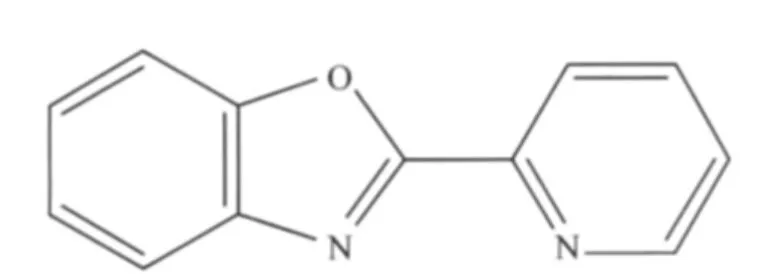
Scheme 1 Molecular structure of 2-(2′-pyridyl)benzoxazole
1 实验部分
1.1 试剂及仪器
2-(2′-吡啶基)苯并噁唑参照文献方法[10]制备。甘氨酸、三羟甲基氨基甲烷、营养肉汤和小牛胸腺DNA(CT-DNA)为生化试剂,其它试剂为市售分析纯。研究配合物与DNA作用时,反应体系为10 mmol·L-1Tris(三羟甲基氨基甲烷)-HCl+50 mmol·L-1NaCl缓冲溶液(pH=7.2),参照文献[11]确定小牛胸腺DNA浓度。整个实验过程均使用二次蒸馏水。
Vario EL元素分析仪,ELEMENTAR公司;Bruker Smart 1K CCD单晶衍射仪,Bruker公司;ACATAR 360 FT-IR型红外光谱仪(KBr压片),美国Nicolet公司;Shimadzu UV-2550型紫外/可见分光光度计,日本Shimadzu公司;DDS-12A型电导率仪,上海宇隆仪器有限公司;F-4500型荧光光谱仪,日本HITACHI公司;乌氏粘度计,上海晶菱玻璃有限公司。
1.2 配合物合成
将0.5 mmol 2-(2′-吡啶基)苯并噁唑和0.5 mmol Cu(ClO4)2·6H2O分别溶于20 mL无水乙醇和1 mL水中,混合搅拌反应10 min后,向溶液中滴加5 mL含0.5 mmol甘氨酸及0.5 mmol NaOH的水溶液。加热搅拌回流20 min后,液冷过滤,静置15 d后析出适合于X-射线单晶衍射测定的蓝绿色晶体。
对配合物进行元素分析并测定其红外光谱(IR)、紫外可见光谱(UV-Vis)和摩尔电导率。IR(KBr),ν/cm-1:3 460(s,br),3 340(w),3 074(w),1 652(vs),1 431(s),1440(w);UV-Vis,λ/nm(ε/(L·mol-1·cm-1)):230(8 653),303(15 312),638(98);EA(%),Found:C,37.10;H,3.17;N,9.22;Calc forC14H14ClCuN3O8:C,37.26;H,3.13;N,9.31。 ΛCH3OH/(S·cm2·mol-1):113。
1.3 晶体结构测定
室温下,选取大小为 0.33 nm×0.43 nm×0.44 mm的晶体置于Bruker Smart 1K CCD型单晶衍射仪上,以石墨单色化的 Mo Kα(λ=0.071 073 nm)辐射为光源,在2.6°≤θ≤27.1°范围内收集到10 297个衍射数据,其中独立衍射点(Rint=0.030)和I≥2σ(I)的可观察点分别为3 476和3 113个。吸收校正采用SADABS程序,数据收集和晶胞修正采用Smart程序,SAINT+程序用于数据还原。晶体结构用直接法解出,氢原子为理论加氢,对非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正。所有计算均由SHELXTL97晶体结构分析软件包完成[12]。 最终偏离因子:R1=0.042 6,wR2=0.101 3。 w=1/[σ2(Fo2)+(0.069 7P)2+0.192 0P],其中 P=(Fo2+2Fc2)/3。有关晶体学数据见表1。
CCDC:852991。
1.4 抑菌试验
本文采用试管二倍稀释法测定化合物最小抑菌浓度(MIC),具体操作步骤与我们以前报道的相类似[13]。试验所用菌株由华南农业大学农学院-广东省植物分子育种重点实验室提供,为枯草杆菌(B.subtilis,G+)、金黄色葡萄球菌(S.aureus,G+)、苏云金芽孢杆菌 (B.Thuringiensis,G+),水稻条斑病细菌(X.Oryzae,G-),沙门氏杆菌(Salmonella,G-)和大肠杆菌(E.coil,G-)来自于华南农业大学农学院-广东省植物分子育种重点实验室。
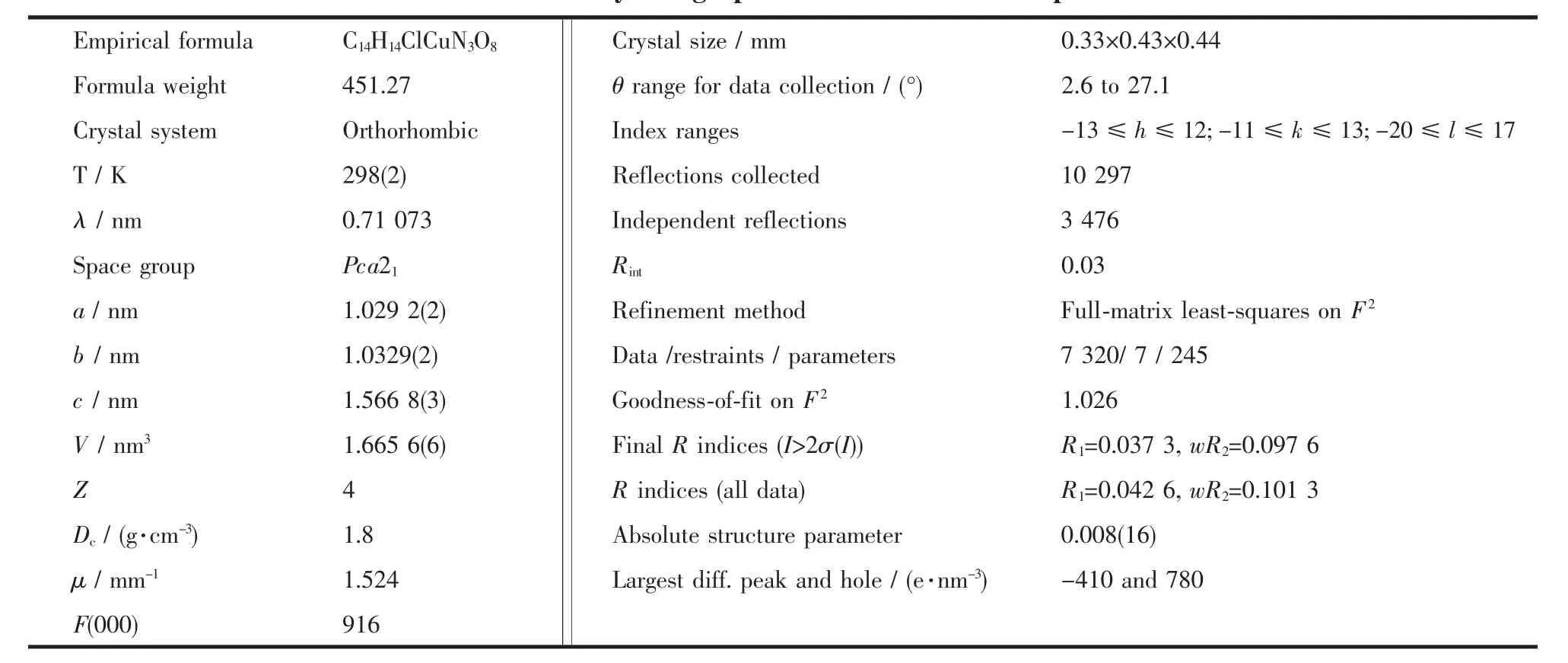
表1 配合物的晶体学数据Table 1 Crystallographic data for the title complex
1.5 配合物与DNA作用
1.5.1 电子吸收光谱测定
在样品池和空白池中分别加入 5.36×10-5mol·L-1标题配合物溶液和3 mL Tris-HCl/NaCl缓冲溶液,在195~400 nm范围内扫描。然后,每次往样品池和空白池中加入同体积的CT-DNA溶液,使样品池中CT-DNA与配合物的浓度比值不断增加。充分摇匀并静置6 min后在上述同样波长范围内扫描测定电子吸收光谱。
1.5.2 荧光光谱测定
激发波长为525 nm和扫描速度为240 nm·s-1下,在550~650 nm波长区间扫描并记录系列配合物/CT-DNA/溴化乙锭(EB)体系的荧光强度变化。在系列试样溶液中,依此增加配合物的浓度,而EB和 CT-DNA 的浓度分别恒定为 4.8 μmol·L-1和 5.5 μmol·L-1。
1.5.3 粘度测定
在恒定温度((29±0.1)℃)下,固定 CT-DNA 浓度为0.2 mmol·L-1,逐渐增大配合物浓度。测定不同r(CComplex/CDNA)值下配合物与CT-DNA混合溶液流经毛细管所需的时间t,然后按照公式:η=(t-t0)/t0(t0为缓冲溶液流经毛细管所需时间)计算溶液的相对粘度,并以(η/η0)1/3对 CComplex/CDNA(η0为 r=0 时 CT-DNA溶液的相对粘度)作图。
2 结果与讨论
2.1 配合物表征
测得配合物在甲醇溶液中的摩尔电导率为113 S·cm2·mol-1,表明配合物为 1∶1 型电解质[14]。
用KBr压片法测定了配合物在400~4 000 cm-1范围内的红外光谱。3 460 cm-1处强而宽的红外吸收峰归属于H2O的ν-O-H;3 340和3 074 cm-1处2个弱吸收带归属于甘氨酸根中-NH2基团的2个不对称分裂吸收峰ν-N-H;1 652和1 431 cm-1处2个强吸收带分别为甘氨酸根中-COO-基团的非对称伸缩振动νas(COO-)和对称伸缩振动νs(COO-),且之间差值Δν(νas(COO-)-νs(COO-)=221 cm-1)>200 cm-1,表明-COO-为单齿配位基团[15]。 此外,1 440 cm-1处弱吸收可归属于2-(2′-吡啶基)苯并噁唑芳环上的C=N的伸缩振动ν-C=N。
测定了配合物甲醇溶液室温下在200~800 nm范围内的紫外可见光谱。紫外区228和303 nm处2个强吸收峰归属于配体2-(2′-吡啶基)苯并噁唑的π→π*跃迁。与未配位2-(2′-吡啶基)苯并噁唑的相关吸收峰相比,这些吸收峰的位置未发生明显改变,但强度有所减弱,归因于该配体上的氮原子配位后导致其芳环上电子云密度的降低。另外,可见光区638 nm处弱而宽的吸收峰可归因于配合物分子中中心Cu(Ⅱ)离子的d→d跃迁,并且由此推测配合物分子具有变形四方锥结构[16]。
2.2 配合物晶体结构
X-射线单晶衍射结果表明,配合物属于正交晶系,Pca21空间群。晶体由配阳离子[Cu(PBO)(Gly)(H2O)]+和阴离子ClO-4堆积而成。配合物的部分键参数列于表2中,而中心金属铜(Ⅱ)离子的配位结构如图1所示。
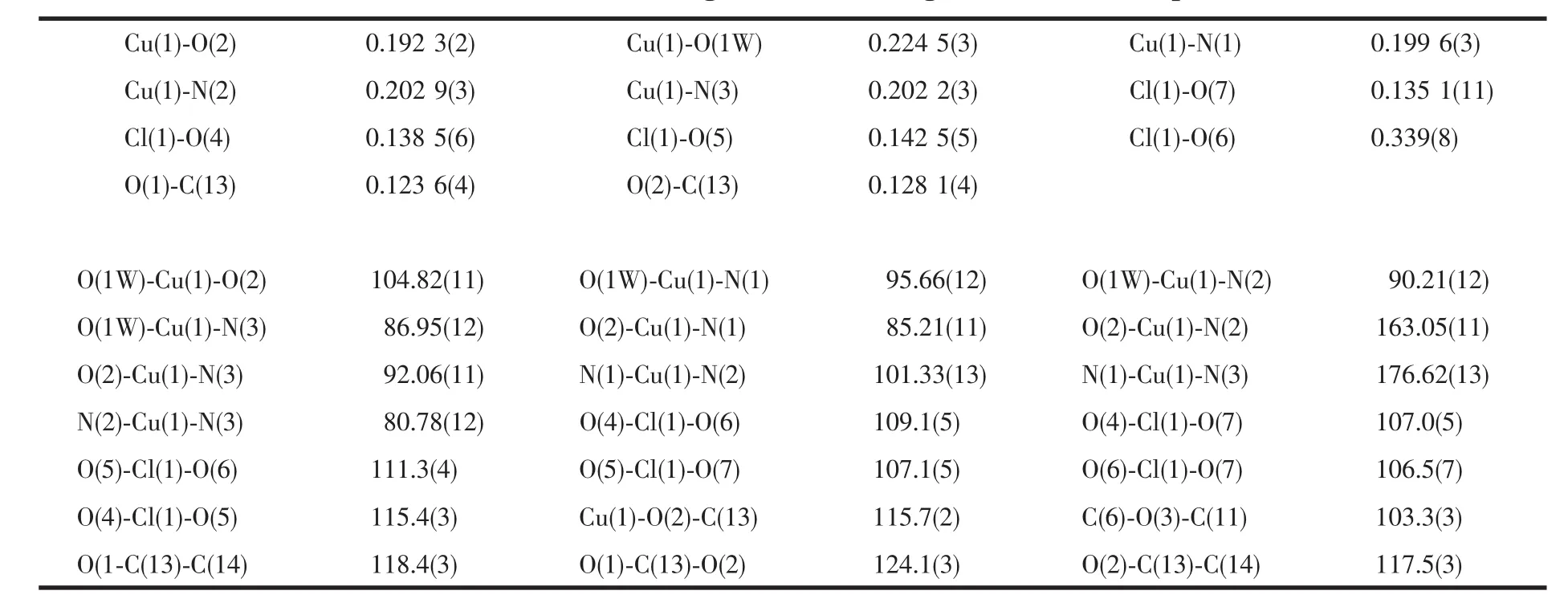
表2 配合物的部分键长和键角Table 2 Selected bond lengths(nm)and angles(°)for the complex

表3 配合物部分氢键参数Table 3 Selected hydrogen bond parameters for the complex

图1 配合物分子结构Fig.1 Molecular structure for the complex with thermal ellipsoids at the 35%probability level
在配阳离子[Cu(PBO)(Gly)(H2O)]+中,每个Cu(Ⅱ)离子与一个Gly(N,O)、一个PBO(N,N)及一个H2O(O)作用形成五配位的变形四方锥构型。其中PBO(N,N)与Gly(N,O)位于四方锥平面上,而H2O(O)配位在四方锥顶点上,配位键键长、键角与多吡啶-铜(Ⅱ)-L-α-氨基酸配合物[17-21]分子中相关的键长、键角相近。 分子中 O(2),N(1),N(2),N(3)和 Cu(1)所处的平面方程为:-0.583 2x+0.055 1y+0.810 4z=-5.285 8,且这些原子偏离该平面值分别为-0.014 75,0.007 38,-0.013 82,0.008 93和0.012 26 nm,表明这5个原子都基本上处在同一个平面上。
表3中数据表明,晶体中高氯酸根与配阳离子[Cu(PBO)(Gly)(H2O)]+中PBO芳环C以及配位水之间存在氢键,而Gly中未配位羧基氧和配位羧基氧分别与另一配阳离子中配位水及Gly的氨基氮形成氢键,由此在配合物晶体中产生了一个三维氢键网络结构(图 2)。

图2 配合物晶体中氢键作用Fig.2 Hydrogen bonds in the crystal for the complex
另外,配合物晶体中通过配阳离子[Cu(PBO)(Gly)(H2O)]+中PBO的吡啶环与邻近配离子中PBO的噁唑环之间的π-π堆积作用形成的一维阶梯状结构(图3)。 堆积平面之间夹角为 6.7°,平面垂直距离为0.331 38 nm,而质心Cg1与Cg2B之间及Cg2与Cg1A之间距离均为0.377 72 nm,其堆积方向与晶体二重轴向垂直。
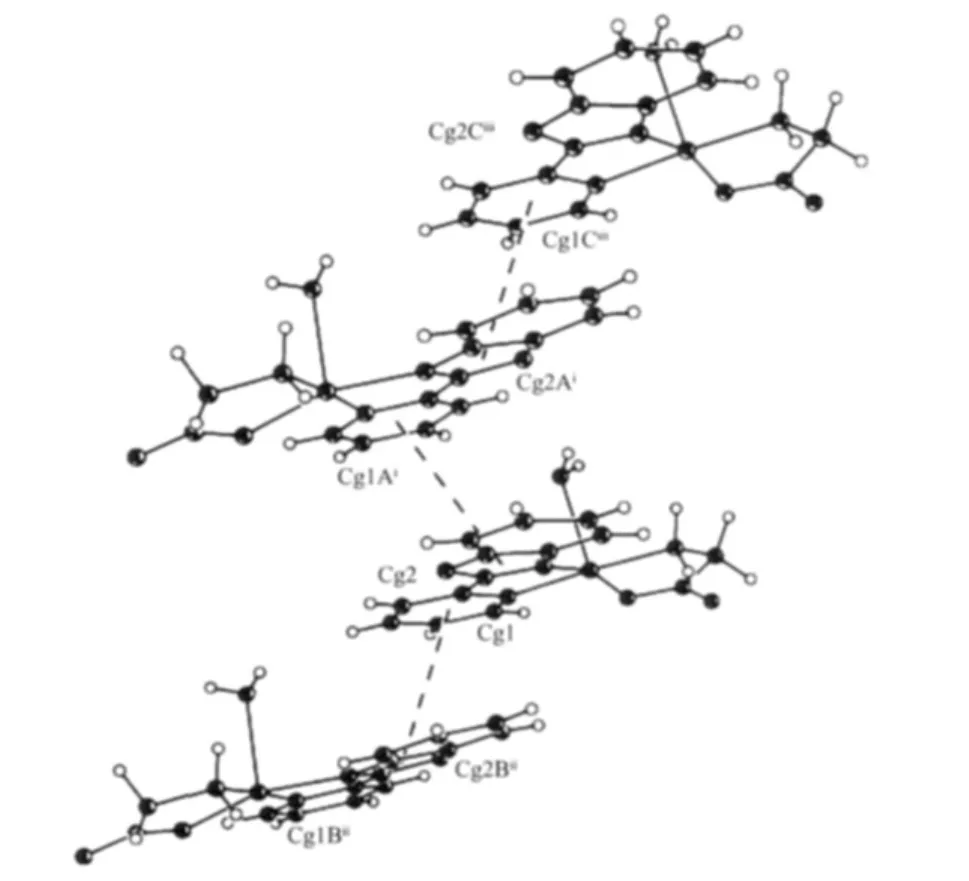
图3 阳离子[Cu(PBO)(Gly)(H2O)]+之间π-π堆积作用Fig.3 π-π stacking interactions between[Cu(PBO)(Gly)(H2O)]+cations
2.3 配合物抑菌活性
将试验化合物配成浓度为1 000 μg·mL-1的原液,通过试管二倍稀释法配制成系列浓度溶液,细菌最终接种量为 5×106CFU·mL-1,恒温(37℃)恒湿(RH>80%)下培养 24 h。 测得 Cu(ClO4)2、PBO 和配合物抑制细菌最低浓度(MICs)[22]如表4所示。
结果表明,对于同一种菌种,配合物抑制细菌生长的最低浓度明显小于Cu(ClO4)2及PBO,表明配合物有相对较强的抗菌活性,这可能主要与金属铜(Ⅱ)离子与配体之间的螯合作用有关[23]。另外,类似于Cu(ClO4)2和PBO,配合物对革兰氏阴性菌(水稻条斑病细菌、大肠杆菌和沙门氏杆菌)的抑制作用大于革兰氏阳性菌(枯草杆菌、金黄色葡萄球菌和苏云金芽孢杆菌),究其原因有待于进一步研究。
2.4 配合物与DNA的相互作用
2-取代苯并噁唑衍生物生物活性作用机制可能与其对DNA的作用有关,因此研究主题配合物与DNA之间相互作用对探索其抗菌作用机理有重要意义。本文通电子吸收光谱、荧光光谱和粘度测定等方法研究了配合物与DNA的作用。
2.4.1 配合物与CT-DNA作用的电子吸收光谱
电子吸收光谱是研究配合物与DNA作用的最常用方法之一。标题配合物与CT-DNA作用的电子吸收光谱如图4所示。结果表明,随着CT-DNA浓度增加,配合物在195~400 nm波长范围内的π→π*跃迁吸收带发生了明显的减色效应,表明配合物与CT-DNA发生了作用。由于吸收峰红移现象不明显,推测只发生较弱的插入作用[24]。
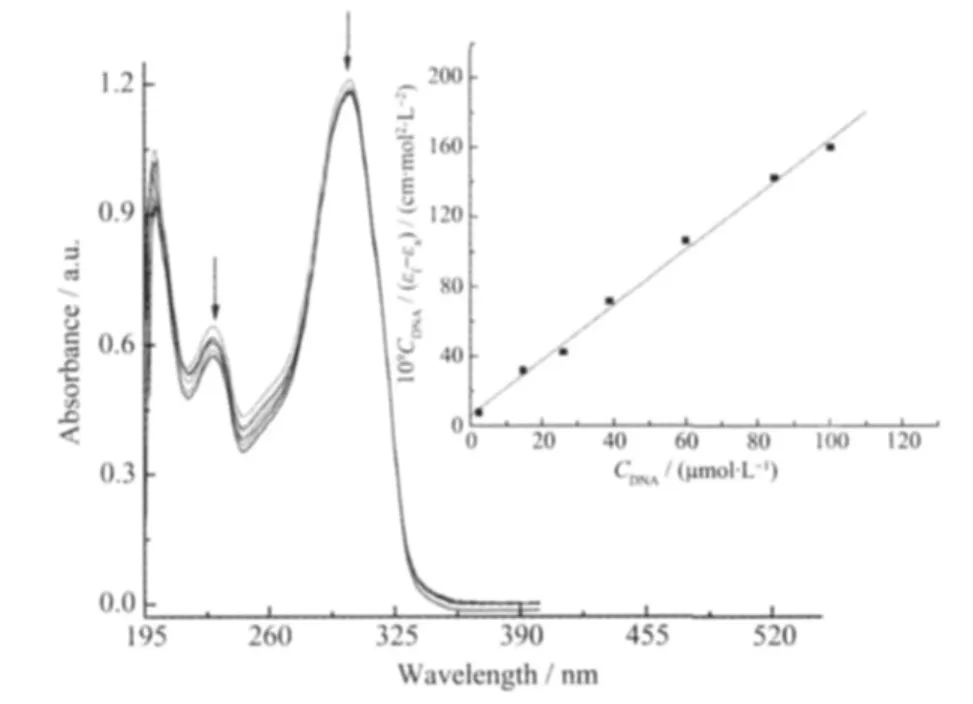
Arrows denote the increase direction in DNA concentration;Ccomplex=5.36×10-5mol·L-1,10-5CDNA/(μmol·L-1):0,2.36,1.48,26,38.9,60.1,84.8,100
为了定量研究配合物与CT-DNA作用程度的强弱,能够根据方程式:CDNA/(εa-εf)=CDNA/(εb-εf)+1/Kb(εb-εf)求得配合物与CT-DNA 的结合常数 Kb。式中CDNA表示CT-DNA的浓度,εa为配合物的表观摩尔吸光系数,εb和εf分别表示完全键合和自由的配合物摩尔吸光系数。以CDNA/(εf-εa)对CDNA作图得直线(图 4 中插图) 方程:y=1.5 819×10-3x+6.004 9×10-9,并由斜率与截距的比值求得配合物与DNA的结合常数Kb=2.634×105mol-1·L,远小于经典插入试剂溴乙锭(EB)对 DNA 的插入作用(Kb=1.4×106mol-1·L in 25 mmol·L-1Tris-HCl/40 mmol·L-1NaCl buffer,pH 7.9)[25]。

表4 化合物抑制细菌生长的最低浓度(MIC,μg·mL-1)Table 4 Minimal inhibitory concentrations(MIC,μg·mL-1)of the compounds for the assayed bactera
2.4.2 配合物与DNA作用的荧光光谱
溴化乙锭是一具有共轭芳香环的平面分子,其本身荧光很弱,但当插入到DNA双螺旋结构碱基之间时,其体系荧光显著增强。然而,当其它不产生荧光且对DNA具有插入作用的分子将EB从DNA双螺旋结构中挤出来时,EB-DNA体系荧光强度显著降低[26]。因此,对于不产生荧光配合物,可通过测定配合物浓度对DNA-EB体系荧光强度的影响来研究该配合物对DNA的作用。标题配合物不产生荧光,测得该配合物对EB-CT-DNA体系荧光光谱的影响如图5所示。
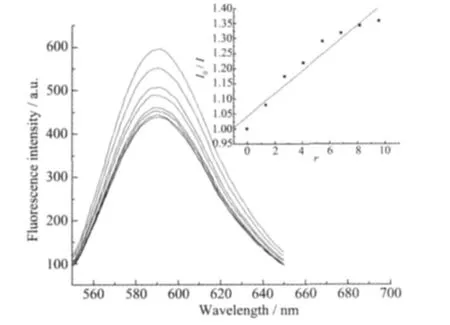
图5 配合物浓度对EB-CT-DNA体系荧光光谱的影响Fig.5 Effects of the complex on the fluorescence spectra of EB-CT-DNA system
实验结果(图5)表明,随着配合物浓度增加,EBCT-DNA体系荧光强度下降,由此推测有可能是配合物插入到DNA双螺旋结构的碱基对之间而将EB挤出。为了定量描述这种作用,可以应用经典Stern-Volmer方程:I0/I=1+Ksq求得配合物取代EB与DNA作用的猝灭常数Ksq[26]。式中I0和I为未加配合物和添加配合物时EB-DNA体系的荧光强度,r表示配合物与DNA的浓度比,即Ccomplex/CDNA。以I0/I对r作图获得直线 (图5中插图)方程式为:y=0.037 9x+1.042 4,由直线的斜率得Ksq=0.037 9,表明配合物对CT-DNA只有较弱的插入作用[27]。
2.4.3 配合物与DNA作用的粘度测定
在缺少晶体结构数据的情况时,粘度测定是研究配合物与DNA作用模式的最有效的方法之一[28-29]。配合物以部分插入方式与DNA结合时,则可能使DNA的双螺旋结构扭结,DNA溶液的粘度降低;以静电或沟面等非插入模式方式结合时,DNA溶液的黏度变化不大;而通过经典插入方式与DNA作用时,DNA相邻碱基对的距离会增大、双螺旋结构变长而导致DNA溶液的粘度增加。标题配合物浓度对CT-DNA相对粘度影响如图6所示。
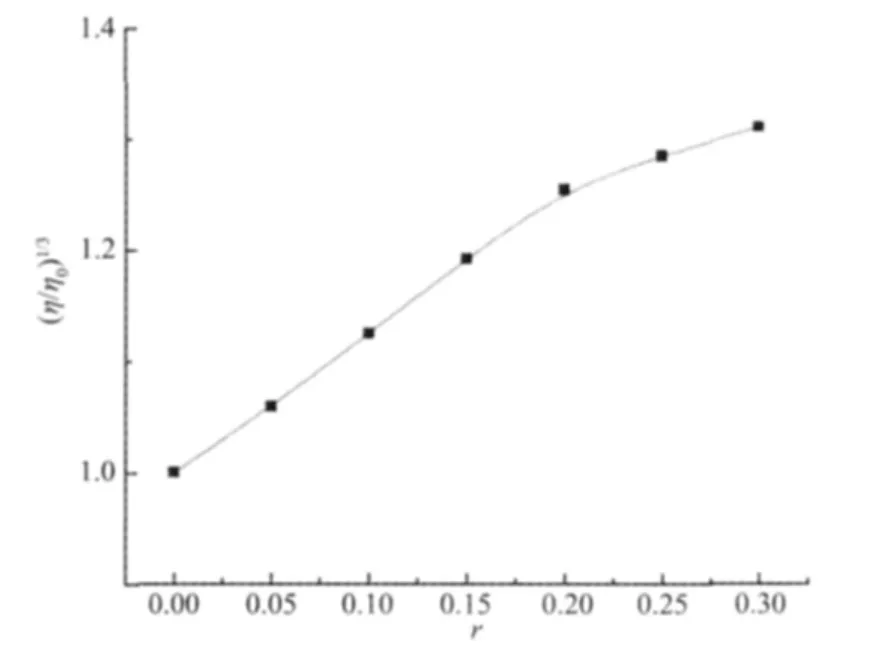
图6 配合物浓度对CT-DNA相对粘度影响Fig.6 Effect of the concentration of the complex on the relative viscosity of CT-DNA
从图6可以看出,随着配合物浓度增加,CTDNA的相对粘度增加,表明配合物可能以插入方式与CT-DNA作用,但粘度增加幅度比经典插入剂EB作用时要小得多[30],表明标题配合物对CT-DNA只有较弱的插入作用,与上述光谱方法测定结果一致。
3 结 论
本文以2-(2′-吡啶基)苯并噁唑、甘氨酸和高氯酸铜(Ⅱ)为原料合成了新的三元配合物:[Cu(PBO)(Gly)(H2O)]ClO4,该配合物具有变形四方锥结构。研究发现,与2-(2′-吡啶基)苯并噁唑和Cu(ClO4)2相比较,该配合物对枯草杆菌、金黄色葡萄球菌、苏云金芽孢杆菌、水稻条斑病细菌、大肠杆菌以及沙门氏杆菌具有良好的抑制作用,并且以插入方式与DNA作用。
[1]Bhattacharya S,Chaudhuri P.Curr.Med.Chem.,2008,15(18):1762-1777
[2]Datt P,Sardar D,Mukhopadhyay A P,et al.J.Organomet.Chem.,2011,696(2):488-495
[3]Sun L Q,Chen J,Takaki K,et al.Bioorg.Med.Chem.Letters,2004,14(5):1197-1200
[4]Kamal A,Reddy K S,Khan M N A,et al.Bioorg.Med.Chem.,2010,18(13):4747-4761
[5]Rida S M,Ashour F A,El-Hawash S A M,et al.European J.Med.Chem.,2005,40(9):949-959
[6]He X F,Vogels C M,Decken A,et al.Polyhedron,2004,23(1):155-160
[7]McKee M L,Kerwin S M.Bioorg.Med.Chem.,2008,16(4):1775-1783
[8]Spillane C B,Dabo M N V,Fletcher N C,et al.J.Inorg.Biochem.,2008,102(4):673-683
[9]Zhang S C,Zhu Y G,Tu C,et al.J.Inorg.Biochem.,2004,98(12):2099-2106
[10]Kumar D,Rudrawar S,Chakraborti A K.Austrlian J.Chem.,2008,61(11):881-887
[11]Cater M T,Rodriguez M,Bard A J.J.Am.Chem.Soc.,1989,111(24):8901-8911
[12]Sheldrick G M.SHELXTL,Version 5.10 Ed,Bruker AXS Inc.,Madsion,Wisconsion,USA,1997.
[13]LU Yan-Mei(卢艳梅),OU Zhi-Bin(区志镔),LIU Hai-Feng(刘海峰),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(4):704-710
[14]Geary W J.Coord.Chem.Rev.,1971,7(1):81-122
[15]Nakamoto K.Infrared and Raman Spectra of Inorganic and Coordination Compounds,4th Ed.New York:John Wiley and Sons Inc.,1986:257
[16]Subramanian P S,Suresh E,Dastidar P,et al.Inorg.Chem.,2001,40(17):4291-4301
[17]Chen J Y,Ren X X,Le X Y,et al.Chin.J.Chem.,2010,28(11):2179-2187
[18]Patra A K,Bhowmick T,Roy S,et al.Inorg.Chem.,2009,48(7):2932-2943
[19]Gu Q,Le X Y,Lin Q B,et al.Chin.J.Chem.,2007,25(6):791-796
[20]Le X Y,Gu Q,Song Z J,et al.J.Coord.Chem.,2007,60(13):1359-1371
[21]ZHOU Jian-Liang(周建良),CHUN Xiao-Gai(春晓改),ZHOU Lin-Jiao(周琳娇),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(4):645-650
[22]Efthimiadou E K,Thomadaki H,Sanakis Y,et al.J.Inorg.Biochem.,2007,101(1):64-73
[23]Ren X X,Chen J Y,Le X Y.Chin.J.Chem.,2011,29(7):1380-1388
[24]Wu J Z,Yuan L,Wu J F.J.Inorg.Biochem.,2005,99(12):2211-2216
[25]Lepecq J B,Paoletti C.J.Mol.Biol.,1967,27(1):87-106
[26]Lakowicz J R.Webber G.Biochemistry,1973,12(21):4161-4170
[27]Liu J,Zhang T X,Lu T B,et al.J.Inorg.Biochem.,2002,91(1):269-276
[28]Satyanarayana S,Dabrowiak J C,Chaires J B,et al.Biochemistry,1992,31(39):9319-9324
[29]HONG Xian-Lan(洪显兰),REN Jian-Min(任健敏).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(4):785-790
[30]REN Xiang-Xiang(任祥祥),WANG Cai-Xia(王彩霞),LU Yan-Mei(卢艳梅),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(5):891-898
Structure,Antibacterial Activities and DNA Interaction of a Copper(Ⅱ)Complex with 2-(2′-Pyridyl)benzoxazole and Glycinate
OU Zhi-Bin1HUANG Shan-Hua1LE Xue-Yi*,1,2
(1Department of Applied Chemistry,South China Agricultural University,Guangzhou 510642,China)(2Institue of Biomaterial,South China Agricultural University,Guangzhou 510642,China)
A new ternary copper(Ⅱ) complex:[Cu(PBO)(Gly)(H2O)]ClO4(PBO=2-(2′-pyridyl)benzoxazole,Gly=glycinate),was synthesized and characterized by elemental analysis,molar conductivity,IR,UV-Vis and single crystal X-ray diffraction.The crystal belongs to orthorhombic,space group Pca21,with the crystal cell parameters:a=1.029 2(2)nm,b=1.032 9(2)nm,c=1.566 8(3)nm,Z=4,V=1.665 6(6)nm3,Dc=1.800 g·cm-3,F(000)=916,R1=0.042 6,wR2=0.101 3.The complex was assayed against gram-positive (S.aureus,B.subtilis,B.thuringiensis)and gram-negative (X.oryzae,Salmonella,E.coil)bacteria by doubling dilutions method,and the interaction of the complex to DNA was investigated by electronic absorption spectroscopy,fluorescence spectroscopy,and viscosity measurement.The results show that the complex has good antibacterial activities and can bind to DNA by intercalative mode.CCDC:852991.
ternary copper(Ⅱ) complex;2-(2′-pyridyl)benzoxazole;glycine;antibacterial activity;DNA
O614.121
A
1001-4861(2012)08-1580-07
2011-11-26。收修改稿日期:2012-05-08。
广东省自然科学基金(No.10151064201000016)及华南农业大学211工程项目(No.2009B010100001)资助项目。*
。 E-mail:lexyfu@163.com;会员登记号:S060000184M。
