小鼠胰腺星状细胞TLR-9的表达及意义
2012-11-07范昕侯雯跻王旭青卢旷逸马小艳张建新
范昕 侯雯跻 王旭青 卢旷逸 马小艳 张建新
·短篇论著·
小鼠胰腺星状细胞TLR-9的表达及意义
范昕 侯雯跻 王旭青 卢旷逸 马小艳 张建新
近年来研究发现,胰腺纤维化及胰腺癌耐药与胰腺星状细胞(PSCs)有关,具体机制尚不清楚[1-3]。有文献报道,肝星状细胞表达TLR-9,并通过TLR-9介导肝纤维化[4]。PSCs与肝星状细胞相似,但其是否表达TLR-9尚不知晓。本研究旨在了解PSCs的TLR-9表达,探讨TLR-9对PSCs功能的影响。
一、材料与方法
1.小鼠PSCs分离培养:清洁级昆明小鼠,体重20 g左右,雌雄不限,由江苏大学动物实验中心提供。参考Bachem等[5]及李波静等[6]大鼠PSCs分离方法,并加以改进。主要操作步骤:取昆明种小鼠,消毒3 min后剖腹,迅速切除胰腺,放入盛有预冷PBS的培养皿中,剔除胰腺被膜及血管组织,将其剪至约1 mm×1 mm×1 mm大小,然后将组织块均匀涂抹在预先包被多聚赖氨酸的培养瓶瓶底,于5% CO2的培养箱静置30 min,待组织块贴壁后用预热的PBS轻轻冲洗一次,加入含有20%胎牛血清(Gibco公司)及胰酶抑制剂的DMEM培养液5 ml,继续常规培养,第一天换液,以后隔天换液,约1周左右PSCs铺满瓶底60%~70%时传代。
2.TLR-9蛋白表达的检测:小鼠胰腺组织TLR-9表达采用免疫组化方法检测,细胞质内出现棕黄色颗粒为阳性。PSCs的TLR-9表达采用蛋白质印迹法检测。兔抗鼠TLR-9抗体及HRP标记的羊抗兔IgG均购自SANTA CRUZ公司,工作浓度1∶200。
3.细胞增殖检测:采用MTT法。将PSCs均匀接种至96孔板,每孔104个细胞,分为对照组、激动剂ODN1826(终浓度2.5 μg/ml,Invivogen公司)组、激动剂ODN1826+拮抗剂ODN2088(终浓度5 μg/ml,Invivogen公司)组,每组设5个复孔。隔天换液,分别培养1、2、3、4、5 d,每孔加入 20 μl 5% MTT(Sigma公司),继续培养4 h,上酶标仪测各孔A490值。
4.一氧化氮(NO)检测:将PSCs均匀接种至6孔板,每孔105个细胞,同上述分为对照组、ODN1826组、ODN1826+ODN2088组,培养72 h。收集上清,采用NO试剂盒(南京建成公司)检测NO水平,按照试剂盒说明书操作。
5.统计学处理:所有数据均采用SPSS13.0进行统计。

二、结果
1.PScs的状态特征:组织块植入后24 h,PSCs从胰腺间质中爬出,呈三角形或星形,同时胞质内可见脂肪滴。随着培养时间的推移,脂滴逐渐消失,传代后,体积变大,突起丰富,呈典型的“稻草把样”(图1)。
2.小鼠胰腺组织及PSCs的TLR-9表达:小鼠胰腺组织及PSCs均表达TLR-9(图2)。
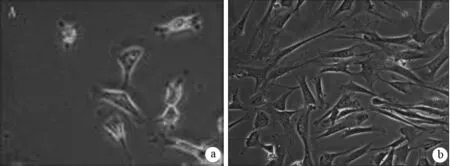
图1 小鼠PSCs培养第3天(a)和传代后2 d(b)的形态(×100)

图2 小鼠PSCs的TLR-9表达(a免疫组化,×400;b蛋白质印迹法)
3.PSCs增殖的变化:对照组小鼠PSCs培养1~5 d的A490值分别为0.133±0.002、0.336±0.01、0.472±0.008、0.610±0.02、0.638±0.02;ODN1826组分别为0.130±0.002、0.268±0.004、0.397±0.01、0.429±0.01、0.497±0.02,自第2天起较同时间点亲本细胞增殖显著降低(F值分别为0.754、7.250、12.494、22.061、12.833,P值分别为0.510、0.025、0.003、0.000、0.002);ODN1826+ODN2088组细胞增殖分别为0.131±0.001、0.318±0.01、0.44±0.006、0.593±0.02、0.613±0.01,与同时间点亲本细胞增殖无显著差异(P值分别为0.476、0.368、0.060、0.590、0.470,图3)。
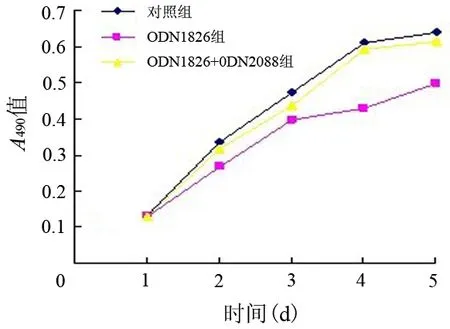
图3 各组小鼠PSCs的生长曲线
4.PSCs的NO合成量变化:对照组、ODN1826组、ODN1826+ODN2088组细胞的NO合成量分别为(30.28±0.21)、(22.87±0.65)、(29.41±0.65)μmol/L,ODN1826组较亲本细胞显著减少(F=148,P=0.000),而ODN1826+ODN2088组与亲本细胞无显著差异(P=0.114)。
讨论正常胰腺组织中PSCs占4%,位于小叶间和腺泡周围,呈静止状态[7]。在胰腺慢性炎症及胰腺恶性肿瘤中PSCs可被激活,活化的PSCs增殖能力及迁移能力较前均明显提高[8]。大量研究表明,胰腺纤维化与PSCs密切相关。通过多种细胞因子与炎性介质如TGF-β1、PDGF等的参与,不同的信号转导通路如磷脂酞肌醇3激酶(IP3)途径和丝裂原激活蛋白激酶(MAPK)途径的转导,从而激活PSCs,并最终形成纤维化[9]。
胰腺癌的病理特征之一是进行性纤维化及肿瘤粘连形成,这与细胞外基质中PSCs的增殖关系密切[10-11]。在体外,胰腺癌细胞与基质细胞共培养可以诱导胰腺癌细胞耐药;PSCs也可以被胰腺肿瘤细胞激活[11-12]。这些都提示PSCs与胰腺癌的发展有协同关系,PSCs支持肿瘤细胞生长、侵袭及耐药,同时肿瘤细胞激活PSCs。两者协同作用,通过正反馈机制导致胰腺癌的高度恶性的生物学特征。
目前认为,胰腺纤维化及胰腺癌耐药的形成是一个以胰腺星状细胞活化为核心的复杂的病理过程[11]。因此对PSCs生物学特性的深入研究意义深远。有研究发现,PSCs细胞表达Toll样受体[13],如TLR-2、TLR-4,但未见胰腺星状细胞表达TLR-9的报道。在本研究中,通过免疫组化及蛋白质印迹法证实了PSCs表达TLR-9。体外实验表明,PSCs分泌的NO可刺激胰腺肿瘤细胞分泌胰腺癌耐药相关因子IL-1β[14]。本研究将分离培养的PSCs分别加入TLR-9的激动剂及拮抗剂,结果显示TLR-9激动剂可明显减弱PSCs的增殖能力,并有效减少NO的合成。加入抑制剂后上述效应被抑制,表明PSCs有TLR-9受体存在,激活PSCs的TLR-9受体,能减少PSCs对NO的分泌并抑制PSCs的增殖。
通过激活PSCs的TLR-9受体改变其生物学特性。这对于研究胰腺纤维化有重要意义。目前,TLR-9减少PSCs对NO
的分泌并抑制PSCs的增殖的机制尚不清楚。我们正在进行相关实验,试图了解其过程中关键的细胞因子或炎症介质以及相关的信号转导通路。
[1] Strimpakos AS, Syrigos KN, Saif MW. Translational research in pancreatic cancer.JOP,2010,11:124:127.
[2] Scarlett CJ, Colvin EK, Pinese M, et al. Recruitment and Activation of Pancreatic Stellate Cells from the Bone Marrow in Pancreatic Cancer: A Model of Tumor-Host Interaction. PLoS One,2011,6:e26088.
[3] Saito R,Yamada S,Yamamoto Y, et al.Conophylline suppresses pancreatic stellate cells and improves islet fibrosis in Goto-Kakizaki rats.Endocrinology,2012,153: 621-630.
[4] Watanabe A, Hashmi A, Gomes DA. Apoptotic hepatocyte DNA inhibits hepatic stellate cell chemotaxis via toll-like receptor 9. Hepatology,2007,46: 1509-1518.
[5] Bachem MG, Schneider E,Gross H,et al. Identification, culture, andcharacterization of pancreatic stellate cells in rats and humans. Gastroenterology,1998,115: 421-432.
[6] 李波静,王兴鹏,吴恺.肥大细胞在大鼠胰腺组织纤维化形成中的作用及其机制.中华消化杂志,2006,26:171-175.
[7] Liotta LA, Kohn EC. The microenvironment of the tumour-host interface. Nature, 2001,411:375-379.
[8] Bachem MG, Zhou S, Buck K,et al. Pancreatic stellate cells-role in pancreas cancer. Langenbecks Arch Surg,2008,393:891-900.
[9] 胥明,王兴鹏.胰腺星状细胞的生物学特性. 胰腺病学,2005,5:54-55.
[10] Mantoni TS, Lunardi S, Al-Assar O, et al.Pancreatic stellate cells radioprotect pancreatic cancer cells through β1-integrin signaling. Cancer Res,2011,71:3453-3458.
[11] Dunér S, Lopatko Lindman J,Ansari D,et al. Pancreatic cancer: the role of pancreatic stellate cells in tumor progression.Pancreatology, 2010,10:673-681.
[12] Fujita H, Ohuchida K, Mizumoto K,et al.Tumor-stromal interactions with direct cell contacts enhance proliferation of human pancreatic carcinoma cells. Cancer Sci,2009,100:2309-2317.
[13] Masamune A,Kikuta K,Watanabe T, et al. Pancreatic stellate cells express Toll-like receptors.J Gastroenterol,2008,43:352-362.
[14] Müerkoster S,Wegehenkel K,Arlt A,et al.Tumor stroma interactions induce chemoresistance in pancreatic ductal carcinomacells involving increased secretion and paracrine effects of nitricoxide and interleukin-1beta.Cancer Res,2004,64:1331-1337.
10.3760/cma.j.issn.1674-1935.2012.05.021
国家自然科学基金(81070287);镇江市2009年度科技计划(科技支撑-社会发展)(SH2009013);江苏大学临床发展基金(JLY2010127)
212001 镇江,江苏大学附属医院普外科(范昕、王旭青、张建新);江苏大学临床医学院(侯雯跻、卢旷逸、马小艳)
张建新,Email:zhangjx1818@163.com
2012-02-07)
(本文编辑:吕芳萍)
