DNA甲基转移酶3b和microRNA-29b在胰腺癌细胞株中的表达及其相关性
2012-11-07王丽华高军杜奕奇吴红玉金晶李淑德李兆申
王丽华 高军 杜奕奇 吴红玉 金晶 李淑德 李兆申
·论著·
DNA甲基转移酶3b和microRNA-29b在胰腺癌细胞株中的表达及其相关性
王丽华 高军 杜奕奇 吴红玉 金晶 李淑德 李兆申
目的明确胰腺癌细胞株甲基转移酶(DNMT)3b和microRNA-29b(miR-29b)的表达,分析两者的相关性。方法应用实时定量PCR法检测人胰腺癌细胞株PANC1、BxPC3、CFPAC、AsPC-1、Capan-2的DNMT3b mRNA和miR-29b表达。采用Pearson直线相关分析法分析两者表达量的相关性。结果PANC1、BxPC3、CFPAC、AsPC-1、Capan-2的DNMT3b mRNA相对表达量分别为0.497±0.184、0.420±0.168、0.439±0.217、0.122±0.111和0.731±0.387;miR-29b的相对表达量分别为0.745±0.596、0.464±0.430、0.797±1.000、1.836±1.623和0.216±0.335,DNMT3b mRNA的表达量和miR-29b的表达量呈负相关关系(r=-0.922,P=0.026)。结论DNMT3b和miR-29b均参与了胰腺癌的发生发展,两者呈负相关关系。
胰腺肿瘤; 细胞系,肿瘤; DNA甲基转移酶3b; 微RNAs
MicroRNA(miRNA)通过与靶基因mRNA上的靶序列互补配对结合,在转录后水平上对基因的表达进行负调控,导致mRNA的降解或翻译抑制[1]。近年的研究发现,miRNAs在多种人类肿瘤中异常表达。虽然其机制尚不清楚,但有研究发现启动子CpG岛异常甲基化在很多肿瘤中与某些miRNAs的下调有关。我们前期的研究发现,DNA甲基转移酶家族(DNMTs),尤其是DNMT1和DNMT3b可能参与胰腺癌的发生与发展;胰腺癌患者血浆中存在miRNAs异常表达,尤其是DNMTs异常表达的胰腺癌患者血浆miRNAs表达下调。本研究检测5株胰腺癌细胞株的DNMT3b和miRNA-29b(miR-29b)表达,并分析两者的相关性,以明确导致胰腺癌DNMT3b异常高表达的内在调控机制。
材料和方法
一、胰腺癌细胞株
人胰腺癌细胞株PANC1、BxPC3、CFPAC、AsPC-1、Capan-2均购自中国科学院细胞所,常规培养、传代,收集对数期生长细胞。
二、实时定量PCR
应用Trizol(Sigma公司)抽提各胰腺癌细胞总RNA,分光光度计检测其纯度和浓度。应用Takara公司的PrimeScript TMRT Reagent Kit逆转录合成DNMT3b的cDNA;采用美国ABI公司的FG,Taqman(r)microRNA RT Kit逆转录合成miR-29b的cDNA;DNMT3b及其内参18S TAQMAN探针、miR-29b及其内参U6 TAQMAN探针均由美国ABI公司设计合成。采用实时定量PCR法同时检测DNMT3b mRNA和miR-29b的表达。扩增反应程序:95℃ 15 s,60℃ 60 s, 40个循环。通过计算得到的RQ值(RQ=2-△△Ct)表示mRNA的相对表达量。
三、统计学处理

结 果
一、扩增曲线
18S、DNMT3b、U6和miR-29b的扩增曲线见图1。

图118S(a)、DNMT3b(b)、U6(c)、miR-29b(d)的RT-PCR扩增曲线
二、胰腺癌细胞DNMT3b mRNA和miR-29b 的表达
PANC1、BxPC3、CFPAC、AsPC-1、Capan-2的DNMT3b mRNA相对表达量分别为0.497±0.184、0.420±0.168、0.439±0.217、0.122±0.111和0.731±0.387;miR-29b的相对表达量分别为0.745±0.596、0.464±0.430、0.797±1.000、1.836±1.623和0.216±0.335(图2)。

图25株胰腺癌细胞株DNMT3b mRNA(左)和miR-29b(右)的表达
三、DNMT3b mRNA和miR-29b表达的相关性
5株胰腺癌细胞株的DNMT3b mRNA表达量和miR-29b的表达量呈负相关关系(r=-0.922,P=0.026,图3)。
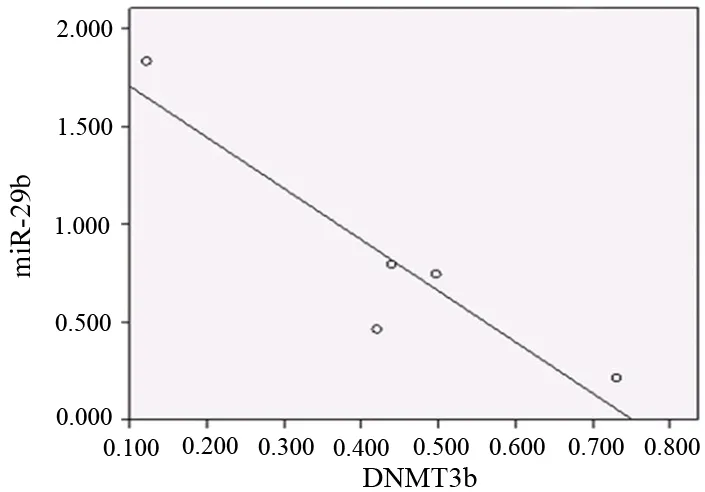
图35株胰腺癌细胞株DNMT3b mRNA和miR-29b表达的相关性
讨 论
甲基化修饰是继基因结构变异即突变和缺失之后的第3种抑癌基因失活机制,其中一种可能的因素是DNMTs高表达和DNMTs复合体调控障碍[2-3]。大多数肿瘤细胞的DNMTs表达明显高于正常细胞,并与抑癌基因启动子高甲基化状态相关[4]。与基因突变引起的癌变不同,由于高度甲基化而导致的抑癌基因转录失活并不改变基因本身的序列,因此从理论上说,恢复基因的正常甲基化状态可以重新激活基因的功能。Luczak等[5]应用反义DNMTs抑制其表达,通过减低DNMTs活性使被高甲基化的凋亡基因恢复活性。
近年的研究发现,miRNA与DNMTs有关。目前已经证实,miR-29家族主要调控DNMT1、3a、3b;miR-148主要调控DNMT-1、3b;miR-143主要调控DNMT-3a;miR-152主要调控DNMT1[6-13]。Fabbri等[7]报道,miR-29家族通过靶向DNMT3a和DNMT3b逆转肺癌细胞的异常甲基化。Garzon等[8]报道,在急性淋巴细胞白血病中,miR-29b通过直接靶向DNMT3a和DNMT3b及间接靶向DNMT1诱导整体的DNA低甲基化,导致肿瘤抑制基因的重新表达。吕塞群等[14]通过实时PCR检测,发现PIC细胞感染病毒48 h后, DNMT3a和DNMT3b表达量显著降低,肝癌细胞miR-29b的表达量与DNMT3a、DNMT3b的表达量呈负相关。本研究结果亦显示,5株胰腺癌细胞株的DNMT3b mRNA的表达量和miR-29b的表达量呈负相关关系。
[1] Lai EC.MicroRNAs are complementary to 3 UTR sequence mo tifs that mediate negative post-transcriptional regulation.Nat Genet, 2002,30: 363-364.
[2] Milutinovic S,Knox JD,Szyf M.DNA methyltransferase in hibition induces the transcription of the tumor suppressor p21 (WAF1/ClPl/sdil). J Biol Chem,2000,275:6353-6359.
[3] Rhee I, Bachman KE,Park BH, et al.DNMT1 and DNMT3b cooperate to silence genes in human cancer cells.Nature, 2002,416:552-556.
[4] Fang JY, Lu R, Mikovits JA,et al.Regulation of hMSH2 and hMLH1 expression in the human colon cancer cell line SW1116 by DNA methyltransferase 1.Cancer Lett,2006,233:124-130.
[5] Luczak MW, Jagodzinski PP. The role of DNA methylation in cancer development. Folia Histoehem Cytobiol, 2006,44:143-145.
[6] Song YX, Yue ZY, Wang ZN, et al. MicroRNA-148b is frequently down-regulated in gastric cancer and acts as a tumor suppressor by inhibiting cell proliferation. Mol Cancer, 2011, 10:1.
[7] Fabbri M, Garzon R, Cimmino A, et al. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B. Proc Natl Acad Sci USA, 2007, 104:15805-15810.
[8] Garzon R, Liu S, Fabbri M, et al. MicroRNA-29b induces global DNA hypomethylation and tumor suppressor gene reexpression in acute myeloid leukemia by targeting directly DNMT3A and 3b and indirectly DNMT1. Blood, 2009,113:6411-6418.
[9] Duursma AM, Kedde M, Schrier M, et al. miR-148 targets human DNMT3b protein coding region. RNA,2008,14:872-877.
[10] Duursma AM, Kedde M, Schrier M, et al. miR-148 targets human DNMT3b protein coding region. RNA, 2008, 14: 872-877.
[11] Takada S, Berezikov E, Choi YL, et al. Potential role of miR-29b in modulation of Dnmt3a and DNMT3b expression in primordial germ cells of female mouse embryos. RNA,2009, 15: 1507-1514.
[12] Ng EK, Tsang WP, Ng SS, et al. MicroRNA-143 targets DNA methyltransferases 3A in colorectal cancer. Br J Cancer, 2009,101:699-706.
[13] Pan W, Zhu S, Yuan M, et al. MicroRNA-21 and microRNA-148a contribute to DNA hypomethylation in lupus CD4+T cells by directly and indirectly targeting DNA methyltransferase 1. J Immunol, 2010,184:6773-6781.
[14] 吕赛群,金华君,钱其军. miR-29b对肝癌细胞中甲基化转移酶表达的调控作用.浙江理工大学学报,2011,23:101-105.
ExpressionofDNMT3bandmicroRNA-29binpancreaticcancercellsandtheirralationship
WANGLi-hua,GAOJun,DUYi-qi,WUHong-yu,JINJing,LIShu-de,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,ChinaCorrespondingauthor:LIZhao-shen,Email:lizhaoshen111@yahoo.com.cn;LIShu-de,Email:lishude57@126.com
ObjectiveTo investigate the expression of DNMT3b mRNA and microRNA-29b (miR-29b) in pancreatic cancer cells and analyze their relationship.MethodsReal-time RT-PCR method was used to detect the expression of DNMT3b mRNA and miR-29b in five pancreatic cancer cell lines (PANC1, BxPC3, CFPAC, AsPC 1, Capan 2) and the relationship between DNMT3b mRNA and miR-29b expression was analyzed by pearson linear correlation method.ResultsThe expression of DNMT3b mRNA in PANC1, BxPC3, CFPAC, AsPC 1, Capan 2 were 0.497±0.184, 0.420±0.168,0.439±0.217,0.122±0.111 and 0.731±0.387, while the expression of miR-29b were 0.745±0.596, 0.797±1.000,0.464±0.430,1.836±1.623 and0.216±0.335. The expression of DNMT3b mRNA was negatively correlated with the expression of miR-29b (r= -0.922,P=0.026).ConclusionsBoth DNMT3b and miRNA29b are involved in the carcinogenesis of pancreatic cancer, and they are negatively correlated.
Pancreatic neoplasms; Cell line, tumor; DNA-methy1transferases3b; MicroRNAs
10.3760/cma.j.issn.1674-1935.2012.05.008
国家自然科学基金重大国际合作项目(3091010-3911)
200433 上海,第二军医大学长海医院消化内科
李兆申,Email:lizhaoshen111@yahoo.com.cn;李淑德,Email:lishude57@126.com
2012-05-16)
(本文编辑:屠振兴)
