柚皮苷在促大鼠骨髓间充质干细胞骨向分化过程中对MAPK信号通路的影响*
2012-11-06张荣华
汪 甜, 杨 丽, 张荣华
(暨南大学药学院中药学教研室,广东 广州 510632)
1000-4718(2012)05-0769-08
2012-02-06
2012-04-19
国家自然科学基金资助项目(No.81173619);暨南大学药学院211工程和重点实验室创新研究项目
△通讯作者 Tel: 020-85220023 ; E-mail: tzrh@jnu.edu.cn
·论著·
柚皮苷在促大鼠骨髓间充质干细胞骨向分化过程中对MAPK信号通路的影响*
汪 甜, 杨 丽, 张荣华△
(暨南大学药学院中药学教研室,广东 广州 510632)
目的研究中药单体柚皮苷(NG)对体外培养的大鼠骨髓间充质干细胞(MSCs)向成骨细胞分化过程中MAPK信号通路的影响。方法观察在正常、加入p38、ERK和JNK通路抑制剂SB203580、PD98059、SP600125及3种抑制剂全部加入的情况下,各组碱性磷酸酶(ALP)、骨钙素(BGP)、I型胶原(Col I)等骨向分化指标的差异。用Western blotting技术检测各组p38、ERK1/2和JNK蛋白的磷酸化水平,用荧光定量PCR技术检测细胞因子转化生长因子β1(TGF-β1)、骨形成蛋白2(BMP-2)和核心结合因子α1(Cbfα1) mRNA的表达。结果(1)10-7mol/L为本实验中NG的最佳促骨向分化浓度。(2) NG最佳浓度组的ALP和BGP含量比其它各组都高(P<0.05),Col I含量无明显差异(P>0.05);与NG组相比,加入不同抑制剂组的ALP、BGP和ColⅠ表达量出现不同程度的降低。(3)与空白组相比,NG组JNK蛋白的磷酸化水平升高(P<0.05),p38蛋白的磷酸化水平降低(P<0.01),ERK1/2蛋白的磷酸化水平无明显差异(P>0.05)。与NG组相比,加入不同抑制剂组的p38、ERK1/2和JNK蛋白的磷酸化水平有升高也有降低。(4) NG组上调BMP-2的表达(P<0.05),下调Cbfα1的表达(P<0.05),而对TGF-β1的表达无明显影响(P>0.05)。与NG组相比,加入不同抑制剂组的TGF-β1、BMP-2和Cbfα1 mRNA表达量出现不同程度的降低。结论NG主要通过激活MAPK信号通路中ERK通路、JNK通路以及上调BMP-2的表达,促进MSCs的骨向分化。NG上调BMP-2的表达受MAPK通路中p38通路的影响较大。
柚皮苷; 骨髓间充质干细胞; 骨向分化; MAPK信号通路
骨髓间充质干细胞(mesenchymal stem cells, MSCs)是在骨髓中发现的一种起源于中胚层、具有自我复制能力和多向分化潜能的非造血干细胞。MSCs向成骨细胞(osteoblast, OB)分化的特性可为骨生长及骨修复提供细胞来源,在骨性疾病的治疗上拥有非常良好的应用前景。MSCs向OB分化是个复杂的过程,涉及多种信号通路的调控,其中与丝裂原活化蛋白激酶 (mitogen-activated protein kinase, MAPK)信号转导途径关系密切。已有研究表明,MAPK通路中的细胞外信号调节激酶(extracellular-signal regulated protein kinase, ERK)、p38 MAPK和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)通路参与了OB分化增殖的信号转导,并在应激、凋亡及骨质代谢、炎症中发挥重要作用[1]。
柚皮苷(naringin, NG)作为中药骨碎补主要成分之一,大量存在于柚、葡萄柚和酸橙及其变种的果皮及果实中。NG具有促进OB增殖和分化、抗过敏、抗炎、抗病毒、抗氧化、降血脂、抑癌等多种药理活性[2]。在促进MSCs骨向分化方面虽然已有文献进行了初步研究[3],但其作用机制尚不清楚。本研究采用中药单体NG对SD大鼠MSCs进行干预,观察在NG促MSCs骨向分化过程中ERK、p38和JNK通路的作用及与骨转化调控因子之间的关系。
材 料 和 方 法
1动物
清洁级(SPF)Sprague-Dawley(SD)大鼠,雌性,3月龄,体重 200 g左右,购自南方医科大学实验动物中心,许可证号:SCXK(粤)2006-0015。
2主要仪器和试剂
倒置相差显微镜(Olympus);CO2培养箱(Revco);酶标仪(Bio-Rad);数码照相机(Canon);扫描电子显微镜(Philips);PCR仪、稳压恒流电泳仪、IQ5 Real Time PCR Detection System(Bio-Rad)。
α-MEM(HyClone);胎牛血清(Gibco);胰蛋白酶、Triton X-100(Amresco);噻唑蓝(MTT)、DMSO、pNPP(Sigma);SB203580(SB,p38通路抑制剂)、PD98059(PD,ERK通路抑制剂)、SP600125(SP,JNK通路抑制剂)购自碧云天生物技术研究所;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;大鼠骨钙素(bone gla protein,BGP)ELISA检测试剂盒、大鼠胶原酶Ⅰ(collagenase Ⅰ, Col I)ELISA检测试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒购自南京建成生物研究所;兔多克隆Ⅰ抗(Cell Signaling),辣根过氧化物酶(horseradish peroxidase, HRP)标记的Ⅱ抗(Cell Signaling),Trizol(Invitrogen);氯仿、异丙醇(广州化学试剂厂);Taq酶、反转录酶购自大连宝生物工程有限公司;引物由上海生工合成;柚皮苷购自中国药品生物制品检定所;其余试剂均为国产分析纯。
制备NG母液并设置不同浓度梯度[4-7]。取10 mg NG溶于85 μL DMSO溶液中配制成0.2 mol/L母液。用α-MEM完全培养基稀释母液,分别得到浓度为1×10-3mol/L、1×10-4mol/L、1×10-5mol/L、1×10-6mol/L、1×10-7mol/L、1×10-8mol/L和1×10-9mol/L的NG溶液。
3方法
3.1原代MSCs的分离提取与鉴定 全骨髓贴壁法提取大鼠MSCs。3月龄SD雌性大鼠,颈椎脱臼法处死,置75%乙醇中浸泡10 min。无菌条件下迅速分离出双侧股骨,剔净股骨上附着的脂肪结缔组织和骨膜,迅速移入超净台。将分离好的股骨放入75%乙醇中浸泡30 s,随后用D-Hanks缓冲盐溶液冲洗4~5次, 放入无菌培养皿内,剪去股骨两头的干骺端。用5 mL注射器吸取含10%FBS的完全培养基反复冲洗骨髓腔数次,收集冲出液,用吸管充分吹打均匀,得到细胞悬液。用1 mL注射器将细胞悬液按 1×109cells/L 的密度接种到25 cm2塑料培养瓶中, 置37 ℃、5%CO2、饱和湿度的培养箱中培养。24 h半量换液1次,以后每3 d全量换液1次。待贴壁细胞达到80%~90%融合后,传代培养。杂细胞随换液而被逐渐弃除,据差速贴壁原理,MSCs不断纯化。倒置显微镜下观察细胞形态特征,用流式细胞仪检测细胞表面标志抗原CD29、CD34和CD45,并用扫描电子显微镜和透射电子显微镜观察细胞超微结构。
3.2细胞增殖活性测定 取生长状态良好的P3代MSCs,0.25%胰酶消化后,制成单细胞悬液,以2×106cells/L密度接种于96孔板中,每孔中的体积分别为100 μL。24 h待所有细胞贴壁后,吸出每孔培养液,换成无血清培养基,24 h细胞周期同步化后开始添加不同浓度柚皮苷。吸净每孔培养液,取配制好的不同浓度的柚皮苷工作液,按设置的浓度加入不同组别,使各组的终浓度分别为1×10-3mol/L、1×10-4mol/L、1×10-5mol/L、1×10-6mol/L、1×10-7mol/L、1×10-8mol/L、1×10-9mol/L,空白组中仅加入完全培养基,不加NG溶液作为对照。每个浓度设6个复孔,每孔终体积200μL。各组添加不同浓度柚皮苷后培养3 d,进行MTT检测。弃去培养液,D-Hanks液冲洗3次,更换无血清的α-MEM培养基180 μL/well,同时加入5 g/L MTT 20 μL/well,置37 ℃、5%CO2培养箱中孵育4 h后,小心弃去上清液,加入DMSO 150 μL/well,置微孔板振荡器上振荡10 min。在酶标仪上测吸光度(A)值,测量波长为490 nm,以未接种细胞的空白对照孔作为调零孔。
3.3以ALP活性确定NG最佳促骨向分化浓度 采用pNPP法检测不同浓度NG对MSCs分化中ALP活性的影响。取P3代细胞,以5×107cells/L密度接种到6孔板中,每孔3 mL。用含10%FBS的α-MEM培养基培养6 d,更换无血清培养基培养24 h。24 h细胞周期同步化后,更换为含有不同浓度NG的完全培养基。培养72 h后,吸弃孔中的培养基,用D-Hanks洗2遍。每孔加入细胞裂解液(0.1%Triton X-100)1 mL,4 ℃作用20 min。收集裂解液采用对硝基酚磷酸盐法测定ALP浓度。以pNPP为底物,根据水解磷酯键所产生的对硝基酚量测定酶活力。在37 ℃、pH 10.0条件下,每分钟转化产生1 μmol/L对硝基酚的酶量为1个酶单位。用BCA法测定裂解液中总蛋白浓度,以蛋白含量(μg) 为横坐标,吸光值为纵坐标,绘出标准曲线。根据标准曲线,算出样品实际浓度(g/L)。ALP活性以103U/g protein表示。
3.4实验分组及各项指标检测 确定NG最佳促MSCs骨向分化浓度后,以该浓度NG和通路抑制剂对MSCs进行干预[8-10]。实验分为6组:(1)空白对照组(control);(2)NG组;(3)NG+SB203580(NG+SB)组;(4)NG+PD98059(NG+PD)组;(5)NG+SP600125(NG+SP)组;(6)NG+3种抑制剂(NG+SB+PD+SP)。实验取P3代均质性良好的MSCs以1×108cells/L的密度接种于24孔板,共6组,每组6个复孔。待细胞接种24 h后,换入无血清培养基,24 h细胞周期同步化后,再加入药物及完全培养基,每孔终体积1 mL。培养板置于37℃、5% CO2培养箱中继续培养:(1)空白对照组每3 d正常换液1次;(2)NG组加入最佳浓度的NG及完全培养基;(3)~(6)组在每次换液前,分别加入3 μmol/L SB203580、4 μmol/L PD98059和5 μmol/L SP600125预处理30 min,然后加入最佳浓度的NG及完全培养基继续培养,加药后培养3 d与其它各组同时取细胞上清液和细胞进行指标检测。
3.4.1ALP活性测定 吸尽各孔培养液,用PBS洗3次,每孔加200 μL 0.1% Triton X-100,4 ℃冰上裂解,收集细胞裂解液,取30 μL加于测定管内,按照ALP试剂盒说明操作,标准管加入30 μL酚标准应用液(0.02 g/L),空白管加入双蒸水30 μL,各管均加入缓冲液50 μL和基质液50 μL,充分混匀,37℃水浴15 min,加入显色剂150 μL,立即混匀,选择520 nm波长,酶标仪测定各管吸光度。根据说明书上相应公式计算ALP活性,用金氏单位(King’s unit,每克组织蛋白在37 ℃与基质作用15 min 产生1 mg 酚为1个金氏单位)表示。
3.4.2BGP分泌测定 吸弃孔中的培养液,用PBS洗2遍,每孔加入细胞裂解液200 μL,冰上裂解20 min,收集裂解液-20 ℃保存待测。标准曲线制备及样品测定按说明书操作,于酶标仪上450 nm波长处测定A值,并通过标准曲线计算样品中BGP含量,用μg/g protein表示。
3.4.3ColⅠ含量测定 分别取各组的细胞培养上清液,标准曲线制备及样品测定按说明书操作,于酶标仪上490 nm波长处测定A值,并通过标准曲线计算样品中ColⅠ含量,结果用mg/g protein表示。
3.4.4Western blotting检测磷酸化ERK1/2、磷酸化JNK和磷酸化p38的表达 吸弃培养基,用PBS洗2遍,再加入细胞裂解液4 ℃裂解30 min, 12 000 r/min离心10 min取上清液,用BCA法测蛋白浓度。配制12%分离胶和5%积层胶进行SDS-PAGE电泳,每孔上样量50 μg。以GAPDH作为内参照。电泳结束后转膜,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭,分别加入兔抗p38抗体、ERK抗体、JNK抗体、GAPDH抗体、p-p38抗体、p-ERK抗体和p-JNK抗体于4 ℃孵育过夜。洗膜,加入HRP标记的相应的羊抗兔IgG 抗体于室温孵育1 h。洗膜,ECL显影曝光,得到胶片,比较各条带的灰度值,分析所检测蛋白的磷酸化水平。
3.4.5荧光定量PCR技术检测TGF-β1、BMP-2和Cbfα1 mRNA的表达 总RNA的提取采用Trizol法进行,紫外分光光度计检测浓度,并用1%甲醛变性琼脂糖电泳检测其完整性。将其逆转录为cDNA。以18S rRNA为内参照,引物如下:
(1)TGF-β1上游引物5’-TGCTTCAGCTCCACAGAGAA-3’,下游引物5’-TGGTTGTAGAG-GGCAAGGAC -3’,扩增片段大小为182 bp;(2)BMP-2上游引物5’-GTGAGGATTAGCAGGTCTTTG-3’,下游引物5’-CACCCCACATCACTGAAGTC-3’, 扩增片段大小为200 bp;(3)Cbfα1上游引物5’-GATGCCTTAGTGCCCAAATGT-3’,下游引物5’-GGCTGAAGGGTGAAGAAAGC-3’,扩增片段大小为130bp;(4)18SrRNA上游引物5’-CCTGGATACCGCAGCTAGGA-3’,下游引物5’-GCGGCGCAATACGAATGCCCC- 3’, 扩增片段大小为112 bp。逆转录体系、PCR扩增体系及反应条件均参照说明书设定。反应结束后立即进行扩增曲线和熔解曲线分析。mRNA的相对表达量以相对样品初始模板量表示。由公式2-ΔΔCt计算,相对样品初始模板量=2-ΔΔCt的平均值±标准差。
4统计学处理

结 果
1MSCs的形态及鉴定
倒置显微镜下观察刚分离出的细胞呈圆形,胞体透亮,折光性强,大小不一,与一同从骨髓腔中冲出的杂细胞相互混杂。24 h首次换液后,可见大量细胞贴壁,见图1A。第3 d换液时可见细胞伸展,伸出伪足,呈短棒状,见图1B。随时间延长,贴壁细胞数量增多,体积增大,呈短梭形,形态渐趋均一,见图1C~D;悬浮的杂细胞随换液而被逐渐弃除。细胞呈梭形,迅速增殖,并逐渐融合成片,呈漩涡状分布,见图1E~F。流式细胞术检测大鼠 MSCs 表面标志抗原CD29 阳性细胞比率为99.5%,CD34 及CD45表达阳性细胞比率分别为3.3%和0.1%,见图2。上述结果符合MSCs的生物学特性。

Figure 1. Morphology of MSCs observed by inverted microscopy. A~D:MSCs morphology after 24 h(P1), 3 d,6 d and 9 d(P2); E~F:P3 MSCs morphology.
图1倒置显微镜观察MSCs的形态

Figure 2. Phenotypes of rat MSCs observed by FCM.
图2大鼠MSCs细胞表型鉴定
扫描电镜下观察P3代MSCs为长梭形或多角形,较为粗大,见图3A。细胞之间孔隙较多,大小不一,孔隙间多有交通,细长的丝突相互搭接在一起,形成类似网状的结构。细胞周围有薄纱样基质成分存在,见图3B~D。细胞表面粗糙,有较多突起和细长的微棘、丝突,并且有许多颗粒物质存在,说明该类细胞在培养时有较好的活力,贴壁良好。

Figure 3. Morphology of MSCs observed by scanning electron microscopy.
图3扫描电子显微镜观察MSCs的形态
透射电镜下观察P3代MSCs细胞表面有粗细不均的胞质突起,细胞核大,且呈不规则形,含1~3个核仁,核质较小,核膜光滑清晰、有凹陷,核内有丰富的常染色质,细密、分布均匀,异染色质趋边分布,见图4。胞浆中有丰富的细胞器,如核糖体、粗面内质网、线粒体等,并可见大量的分泌小泡,说明细胞分泌功能旺盛;胞浆内有较多的粗面内质网,线粒体丰富,高尔基复合体发达,说明细胞合成代谢能力旺盛;细胞表面有较多短而粗的微绒毛突起,胞内有较多的初级溶酶体,表明细胞吞噬能力旺盛。

Figure 4. Morphology of MSCs observed by transmission electron microscopy.A,B:bar=2 μm;C,Dbar=5 μm.
图4透射电子显微镜观察MSCs的形态
2NG最佳促骨向分化浓度确定
采用MTT法观察NG对MSCs增殖活性的影响,结果显示,与对照组相比,NG浓度在10-9mol/L~10-4mol/L范围内均能促进MSCs的增殖,且随NG浓度增加,促增殖作用先增强后减弱,当NG浓度为10-6mol/L时促增殖作用最强,见图5。


图5不同浓度NG对MSCs增殖活性的影响
采用pNPP法观察NG对MSCs细胞ALP活性的影响,结果显示,与对照组相比,NG能增强ALP活性,且随NG浓度增加,ALP活性先增强后减弱,当NG浓度为10-7mol/L时ALP活性最强,见图6。结合MTT实验可知,10-7mol/L在上述促增殖浓度范围内,其促增殖能力也较强。综合MTT和pNPP实验,我们选择10-7mol/L为后续实验NG的浓度。


图6不同浓度NG对MSCs细胞ALP活性的影响
3各组细胞骨向分化指标ALP、BGP和ColⅠ的表达
如表1所示,与空白组相比,NG组细胞ALP活性显著增强(P<0.05),BGP分泌显著升高(P<0.01),ColⅠ分泌量无明显差异(P>0.05)。与NG组相比:NG+SB组ALP活性无明显差异(P>0.05),BGP分泌量降低(P<0.05),ColⅠ分泌无明显差异(P>0.05);NG+PD组ALP活性显著降低(P<0.05),BGP分泌量无明显差异(P>0.05),ColⅠ分泌量降低(P<0.05);NG+SP组ALP活性显著降低(P<0.05),BGP分泌显著降低(P<0.05),ColⅠ分泌量无明显差异(P>0.05);NG+SB+PD+SP组细胞ALP活性显著降低(P<0.05),BGP含量无明显差异(P>0.05),ColⅠ含量降低(P<0.05)。
表1各组ALP、BGP和ColⅠ的表达水平
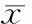

GroupALP(King’sunit)BGP(μg/gprotein)ColⅠ(mg/gprotein)Control0.465±0.0160.508±0.2090.024±0.001NG0.524±0.027*1.972±0.249**0.025±0.002NG+SB0.504±0.021*1.088±0.456*△0.023±0.003NG+PD0.469±0.030△1.171±0.705*0.018±0.002*△NG+SP0.473±0.029△0.398±0.219△0.022±0.003*NG+SB+PD+SP0.413±0.016*△0.260±0.266*0.019±0.005*△
*P<0.05 ,**P<0.01vscontrol;△P<0.05vsNG group .
4各组p38、ERK1/2和JNK蛋白磷酸化的水平
如图7所示,NG组与空白组相比p38的磷酸化减少(P<0.01),JNK磷酸化增加(P<0.05),ERK1/2磷酸化无明显差异(P>0.05)。与NG组相比,NG+SB组p38磷酸化增加(P<0.05),表现出向空白组变化的趋势,同时伴随了JNK磷酸化的减少(P<0.05),ERK1/2磷酸化无明显差异(P>0.05);NG+PD组p38磷酸化增加(P<0.05),ERK1/2的磷酸化明显减少(P<0.05),JNK磷酸化无明显差异(P>0.05);NG+SP组ERK1磷酸化增加(P<0.05),JNK磷酸化减少(P<0.05),p38和ERK2的磷酸化无明显差异(P>0.05);NG+SB+PD+SP组ERK1的磷酸化增加(P<0.05),JNK磷酸化减少(P<0.05),p38和ERK2的磷酸化无明显差异(P>0.05)。
5各组TGF-β1、BMP-2和Cbfα1mRNA的表达
结果如表2所示,与空白组相比,NG组TGF-β1表达量无明显差异(P>0.05),BMP-2表达量增加(P<0.01),Cbfα1表达量减少(P<0.05)。与NG组比较,NG+SB组TGF-β1mRNA表达量减少(P<0.05),BMP-2表达量减少(P<0.05),Cbfα1表达量无明显差异(P>0.05);NG+PD组TGF-β1mRNA表达量无明显差异(P>0.05),BMP-2表达量无明显差异(P>0.05),Cbfα1表达量减少(P<0.05);NG+SP组TGF-β1mRNA表达量减少(P<0.05),BMP-2表达量无明显差异(P>0.05),Cbfα1表达量无明显差异(P>0.05);NG+SB+PD+SP组TGF-β1表达量无明显差异(P>0.05),BMP-2表达量明显减少(P<0.05),Cbfα1表达量无明显差异(P>0.05)。


图7各组磷酸化p38、ERK和JNK的表达
表2各组TGF-β1、BMP-2和Cbfα1mRNA的表达水平
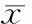

GroupTGF-β1BMP-2Cbfα1Control1.47±0.061.00±0.051.91±0.17NG1.42±0.272.08±0.34**1.33±0.05*NG+SB1.00±0.17*△1.17±0.05△1.34±0.30NG+PD1.12±0.09*1.41±0.28*1.10±0.09*△NG+SP1.07±0.15*△1.35±0.45*2.45±0.49NG+SB+PD+SP1.12±0.28*1.05±0.03△1.30±0.29*
*P<0.05,**P<0.01vscontrol;△P<0.05vsNG group.
讨 论
MSCs的多向分化潜能在骨的形成和吸收方面具有重要的生理意义,尤其是分化为OB的这一重要特性,使之在骨组织工程研究中作为理想的种子细胞而受到重视。其来源广泛、取材简便、体外培养要求条件不高、细胞增殖快、生长稳定、经多次传代成骨能力不减弱,而且作为未分化的干细胞,其细胞表型尚不成熟、自体或同种异体移植后排斥反应轻等,因此在骨性疾病的治疗上拥有良好的应用前景。MSCs向OB分化受到多方面因素的影响,如激素、细胞因子等,且受多种信号通路调控,其中与MAPK信号转导通路关系密切。MAPK家族包含五大类成员,分别为ERK1/2、JNK/应激激活蛋白激酶(SAPK)、p38 MAPK、ERK5/big MAP kinase 1(BMK1)和ERK3/4 等。MAPK通路作为细胞外信号引起细胞核内反应的通道之一,可参与细胞的形成、运动、凋亡、分化及生长增殖等多种生理过程,在MSCs骨向分化过程中发挥着重要作用[11]。
本文选择MAPK通路中的p38、ERK及JNK 3条通路作为研究对象,以ALP、BGP以及ColⅠ为指标观察其对MSCs骨向分化能力的影响,并初步探究了其与骨转化调控因子TGF-β1、BMP-2和Cbfα1之间的关系。ALP是成骨细胞分化早期和中期的一个标志性蛋白[12];此外,ALP作为一种细胞内酶,活性越高说明前成骨细胞向成熟OB分化越明显,因此其可作为OB功能状态的一个重要指标来衡量MSCs向OB方向分化的程度[13]。BGP是成骨细胞分化晚期的一个标志性蛋白,它是一个成骨细胞特异性蛋白。ColⅠ是成骨细胞正常分化及钙化所必需的蛋白。TGF-β1、BMP-2和Cbfα1是与MSCs骨向分化密切相关的细胞因子,在分化过程中起重要作用。TGF-β1是TGF-β超家族的一员,其与骨代谢的关系最为密切,具有重要的诱导成骨分化、成熟的能力[14-15]。BMPs也属于TGF-β超家族,是目前公认的高效骨诱导因子,它具有诱导OB分化和体外成骨的能力,而且能启动MSCs的成骨过程,其中以BMP-2的成骨能力最强,它被认为是活性最强的唯一能单独诱导成骨的因子[16]。Cbfα1属于Runt结构域基因家族,近年来的研究已证明其是OB分化和骨形成的关键调控因子[17]。
本文的研究表明NG能提高MSCs细胞的ALP活性,增加BGP分泌量,证明其具有显著的促进MSCs骨向分化的作用,其最佳促骨向分化浓度为10-7mol/L 。已有文献报道,在NG促MSCs骨向分化过程中,MAPK通路中的p38、ERK和JNK这3条分通路起着至关重要的作用。MAPK信号通路中这3条通路激活的时间顺序是不一样的[18-21],所起的作用强弱也不一样。本文通过对ALP、BGP和ColⅠ指标的观察发现,阻断p38或ERK或JNK任一通路都会减弱NG促MSCs骨向分化的能力,表明这3条通路都在NG促MSCs骨向分化过程中发挥重要作用。其中ERK和JNK通路对MSCs骨向分化能力的影响较显著,表明NG可能主要通过ERK以及JNK这2条MAPK通路促进MSCs骨向分化。Western blotting 实验中NG组与对照组相比下调了p38磷酸化水平,上调了JNK的磷酸化水平;而将p38抑制剂组与NG组比较, p38磷酸化增加,ERK1和JNK磷酸化降低,表现出向对照组变化的趋势,ERK2没有明显变化。这一结果表明加入p38通路抑制剂SB203580后,抑制了NG对p38、ERK1和JNK磷酸化水平调节的能力;同时还表明p38通路不仅与p38的磷酸化有关,还影响ERK1和JNK磷酸化,这也从一个方面表明MARK通路中的p38、ERK和JNK是一个相互联系的有机整体。与NG组相比,ERK抑制剂组ERK磷酸化水平降低,JNK抑制剂组JNK磷酸化水平降低,表明ERK、JNK通路抑制剂的加入,都减弱了NG的调节作用,结果进一步表明NG主要是通过激活ERK、JNK通路从而促进MSCs骨向分化。3种抑制剂都加入,反而对NG调节3种蛋白磷酸化水平的作用无显著影响,表明在NG促MSCs骨向分化过程中除p38、ERK、JNK通路以外,还受MAPK信号通路中其它通路的影响。这也表明MAPK信号通路是一个很复杂的网络系统。作为一个复杂的网络系统,各个MAPK通路之间通过复杂的机制既可相互区别,又可相互调节,既有自身的独立性,相互之间又有着千丝万缕的联系。其中p38、ERK、JNK这3条MAPK通路,或是在上游蛋白激酶,或是在下游作用底物处有其通路的交汇。正是这种复杂的多联系的网络系统,确保了细胞反应的精确性和准确性。通过荧光定量PCR检测各组骨向分化调控因子TGF-β1、BMP-2和Cbfα1 mRNA的表达发现,这3个指标尤其是BMP-2的表达与MAPK通路的p38通路密切相关;同时实验结果表明NG可能主要是通过上调BMP-2的表达来促进骨向分化。
综上所述,本文的研究表明:NG具有显著促进MSCs骨向分化的能力;NG主要是通过激活MAPK信号通路中ERK通路、JNK通路,以及上调BMP-2的表达,来促进MSCs骨向分化的;NG上调BMP-2的表达受MAPK通路中p38通路的影响较大。
[1] 曾芬芳, 黄 河. 间充质干细胞向成骨细胞分化的信号通路[J]. 细胞生物学杂志, 2007, 29(3): 336-340.
[2] 于宏伟, 谷维娜, 李 娜,等. 柚皮苷的提取方法及其应用研究进展[J]. 湖北农业科学, 2011, 50(8): 1516-1518.
[3] 邓展生, 张 璇, 邹冬青, 等. 骨碎补有效成分柚皮甙对人骨髓间充质干细胞的影响[J]. 湘南学院学报: 自然科学版, 2005, 7 (4): 5-7.
[4] 刘新迎, 周 联, 梁瑞燕, 等. 柚皮苷对前脂肪细胞3T3-L1增殖和诱导分化的影响[J]. 中药新药与临床药理, 2007, 18(3): 176-179.
[5] 武密山, 赵素芝,任立中,等. 柚皮苷对乳鼠成骨细胞增殖及c-fos、c-jun表达的影响[J]. 中国药理学通报, 2011, 27(5): 667-681.
[6] 欧阳菁. 柚皮苷对大鼠骨髓间充质干细胞增殖和骨向分化的影响[D]. 广州: 暨南大学,2006.
[7] 周 荣, 姚 巍, 李彦红, 等. 环磷酸腺苷葡甲胺诱导骨髓间充质干细胞向心肌细胞分化的实验研究[J]. 中国病理生理杂志, 2011, 27(10): 2040-2044.
[8] Gong J,Shen X,Qiu H, et al. Down-regulation of HIV-1 Infection by Inhibition of The MAPK Signaling Pathway[J]. Virol Sin, 2011, 26(2):114-122.
[9] 廖清船, 肖洲生, 秦艳芳, 等. 植物雌激素金雀异黄酮通过p38MAPK通路促进骨髓间充质干细胞向成骨细胞分化[J]. 中国药理学通报, 2006, 22(6): 683-687.
[10]王和鸣, 王 力, 李 楠.巴戟天对骨髓基质细胞向成骨细胞分化影响的实验研究[J].福建中医学院学报, 2004, 14(3):16-20.
[11]Yamaguchi A, Komori T, Suda T.Regulation of osteoblast differentiation mediated by bone morphogenetic proteins, hedgehogs, and Cbfa1[J].Endocr Rev, 2000, 21(4): 393-411.
[12]Sierra RI, Specker BL, Jimenez F, et al. Biochmical bone markers, bone mineral content, and bone mineral density in rats with experimental nephritic syndrome[J]. Ren Fail, 1997, 19(3): 409-24.
[13]廖二元, 谭利华. 代谢性骨病学[M]. 第1版. 北京:人民卫生出版社, 2003:1-78.
[14]石义刚, 陶天遵, 徐 强, 等. TGF-β对成骨细胞增殖、分化及OPG 基因mRNA表达的影响[J]. 中国骨肿瘤骨病, 2003, 2(3): 170-172,192.
[15]王小娜, 李 正, 王 瑒, 等. TGF-β1在雷奈酸锶促进大鼠骨髓间充质干细胞向成骨细胞分化中的作用[J]. 中国病理生理杂志, 2011, 27(12): 2357-2361.
[16]Okubo Y, Bessho K, Fujimura K, et al. Osteoinduction by recombinant human bone morphogenetic protien-2 at intramuscular, intemuscular, subcutaneous and intrafatty sites[J]. Int J Oral Maxillofac Surg, 2000, 29(1): 62-66.
[17]Zhang X,Aubin JE,Inman RD. Molecular and cellular biology of new bone formation: insights into the ankylosis of ankylosing spondylitis[J]. Curr Opin Rheumatol, 2003, 15(4): 387-393.
[18]谢兴文, 徐世红, 李 宁. 中药单味或单体诱导骨髓间充质干细胞向成骨细胞分化研究概况[J].中国中医骨伤科杂志, 2010, 18(10):65-67.
[19]Yuan Y, Wu ZJ, Yao HY, et al. Activation of p38 mitogen-activated protein kinase contribute to BMP4-induced alkaline phosphatase expression in MC3T3-E1 preosteoblast[J]. Chin Med J(Engl), 2006, 119(4): 324-327.
[20]Jaiswal RK, Jaiswal N, Bruder SP, et al. Adult human mesenchymal stem cell differentiation to the osteogenic or adipogenic lineage is regulated by mitogen-activated protein kinase [J]. J Biol Chem, 2000,275(73):9645-9652.
[21]Suzuki A, Guicheux J, Palmer G, et al. Evidence for a role of p38 MAP kinase in expression of alkaline phosphatase during osteoblastic cell differentiation [J]. Bone, 2002,30(1):91-98.
EffectsofnaringinonMAPKsignalpathwayinratbonemarrowmesenchymalstemcellsduringosteogenicdifferentiation
WANG Tian, YANG Li, ZHANG Rong-hua
(DepartmentofChineseMateriaMedica,PharmacyCollege,JinanUniversity,Guangzhou510632,China.E-mail:tzrh@jnu.edu.cn)
AIM: To study the effects of Chinese herbal monomer naringin (NG) on the MAPK signal pathway in bone marrow mesenchymal stem cells (MSCs) derived from SD rats during the differentiation into osteoblastsinvitro.METHODSThe changes of evaluating indicators alkaline phosphatase (ALP), bone gla protein (BGP) and type I collagen (Col I) in MSCs were observed under the conditions of normal, adding p38 pathway inhibitor SB203580, adding extracellular signal-regulated kinase (ERK) pathway inhibitor PD98059, adding c-Jun N-terminal kinase (JNK) pathway inhibitor SP600125, and adding SB203580, PD98059 and SP600125 together. The protein phosphorylation of p38, ERK1/2 and JNK was measured by Western blotting. The mRNA expression levels of transforming growth factor beta 1 (TGF-β1), bone morphogenetic protein 2 (BMP-2) and core binding factor α1 (Cbfα1) were measured by fluorescence quantitative PCR.RESULTSThe most effective concentration of NG to promote the differentiation of MSCs into osteoblasts was 10-7mol/L. The highest expression levels of both ALP and BGP were observed in NG group (P<0.05), while the expression of Col I did not reveal significant difference (P>0.05). Compared with NG group, the expression levels of ALP, BGP and Col I decreased differently after adding different inhibitors. Compared with control group, the protein phosphorylation of JNK was increased (P<0.05), and the phosphorylation of p38 was decreased (P<0.05), while the phosphorylation of ERK1/2 did not reveal significant difference (P>0.05) in NG group. Compared with NG group, the protein phosphorylation of p38, ERK1/2 and JNK showed fluctuation with some increasing and others decreasing. Compared with control group, the expression of BMP-2 was increased (P<0.05), and the expression of Cbfα1 was decreased(P<0.05), while the expression of TGF-β1did not reveal significant difference (P>0.05) in NG group. Compared with NG group, the mRNA expression levels of TGF-β1, BMP-2 and Cbfα1 decreased differently after adding different inhibitors.CONCLUSIONActivation of ERK/JNK signaling and up-regulation of BMP-2 expression may be the main mechanism of NG to promote the differentiation of MSCs into osteoblasts. NG has strong impact on p38 pathway to improve the expression of BMP-2 in MSCs.
Naringin; Bone marrow mesenchymal stem cells; Osteogenic differentiation; MAPK signal pathway
R363
A
10.3969/j.issn.1000-4718.2012.05.001
