右旋美托咪啶镇静治疗对严重创伤后炎症因子的影响*
2012-11-06钟志越何岱昆闵思庆
钟志越, 何岱昆, 张 琳, 闵思庆, 申 捷
(复旦大学附属金山医院化学伤害救治中心ICU,上海201508)
1000-4718(2012)11-1979-04
2012-07-02
2012-09-13
上海市金山区科委课题资助(No.2010-3-04)
△通讯作者Tel: 021-34189990-5430;E-mail: j1999sh@yahoo.com.cn
右旋美托咪啶镇静治疗对严重创伤后炎症因子的影响*
钟志越, 何岱昆, 张 琳, 闵思庆, 申 捷△
(复旦大学附属金山医院化学伤害救治中心ICU,上海201508)
目的探讨右旋美托咪啶(DEX)在严重创伤患者短期镇静治疗中对严重创伤后炎症因子的影响。方法随机将60例入住重症监护病房(ICU)的严重创伤患者分为3组:DEX镇静组(DEX组,n=20)、咪达唑仑(MDZ)镇静组(MDZ组,n=20)和不用镇静剂的对照组(n=20)。DEX组:先静脉注射DEX负荷量1~2 μg/kg (>10 min),继以微量注射泵持续静脉泵注维持量0.2~0.7 μg·kg-1·h-1。MDZ组:先静脉注射MDZ负荷量0.03~0.3 mg/kg,继以微量注射泵持续静脉泵注维持量0.03~0.2 mg·kg-1·h-1。镇静2组均以Ramsay氏镇静评分分级Ⅱ~Ⅳ级为镇静目标,根据Ramsay评分调整用量,实施2 d的短程镇静治疗。分别检测患者在入院时、24 h和48 h血清中白细胞介素1(IL-1)、IL-6、肿瘤坏死因子α(TNF-α)和C反应蛋白(CRP)水平。结果3组患者TNF-α、IL-1、IL-6和CRP水平在入住ICU时均明显高于正常值,3组差异无统计学意义(P>0.05);对照组TNF-α、IL-1、IL-6和CRP在24 h和48 h逐步升高,而DEX组和MDZ组的上述指标有所下降,分别与对照组比较差异有统计学意义(P<0.05);DEX组和MDZ组TNF-α、IL-1、IL-6和CRP水平在24 h无显著差异(P>0.05),但在48 h差异显著(P<0.05)。结论右旋美托咪啶可在一定程度上降低创伤后过度应激反应,阻止炎症介质的进一步产生和释放,有助于严重创伤患者的稳定和恢复。
右旋美托咪啶; 咪唑安定; 镇静; 创伤; 炎症介质
严重创伤诱导机体发生严重持续的应激不良反应,使得机体内的炎症介质如白细胞介素(interleukin,IL)、肿瘤坏死因子 α(tumor necrosis factor α,TNF -α)等大量释放,使炎症反应增强,由此形成级联放大效应,从而加重创伤应激功能紊乱和全身损害[1]。及时有效的镇痛镇静治疗能消除患者疼痛, 减轻患者焦虑和躁动,改善病人的依从性和耐受性,同时可能有益减轻或改善患者的炎症反应。本研究通过检测血清TNF-α、IL-1、IL-6和C反应蛋白(C-reactive protein,CRP)水平,探讨右旋美托咪啶(dexmedetomidine,DEX)镇静治疗对严重创伤后应激反应中炎症介质的影响。
材 料 和 方 法
1一般资料
选择2010年7月~2011年12月入住我院重症监护病房(intensive care unit,ICU)的严重创伤患者60例。入选标准:按创伤严重度评分(abbreviated injury score-injury severity score,AIS-ISS)≥16分[2];受伤时间≤24 h;Ramsay镇静评分(Ramsay sedation scale)[3]均为1分者(Ramsay镇静评分的标准:1:焦虑、躁动不安; 2:安静合作、有定向力;3:嗜睡,能听从指令;4:嗜睡,对轻叩眉间或大声听觉刺激反应敏捷;5:嗜睡,对轻叩眉间或大声听觉刺激反应迟钝;6:深睡状态,无任何反应)。排除标准:(1)伤情诊断不明、不可控出血患者;(2)病情出现重大变化如突发瞳孔变化自行退出研究;(3)严重休克,平均动脉压(mean artery pressure, MAP)<50 mmHg(1 mmHg=0.133 kPa)者;(4)心率<60次/分者。其中男36例,女24例;年龄18~72岁,平均(56.72±9.21)岁。致伤原因为交通伤42例(70.00%),高处坠落伤15例(25.00%),其它3例(5.00%)。随机分为DEX(江苏恒瑞医药股份有限公司产品,批号:10082734)镇静组(DEX组,n=20)、咪达唑仑(midazolam,MDZ,江苏恩华药业股份有限公司产品,批号:20100513)镇静组(MDZ组,n=20)和不用镇静剂的对照组(n=20)。3组患者间资料差异无统计学意义(P>0.05),见表1。
表13组患者一般资料
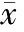

GroupSex(male/female)Age(year)AIS-ISSDEX12/855.85±10.4526.32±8.59MDZ11/956.41±11.3826.53±9.25Control13/756.96±12.7226.75±7.26
2方法
3组研究对象入住ICU立即均按常规进行补液、呼吸循环支持、抗感染、脏器功能保护、营养支持及对症处理等治疗,根据病情需要行控制性手术。其中DEX与MDZ镇静2组在常规治疗的基础上进入ICU时立即实施镇静治疗,镇静持续时间为48 h。DEX组:先静脉注射DEX负荷量1~2 μg/kg(>10 min),继以微量注射泵持续静脉泵注维持量0.2~0.7 μg·kg-1·h-1; MDZ组:先静脉注射MDZ负荷量0.03~0.3 mg/kg,继以微量注射泵持续静脉泵注维持量0.03~0.2 mg·kg-1·h-1。最初每10 min进行1次Ramsay镇静评分,并根据镇静评分结果调整给药速度,直至镇静维持Ramsay评分2~4分,以后每小时进行1次Ramsay评分。所有患者均用NIHON KOHDENBSM-4113K床旁多功能监护仪严密监测患者心率(heart rate,HR)、MAP、血压(blood pressure,BP)、呼吸频率(respiratory rate,RR)和脉搏氧饱和度(pulse oxygen saturation,SpO2)。
3标本留取和检测
3组患者均在入院后第0 h、24 h、48 h抽取静脉血,离心分离血清后于-70 ℃低温保存备检。留取标本进行TNF-α、IL-1、IL-6和CRP检测。标本检测由专人严格按试剂盒说明进行操作。
4统计学处理

结 果
1炎症指标的变化
3组患者TNF-α、IL-1、IL-6和CRP水平在入住ICU时均明显高于正常值,但差异无统计学意义(P>0.05);TNF-α、IL-1、IL-6和CRP在对照组第24 h、48 h逐步升高,而在DEX组和MDZ组有所下降,与对照组比较显著降低(P<0.05,P<0.01), DEX组与MDZ组比较,第24 h TNF-α、IL-1、IL-6和CRP变化无显著差异(P>0.05),但第48 h的变化差异显著(P<0.05),见表2。
2DEX组和MDZ组的不良反应
在目标镇静范围内,2种药物引起心动过缓(bradycardia)(HR<60 min-1)、低血压(hypotension)(MAP<50 mmHg)及呼吸抑制(respiratory depression)(RR<16 min-1)等不良事件的发生率,DEX组心动过缓发生率百分比高于MDZ组,低血压及呼吸抑制的发生率百分比低于MDZ组,但2组不良事件发生率比较差异无统计学意义(P>0.05),见表3。

表2 3组各时点TNF-α、IL-1、IL-6 和CRP的变化
*P<0.05,**P<0.01vscontrol group;△P<0.05vsDEX group at 48 h.
表3DEX组和MDZ组的不良反应
Table 3. Adverse events of sedation with dexmedetomidine (DEX) or midazolam (MDZ) (n=20)

GroupBradycardiaHypotensionRespiratorydepressionDEX4(20%)3(15%)0(0)MDZ2(10%)4(20%)2(1%)
讨 论
严重创伤诱导机体发生严重持续的不良应激反应[4],包括细胞因子和急性期反应物质的释放,儿茶酚胺、皮质醇、生长激素和促肾上腺皮质激素水平的升高,免疫系统抑制、血液高凝状态、氧耗增加等, 诱导全身炎症反应综合征(systemic inflamatory response syndrome,SIRS)和多器官功能障碍综合症(multiple organ dysfunction syndrome,MODS)的发生,是创伤患者死亡的重要因素。目前认为,在创伤早期(72 h 内)各种炎症介质表现最为活跃[5]。TNF-α是严重创伤后最重要的细胞炎症因子,具有广泛的生物效应,能刺激其它细胞因子IL-1、IL-6等产生释放等,从而介导创伤后细胞炎症反应,引起多器官组织损伤[6]。IL-1、IL-6、TNF-α等细胞因子刺激肝细胞和上皮急性期反应蛋白CRP的合成[7],CRP作为一种急性期炎症反应蛋白,其水平是体内炎症的敏感指标,且CRP水平还可以反映循环系统中炎症细胞因子的量及活性。这些炎症介质等反应构成了严重创伤后病情发展的病理生理基础。因此早期实施对炎症介质的干预具有重要意义。
目前ICU中的镇痛、镇静已形成共识[8]。一致认为通过对ICU患者实施镇静治疗有助于其机体心理状态和生理功能的双重恢复,改善患者的预后。咪达唑仑是常用的镇静催眠药、麻醉药,被广泛应用于各种麻醉和ICU镇静。研究咪达唑仑对免疫调节作用的结果比较一致,认为其有抑炎症趋势。持续输注咪达唑仑48 h,病人血浆促炎症细胞因子IL-1、IL-6、TNF-α与输注前比较有明显下降[9-10]。Zavala等[11]研究表明咪达唑仑可抑制小鼠单核/巨噬细胞系统促炎症细胞因子(IL-1、IL-6、TNF-α)的分泌。右旋美托咪啶为一种α2肾上腺素能受体激动剂型新镇静药,兼具镇静与镇痛作用。Venn等[12]研究发现,它在ICU患者中的药代动力学与健康志愿者相似,给予小剂量的负荷剂量就能提供有效的镇静而无呼吸抑制等不良反应发生。
研究发现,DEX镇静组及MDZ镇静组的TNF-α、IL-1、IL-6和CRP水平在第24 h和48 h分别与对照组比较显著降低(P<0.05,P<0.01)。DEX及MDZ镇静2组第24 h变化无显著差异(P>0.05),但第48h的变化差异显著(P<0.05)。这提示DEX有控制严重创伤患者早期过度的炎症反应,抑制各种促炎介质释放,具有明显的抗炎作用,同时降低CRP水平,能抑制早期应激反应,比MDZ更有优势。Qiao等[13]给急性严重败血症小鼠应用DEX和MDZ镇静,将小鼠死亡率由90%分别降低至20%和30%,也证实DEX较MDZ镇静有优势。DEX有抗炎作用在国外的研究中也得到证实,Hofer等[14]证实DEX在败血症小鼠中应用后发现炎症因子TNF-α、IL-1和IL-6表达下降,提高了败血症小鼠的存活率。Can等[15]在对比DEX和甲强龙对炎症反应作用的研究中,发现DEX和甲强龙一样都能显著降低TNF-α和IL-6水平,都降低了中性粒细胞的组织浸润。观察显示DEX及MDZ镇静对第24 h和48 h CRP水平的影响较相应时点的TNF-α、IL-1和IL-6更显著 (P<0.01,P<0.05),可能与CRP达到高峰时间较TNF-α、IL-1和IL-6早相关。
研究观察不良事件发生率发现,MDZ镇静组的低血压及呼吸抑制的发生率百分比高于DEX镇静组,但DEX镇静组心动过缓发生率百分比高于MDZ镇静组,但DEX镇静组及MDZ镇静组在目标镇静范围内不良事件发生率比较无统计学意义(P>0.05),可能与样本量较少相关。DEX镇静治疗没有MDZ清醒后再入睡现象,而且在镇静治疗中既能维持病人平静又易于唤醒,配合治疗和检查,有利于我们对患者意识状态进行准确的评价,特别是对呼吸无明显抑制。
通过本研究显示,DEX对严重创伤良好有效的镇痛镇静治疗不仅仅是传统意义上的减轻患者痛苦,增加创伤患者耐受性,更重要的意义在于可在一定程度上降低创伤后过度应激反应,阻止炎症介质的进一步产生和释放,有助于病情的稳定和恢复,但DEX可能会产生低血压和心动过缓,所以应加强监测,对于有心动过缓和低血压的患者应慎用。
[1] Waage A,Halstensen A,Shalaby R,et al.Local production of tumor necrosis factor alpha,interleukin 1,and interleukin 6 in meningococcal meningitis.Relation to the inflammatory response[J].J Exp Med,1989,170 (6):1859-1867.
[2] 美国机动车医学促进会(AAAM), 重庆市急救医疗中心.简明损伤定级标准(2005)(2005修订本)[M].第1版.重庆:重庆出版社,2005:34-35.
[3] Ramsay MA,Savege TM,Simpson BR,et al.Controlled sedation with alphaxalone-alphadolone [J].Br Med J,1974,2(5920):656-659.
[4] 刘都户,粟永萍,程天民.严重创伤后应激反应的调控机理[J].中国病理生理杂志,2001, 17(1):89-92.
[5] Jastrow KM 3rd, Gonzalez EA, McGuire MF, et al. Early cytokine production risk stratifies trauma patients for multiple organ failure[J]. J Am Coll Surg, 2009, 209(3): 320-331.
[6] Spielmann S,Kerner T,Ahlers O,et al.Early detection of increased tumour necrosis factor alpha (TNFα) and soluble TNF receptor protein plasma levels after trauma reveals associations with the clinical course[J].Acta Anaesthesiol Scand, 2001, 45(3):364-370.
[7] Dinarello CA. Proinflammatory cytokines[J]. Chest, 2000, 118(2):503-508.
[8] 中华医学会重症医学分会.中国重症加强治疗病房患者镇痛和镇静治疗指导意见(2006)[J].中华外科杂志,2006,44(17):1158-1166.
[9] Helmy SA,Al-Attiyah RJ. The immunomodulatory effects of prolonged intravenous infusion of propofol versus midazolam in critically ill surgical patients[J]. Anaesthesia, 2001, 56(1):4-8.
[10]林洪启. 连续输注异丙酚和咪达唑仑对老年患者免疫功能的影响[J].中国医院药学杂志,2009,29(14):1239-1240.
[11]Zavala F,Taupin V,Descamps LB,et al.Invivotreatment with benzodiazepines inhibits murine phagocyte oxidative metabolism and production of interleukin-1,tumor necrosis factor and interleukin-6[J]. J Pharmacol Exp Ther,1990,255(2):442-450.
[12]Venn RM,Karol MD,Grounds RM.Pharmacokinetics of dexmedetomidine infusions for sedation of postoperative patients requiring intensive care [J].Br J Anaesth,2002,88(5):669-675.
[13]Qiao H,Sanders RD,Ma D,et al.Sedation improves early outcome in severely septic Sprague-Dawley rats[J]. Crit Care,2009,13(4): R136.
[14]Hofer S,Steppan J, Wagner T,et al.Central sympatholytics prolong survival in experimental sepsis[J].Crit Care,2009,13(1):R11.
[15]Can M,Gul S,Bektas V, et al.Effects of dexmedetomidine or methylprednisolone on inflammatory responses in spinal cord injury[J].Acta Anaesthesiol Scand,2009,53(8):1068-1072.
Effectofsedationbyinfusionofdexmedetomidineoninflammatoryfactorsinpatientswithseveretrauma
ZHONG Zhi-yue, HE Dai-kun, ZHANG Lin, MIN Si-qing, SHEN Jie
(IntensiveCareUnit,ChemicalInjuryTreatmentCenter,JinshanHospital,FudanUniversity,Shanghai201508,China.E-mail:j1999sh@yahoo.com.cn)
AIM: To study the effect of short-term sedation by infusion of dexmedetomidine (DEX) on the inflammatory factors in the patients with severe trauma.METHODSSixty patients with severe trauma in ICU were randomly divided into 3 groups: DEX group (n=20), midazolam (MDZ) group (n=20) and control group (without any sedatives,n=20). Dexmedetomidine at an initial loading dose of 1~2 μg/kg was administered intravenously over 10 min to the patients in DEX group before the sedation procedure of continuous infusion at dose of 0.2~0.7 μg·kg-1·h-1by a 50-mL infusion syringe was perform. Midazolam at dose of 0.03~0.3 mg/kg was also administered intravenously immediately before the procedure of a continuous infusion at dose of 0.03~0.2 mg·kg-1·h-1. The doses of DEX or MDZ for the patients receiving short-term (48 h) sedation were adjusted according to the Ramsay sedation scale scores. The serum levels of interleukins (IL-1 and IL-6), tumor necrosis factor α (TNF-α) and C-reactive protein (CRP) were measured at the time points of the baseline (before the start of the study), 24 h and 48 h of sedative infusion.RESULTSThe levels of TNF-α, IL-1, IL-6 and CRP in the 3 groups of severe traumatic patients at the time when they were admitted to the hospital were significantly higher than those of the normal values. The levels of TNF-α, IL-1, IL-6 and CRP in control group gradually increased at 24 h and 48 h, while those in DEX group and MDZ group significantly declined. No significant difference of TNF-α, IL-1, IL-6 and CRP levels between DEX group and MDZ group was observed at 24 h, but the changes were significantly different at 48 h.CONCLUSIONDexmedetomidine reduces over-stress responses to a certain extent in the traumatic patients to prevent the further production and release of inflammatory mediators, thus contributing to the stability and recovery of the patients with severe trauma.
Dexmedetomidine; Midazolam; Sedation; Trauma; Inflammation mediators
R 363
A
10.3969/j.issn.1000-4718.2012.11.012
