P53在急性肾损伤小鼠肾脏的表达及其与细胞凋亡的关系*
2012-08-02郭晓芳
郭晓芳,顾 勤,刘 宁,俞 隼
(南京大学医学院附属鼓楼医院ICU,江苏 南京 210008)
急性肾损伤(acute kidney injury,AKI)是临床常见的危急重症,死亡率在50%以上[1]。尽管现代救治技术不断提高,在预防AKI及保护肾脏方面尚无有效手段,AKI发生率及其相关死亡率并未降低。有研究表明,细胞凋亡参与了甘油、内毒素等诱导AKI的发生[2-3],且受多种凋亡基因及其相关蛋白的调控,其中P53被认为是最重要的介导细胞凋亡的基因[4]。因此,本研究通过肾脏缺血再灌注建立AKI模型观察肾组织细胞凋亡变化及P53蛋白的表达,为缺血再灌注导致的AKI分子机制的研究提供依据。
材料和方法
1 材料
1.1 动物 SPF级雄性C57BL/6小鼠18只,体重18 ~23 g,平均体重(20.03 ±0.98)g,由南京大学模式动物研究所提供。
1.2 主要试剂 P53抑制剂pifithrin-alpha(PFT-α;Calbiochem),抗 P53和肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)多克隆抗体(Santa Cruz),GAPDH(BD),抗 Bcl-2 和 caspase-3(北京博奥森生物技术有限公司),免疫组化S-P超敏试剂盒(北京中杉金桥生物技术有限公司),TUNEL试剂盒(Roche),BCA蛋白试剂盒(南京凯基生物科技发展有限公司),RIPA裂解液(南京七彩石生物科技有限公司),蛋白marker(联科生物技术有限公司),大鼠抗羊Ⅱ抗(Abcam),PVDF膜(Milipore),显影液(南京凯基生物科技发展有限公司),免疫荧光Ⅱ抗(Molecular Probes)。
2 方法
2.1 动物模型和组织标本制作
2.1.1 动物模型的建立 所有小鼠均在标准条件下饲养(标准温度、湿度、12 h明暗周期、可自由摄食);随机分为3组(n=6):假手术组、AKI组和PFT-α组。AKI组采用改良方法建立小鼠 AKI模型[5]:腹腔注射氯胺酮(2 mL/kg)麻醉小鼠,无菌条件下背部正中行长约1.5 cm的纵形切口,钝性分离并暴露双侧肾脏,游离出双侧肾蒂,无创动脉夹阻断血流,肾脏由红变紫黑色表示夹闭成功,持续夹闭45 min后开放动脉夹,肾脏恢复灌注后缝合切口。假手术组同法找到肾蒂,但不夹闭肾蒂。PFT-α组于建立AKI模型前5 min腹腔注射 PFT-α 2.2 mg/kg[6]。术后小鼠于24~29℃的环境,密切观察小鼠的生命体征,同时补充水与饲料。
2.1.2 模型成功判定标准 参考 Melnikov等[5]的方法,松开动脉夹后肾脏从紫黑色转为红色,则说明小鼠经过肾脏缺血-再灌注病理生理过程,关腹后继续观察2 h,如动物能正常活动,则认为造模成功;如果松开动脉夹后5 min,肾脏未转为红色或术中损伤大血管或者周围组织认为造模不成功。
2.1.3 标本制作 于造模后48 h,摘除眼球取外周静脉血约1 mL,测定血尿素氮、肌酐;摘取双肾,取部分肾组织经10%甲醛固定,常规石蜡包埋后,用于HE染色、TUNEL法检测凋亡小体及免疫组化法测定Bcl-2、caspase-3和TNFR蛋白水平,其余肾组织-80℃保存,用于P53蛋白含量测定。
2.2 标本检测方法
2.2.1 血尿素氮和肌酐测定 静脉血1 mL置于惰性分离胶促凝管,快速离心后取上层血清,采用日本日立公司全自动生化检测仪检测尿素氮和肌酐值。
2.2.2 肾组织HE染色及肾组织评分 取部分肾组织经10%甲醛固定,常规石蜡包埋制作石蜡切片,HE染色后光镜观察各组肾组织病理形态学变化。肾组织病理评分参照Paller等[7]评分。
2.2.3 Western blotting法检测肾组织P53蛋白 肾组织称重后剪碎匀浆,RIPA裂解液裂解,离心,取上清采用BCA蛋白试剂盒测定蛋白浓度。取30 μg蛋白样品加5×SDS加样缓冲液,加热蛋白变性后电泳,在胶上加入标准参照蛋白。封闭,先后加入Ⅰ抗溶液(P531∶3000,GAPDH 1∶3000)、Ⅱ抗(P531∶2000,GAPDH 1∶2000)。洗膜,进行 ECL 反应,之后定影、显影。
2.2.4 免疫荧光定位 P53表达 4 μm厚冰冻切片,丙酮固定PBS洗5 min×2次;修复后置于3%H2O2甲醇溶液室温孵育10 min,加Ⅰ抗P53多克隆抗体(浓度1∶1000),阴性对照用PBS替代Ⅰ抗,4℃过夜,加Ⅱ抗FITC荧光素标记的大鼠抗羊免疫球蛋白IgG(浓度1∶500),37℃避光孵育1 h,甘油封固,荧光显微镜下观察。P53由于被间接FITC标记发蓝绿色光。
2.2.5 TUNEL法检测肾组织凋亡细胞 切片常规脱蜡入水,PBS洗5min×3次,加20%正常牛血清室温30 min,将TUNEL反应混合液加在切片上,37℃温育90 min,之后PBS洗5min×3次,3%H2O2甲醇液室温阻断10 min,37℃温育90 min,加POD转化剂37℃温育30 min,DAB/H2O2显色。结果判定:细胞核呈棕色颗粒者为阳性细胞。凋亡指数计算方法:数5个高倍视野,分别计算阳性细胞数和总细胞数。凋亡指数(%)=阳性细胞数/总细胞数 ×100%。
2.2.6 免疫组化法检测肾组织 Bcl-2、TNFR和caspase-3 石蜡组织切片常规脱蜡,浸入3%H2O2中10 min,加正常山羊血清封闭20 min后,依次加Ⅰ抗 (抗 Bcl-2、TNFR和 caspase-3多克隆抗体)(1∶200)50 μL,生物素标记Ⅱ抗 50 μL,室温孵育 30 min,DAB显色。苏木精复染、脱水、透明及封片后镜检。细胞染色呈棕黄色为阳性,定位于细胞浆或细胞核。胞浆染色结果判定:无着色0分;淡黄色为1分;棕黄色为2分;棕褐色3分。计数5个高倍视野(×200)下阳性细胞所占的百分比,无着色细胞为0分;≤10%为1分;11%~50%为2分;51%~75%为3分;>75%为4分。计算两部分相乘结果。
3 统计学处理
结 果
1 肾功能变化
PFT-α组和AKI组小鼠血尿素氮和肌酐水平明显高于假手术组,而PFT-α组与AKI组比较,血尿素氮和肌酐水平明显降低(P<0.05),见表1。
表1 各组血尿素氮、血清肌酐、肾小管评分和凋亡指数的比较Table1.The results of blood urea nitrogen(BUN),serum creatinine(SCr),tubular score and apoptotic index in each group(.n=6)

表1 各组血尿素氮、血清肌酐、肾小管评分和凋亡指数的比较Table1.The results of blood urea nitrogen(BUN),serum creatinine(SCr),tubular score and apoptotic index in each group(.n=6)
*P <0.05 vs sham group;#P <0.05 vs AKI group.
Group BUN(mmol/L) SCr(μmol/L) Tubular score Apoptoic index(%)Sham 15.42 ±5.08 4.33±1.86 0.17±0.41 0.67±0.58 AKI 77.78 ±5.82* 152.00±16.55* 4.50±0.55* 28.00±2.01*PFT -α 61.65 ±3.06*# 74.33±9.83*# 2.83±0.41*# 5.00±1.04*#
2 肾组织病理学变化
假手术组肾组织无明显病变;AKI组光镜下见皮质肾小管上皮细胞空泡、滴状变性,刷状缘消失,有明显淤血带;PFT-α组光镜下见皮质肾小管上皮细胞空泡,滴状变性减少,淤血带明显减轻,造模后48 h Paller病理评分明显低于AKI组(P <0.05),见图1、表1。
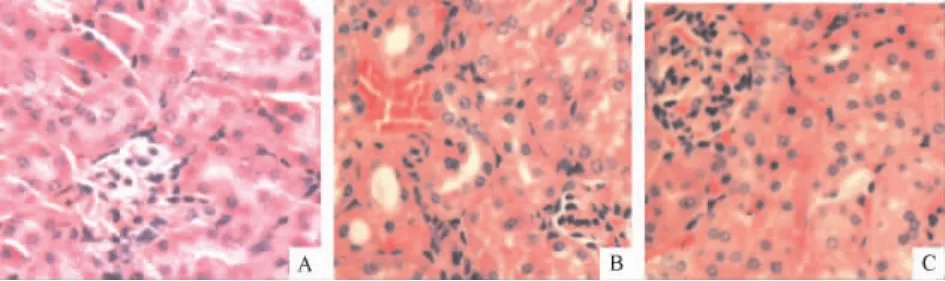
Figure1.The pathophysiological changes in the kidney of mice(HE staining,× 200).A:sham group;B:AKI group;C:PET-α group.图1 各组小鼠肾皮质组织病理
3 肾组织P53表达
P53在假手术组有少量表达,而AKI组在缺血再灌注48 h后肾脏P53蛋白明显增加[(1.08±0.53)vs(4.54 ±0.88),P <0.05],见图 2,且主要定位于肾皮质,皮-髓质交界处及髓质区的肾小管和集合管分布较少,见图3。而P53在PFT-α组小鼠肾脏表达较 AKI组明显减少[(1.08±0.78)vs(4.54 ±0.88),P <0.05],见图 2。
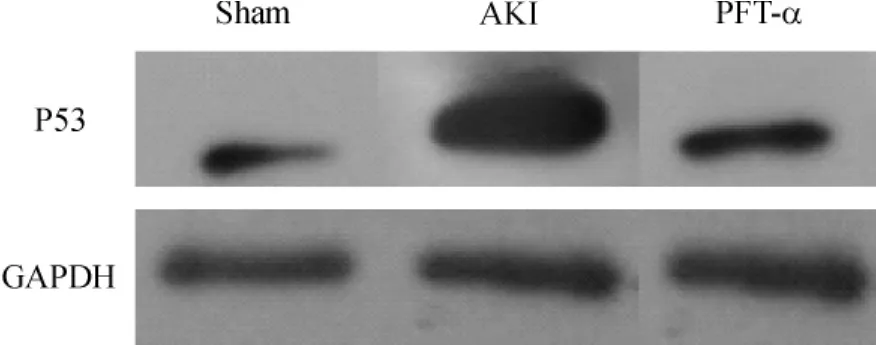
Figure2.The level of P53 protein in each group.图2 各组小鼠肾组织P53蛋白水平
4 肾组织细胞凋亡
假手术组小鼠肾脏未见凋亡细胞,AKI组与PFT-α组小鼠肾组织均可见凋亡细胞,而PFT-α组与AKI组比较肾组织细胞凋亡指数降低(P<0.05),见图4。AKI组小鼠肾组织凋亡细胞多位于皮质,皮-髓质交界处及髓质区肾小管和集合管分布较少,与肾脏P53的表达部位一致,见图5、表1。

Figure3.The results of P53 protein immunofluorescence staining in the kidney of AKI group(×200).A:cortex;B:cortex-medulla junction;C:medulla.图3 AKI组肾组织P53蛋白免疫荧光

Figure4.The apoptotic cells in the kidney of mice were detected by TUNEL in each group(×200).A:sham group;B:AKI group;C:PET-α group.图4 各组肾组织凋亡细胞TUNEL检测

Figure5.The apoptotic cells were detected by TUNEL in AKI group(×200).A:cortex;B:cortex-medulla junction;C:medulla.图5 AKI组肾组织凋亡细胞TUNEL检测
5 肾组织TNFR、Bcl-2和caspase-3蛋白含量
各组小鼠肾组织均见TNFR、Bcl-2和 caspase-3蛋白表达。与假手术组相比,AKI组小鼠肾脏TNFR 和 caspase-3蛋白水平升高(P <0.05),Bcl-2蛋白水平降低(P<0.05)。而 PFT-α组与 AKI组比较 TNFR和 caspase-3蛋白水平降低(P<0.05),Bcl-2 蛋白水平升高(P <0.05),见图 6、表2。
讨 论

Figure6.The expression of TNFR,caspase-3 and Bcl-2 proteins in the kidney of mice were detected by immunohistochemical staining(×200).图6 各组小鼠肾组织TNFR、caspase-3及Bcl-2蛋白的表达
表2 各组小鼠肾组织TNFR、caspase-3和Bcl-2蛋白的表达Table2.The expression of TNFR,caspase-3 and Bcl-2 protiens in each group(.n=6)

表2 各组小鼠肾组织TNFR、caspase-3和Bcl-2蛋白的表达Table2.The expression of TNFR,caspase-3 and Bcl-2 protiens in each group(.n=6)
*P <0.05 vs sham group;#P <0.05 vs AKI group.
Group TNFR Caspase-3 Bcl-2 Sham 1.67 ±0.82 2.00 ±0.89 10.50 ±1.38 AKI 9.75 ±0.76*11.00 ±1.26* 1.83 ±0.98*PFT - α 5.55 ±0.82*#7.00 ±1.26*#5.83 ±0.75*#
休克、创伤、严重感染、烧伤等患者由于经历缺血再灌注损伤,可导致急性肾功能衰竭,对于危重患者而言,缺血再灌注是急性肾损伤发生的重要病理生理机制,过去认为急性肾小管坏死是AKI发生的主要病理改变[8]。由于近年来临床活检和实验研究发现轻度急性肾小管坏死与临床表现的肾功能障碍程度之间不一致,推测除肾小管细胞坏死以外还存在其它肾小管上皮细胞丢失的途径[9]。本研究结果表明,正常小鼠肾脏组织未出现细胞凋亡,夹闭肾动脉再开放后肾脏凋亡细胞明显增加,且肾小管上皮细胞刷状缘脱落、空泡及滴状变性,皮髓质间有明显淤血带,肾脏组织具有明显病理改变。因此认为,肾脏缺血再灌注时,细胞凋亡是肾功能丧失的重要途径,参与介导急性肾损伤的发生[10]。正常情况下约94%血液供应皮质层,5%供应外髓质,其余不到1%供应内髓,肾损伤时肾脏血流减少的部位主要在皮质,因此皮质相对髓质对缺血敏感性高。本研究发现AKI组小鼠肾脏凋亡细胞主要集中于皮质,缺血再灌注致急性肾损伤易于发生细胞凋亡。
细胞凋亡受多种凋亡基因及其相关蛋白的调控,p53被认为是最重要的介导细胞凋亡基因[4]。缺血、缺氧等应激刺激P53蛋白富集,激活相关凋亡蛋白表达或作为转录因子调节下游凋亡基因表达,介导细胞凋亡发生。本研究结果证实肾脏缺血再灌注刺激P53表达及凋亡小体增加,且二者表达部位一致,均主要分布于皮质,因此推测急性肾损伤时,肾组织P53表达增加,可能参与介导细胞凋亡。为了明确P53蛋白与细胞凋亡的关系,本实验通过腹腔注射P53特异性抑制剂PFT-α,观察肾脏细胞凋亡及肾功能变化。PFT-α通过特异性抑制P53依赖诱导的细胞凋亡,近年来在抑制抗肿瘤治疗的副作用及研究P53功能方面受到广泛关注[11-12]。本实验于小鼠肾动脉夹闭前5 min腹腔注射PFT-α 2.2 mg/kg[6],发现与 AKI组相比,PFT - α 组小鼠肾组织P53表达下降,肾脏细胞凋亡指数降低85.7%,肾功能指标血尿素氮和肌酐水平分别降低20.7%和48.3%,表明肾脏缺血再灌注时,P53表达增加,介导细胞凋亡,参与AKI的发生。
目前公认的2条细胞凋亡通路均有P53蛋白的参与,即线粒体凋亡通路和死亡受体通路,前者通过激活Bcl-2家族成员中促凋亡基因bax表达,抑制抗凋亡基因bcl-2的表达,引起线粒体细胞色素C向胞质内释放;后者通过细胞表面死亡受体如TNF-α和其配基TNFR结合,2条通路最终激活凋亡蛋白执行酶caspase-3(共同通路),介导细胞凋亡[4]。Cunningham等[13]通过脓毒症导致的AKI模型发现,P53及死亡受体通路中表面受体配基TNFR蛋白在AKI肾组织的近曲小管周围表达增加,同时TUNEL法检测肾小管周围凋亡小体增多且与肾功能下降程度呈正相关。也有研究报道[14],顺铂可上调小鼠TNFR及P53蛋白在肾脏的表达,肾功能障碍程度、细胞凋亡指数升高,表明P53蛋白通过激活细胞凋亡的死亡受体通路参与了脓毒症相关AKI、肾毒性药物顺铂所致AKI的病理过程。本实验通过夹闭小鼠肾动脉再开放建立缺血再灌注模型,研究各组小鼠肾组织Bcl-2、TNFR和caspase-3蛋白水平,发现与假手术组相比,AKI组P53表达增加,同时线粒体凋亡通路中抗凋亡蛋白Bcl-2水平降低,表面受体通路配基TNFR蛋白及二者共同通路凋亡执行蛋白酶caspase-3蛋白水平升高;建模前给予PFT-α后P53表达降低,同时Bcl-2蛋白水平升高,TNFR和caspase-3蛋白水平降低,表明肾脏缺血再灌注时,P53表达增加,同时激活细胞凋亡的线粒体和死亡受体通路,介导细胞凋亡。
另外PFT-α组小鼠在腹腔注射PFT-α后小鼠肾功能、肾脏组织病理学并未恢复至正常水平,原因可能为介导细胞凋亡的机制错综复杂,涉及到多种促凋亡基因表达,除了P53介导的细胞凋亡通路外,还存在非依赖P53蛋白介导细胞凋亡的途径。
肾脏缺血再灌注时,P53通过干预细胞凋亡的线粒体凋亡通路和表面受体通路,主要定位表达皮质近曲小管,介导细胞凋亡,影响肾功能,参与AKI的发生。通过干预细胞凋亡途径减轻肾小管损伤,为治疗缺血再灌注导致的急性肾损伤提供了特异性治疗策略。
[1]Kohli HS,Bhat A,Jairam A,et al.Predictors of mortality in acute renal failure in a developing country:a prospective study[J].Ren Fail,2007,29(4):463 - 469.
[2]Homsi E,Janino P,de Faria JB.Role of caspases on cell death,inflammation,and cell cycle in glycerol- induced acute renal failure[J].Kidney Int,2006,69(8):1385-1392.
[3]Guo R,Wang Y,Minto AW,et al.Acute renal failure in endotoxemia is dependent on caspase activation[J].J Am Soc Nephrol,2004,15(12):3093 -3102.
[4]Morton JP,Kantidakis T,White RJ.RNA polymerase Ⅲtranscription is repressed in response to the tumour suppressor ARF[J].Nucleic acids Res,2007,35(9):3046-3052.
[5]Melnikov VY,Faubel S,Siegmund B,et al.Neutrophilindependent mechanisms of caspase-1-and IL-18-mediated ischemic acute tubularnecrosis in mice[J].J Clin Invest,2002,110(8):1083 -1091.
[6]Wei Q,Dong G,Yang T,et al.Activation and involvement of P53 in cisplatin-induced nephrotoxicity[J].Am J Physiol Renal Physiol,2007,293(4):F1282 -F1291.
[7]Paller MS,Hoidal JR,Ferris TF.Oxygen free radicals in ischemic acute renal failure in the rat[J].J Clin Invest,1984,74(4):1156-1164.
[8]De Broe ME.Apoptosis in acute renal failure[J].Nephrol Dial Transplant,2001,16(Suppl 6):23 -26.
[9]Rana A,Sathyanarayana P,Lieberthal W.Role of apoptosis of renal tubular cells in acute renal failure:therapeutic implications[J].Apoptosis,2001,6(1 -2):83 -102.
[10]Devarajan P.Update on mechanisms of ischemic acute kidney injury[J].J Am Soc Nephrol,2006,17(6):1503-1520.
[11]El-Gibaly AM,Scheuer C,Menger MD,et al.Improvement of rat liver graft quality by pifithrin-α-mediated inhibition of hepatocyte necrapoptosis[J].Hepatology,2004,39(6):1553-1562.
[12]Liu X,Chua CC,Gao J,et al.Pifithrin-α protects against doxorubicin-induced apoptosis and acute cardiotoxicity in mice[J].Am J Physiol Heart Circ Physiol,2004,286(3):H933-H939.
[13]Cunningham PN,Dyanov HM,Park P,et al.Acute renal failure in endotoxemia is caused by TNF acting directly on TNF receptor- 1 in kidney[J].J Immunol,2002,168(11):5817-5823.
[14]Tsuruya K,Ninomiya T,Tokumoto M,et al.Direct involvement of the receptor-mediated apoptotic pathways in cisplatin- induced renal tubular cell death[J].Kidney Int,2003,63(1):72 -82.
