细胞钙离子转运蛋白兰尼碱受体3与ApoE基因敲除小鼠动脉粥样硬化斑块形成的关系*
2012-11-06冯利霞葛长江吕树铮孙海梅季凤清
冯利霞, 葛长江△, 吕树铮, 孙海梅, 季凤清, 霍 勇
(1首都医科大学附属北京安贞医院心内科,北京市心肺血管疾病研究所,北京 100029;2首都医科大学基础医学院组织学与胚胎学教研室,北京100069;3北京大学第一医院心内科,北京100034)
1000-4718(2012)09-1686-04
2012-03-29
2012-07-11
国家“十一五”科技支撑计划(No.2006BAI01A02);首都医学科技发展基金资助项目(No.SF-2009-I-09);首都医科大学基础与临床合作基金课题(No.11JL51)
△通讯作者 Tel:010-64456473;E-mail:cjge1116@163.com
·短篇论著·
细胞钙离子转运蛋白兰尼碱受体3与ApoE基因敲除小鼠动脉粥样硬化斑块形成的关系*
冯利霞1, 葛长江1△, 吕树铮1, 孙海梅2, 季凤清2, 霍 勇3
(1首都医科大学附属北京安贞医院心内科,北京市心肺血管疾病研究所,北京 100029;2首都医科大学基础医学院组织学与胚胎学教研室,北京100069;3北京大学第一医院心内科,北京100034)
目的观察细胞钙离子转运蛋白兰尼碱受体3(ryanodine receptor 3, RYR3)在动脉粥样硬化斑块形成过程中的改变,探讨两者的相关性。方法选取6周龄雄性载脂蛋白E基因敲除(ApoE-/-)小鼠及野生型C57BL/6J小鼠,高脂饲喂20、27和33周后,在各个时点处死动物取主动脉根部制作连续切片。(1)HE染色,观察组织形态学的变化,计算机图像分析仪测量斑块面积和血管管腔面积,计算校正斑块面积(斑块面积/血管管腔面积)。(2)免疫组织化学染色,计算机图像分析仪测定不同周龄小鼠细胞钙离子转运蛋白RYR3表达变化。结果与同周龄对照组小鼠相比,ApoE-/-小鼠体内RYR3表达显著减少(P<0.05),随着ApoE-/-小鼠周龄的增加,RYR3的表达明显减少,且与斑块面积/血管管腔面积呈负相关(r=-0.652,P<0.01)。结论细胞钙离子转运蛋白RYR3参与动脉粥样硬化的病理过程,且与动脉粥样硬化斑块的形成密切相关。
兰尼碱受体3;载脂蛋白E;动脉粥样硬化
作为冠心病的重要始动因素,动脉粥样硬化是以血管内皮损伤为基础的多种危险因素综合作用的结果,主要包括血管重塑和易损斑块形成。血管平滑肌细胞(vascular smooth muscle cells, VSMCs)增殖与凋亡是决定动脉粥样硬化斑块发生、发展的重要环节。已知Ca2+参与细胞增殖和凋亡的过程,而Ca2+稳态的维持则受细胞离子泵的调控。细胞离子通道的开通和激活与动脉粥样硬化性血管疾病密切相关[1-2]。Van Assche等[3]研究发现,在动脉粥样硬化斑块形成之前,ApoE-/-小鼠主动脉VSMCs内基础Ca2+水平增高,1, 4, 5-三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor,IP3R)含量及其介导的Ca2+释放均明显增高,而兰尼碱受体(ryanodine receptor, RYR)含量却未见明显改变,然而尚不明确动脉粥样硬化斑块长期形成过程中该蛋白的动态表达变化规律及其间的关系。本研究应用载脂蛋白E基因敲除(apolipoprotein E gene-deficient,ApoE-/-)小鼠动脉粥样硬化模型,观察在动脉粥样硬化病程中,主动脉VSMCs内RYR3表达的改变,并明确其与动脉粥样硬化斑块之间的关系。
材 料 和 方 法
1动物和试剂
6周龄ApoE-/-(品系C57BL/6J,北京大学医学部实验动物科学部自美国Jackson实验室引进并培育)15只,质量合格证号[SCXK(京)2006-0008],野生型C57BL/6J小鼠由中国人民解放军军事医学科学院实验动物中心提供,质量合格证号[SCXK(京)2007-004]。均为雄性,体重18~20 g,饲养条件为2级,室温保持在22~24 ℃,相对湿度50%,光照时间7:00~19:00。RYR3Ⅰ抗购自Chemicon,Ⅱ抗、DAB试剂盒购自北京中杉金桥生物技术有限公司。
2动物分组和模型制备
选取15只6周龄ApoE-/-为模型组,野生型C57BL/6J小鼠为对照组,分别给予高脂饲料(基础饲料78.85%,脂肪21%,胆固醇0.15%),喂养20周、27周和33周(每组5只)。在各个时点处死动物后取主动脉根部用 4%多聚甲醛固定,石蜡包埋制备连续切片。
3方法
3.1标本处理 20周龄、27周龄、33周龄时随机各取5只处死动物,处死前1 d晚上禁食不禁水。无菌条件下取出心脏和主动脉,10%甲醛固定,脱水,常规石蜡包埋,小鼠心底部横断面连续切片。每只小鼠的主动脉根部取4个相同的切面[4-5],分别是:(1)升主动脉最近端横截面,切面形态呈圆形;(2)主动脉瓣附着部位,并有冠状动脉开口;(3)主动脉瓣起始横截面;(4)主动脉瓣完全出现并汇合在一起。每隔100 μm连续取6张切片,切片厚5 μm,相邻的2个切面分别进行HE染色及免疫组织化学染色。
3.2斑块面积的测定 HE染色,形态计量学测定斑块面积、血管管腔面积(取4个切面平均值),计算矫正的斑块面积(斑块面积/血管管腔面积)。
3.3免疫组织化学染色法测定RYR3蛋白含量 取主动脉根部10%甲醛固定、脱水、透明、石蜡包埋,制成厚5 μm组织切片,置于APES防脱玻片上60 ℃烤片固定,脱蜡、水化,3% H2O2封闭内源性过氧化氢酶5~10 min,蒸馏水洗3次,微波修复抗原柠檬酸盐缓冲液(pH 6.0)92~98℃,15 min;自然冷却,PBS洗3次,滴加1∶500的兔抗小鼠RYR3Ⅰ抗(含1%牛血清)4 ℃孵育24 h,PBS洗3次后,HRP标记的山羊抗兔IgG抗体室温孵育30 min,滴加DAB显色剂,显微镜下观察显色变化,约60 s后自来水终止反应。蒸馏水洗,苏木精复染2 min,蒸馏水洗5 min,自来水返蓝,后脱水、透明、封片、镜检。实验均设阳性对照与阴性对照,用已知阳性切片作阳性对照,用PBS缓冲液代替Ⅰ抗作阴性对照。结果的判定:光镜下,阳性表达RYR3的细胞,胞浆呈黄至棕黄色,RYR3定位于胞浆。定量分析:×200下Leica Q 5501W图像处理显微镜进行图像分析,测定RYR3蛋白的积分吸光度值,取4个切面的平均值。
4统计学处理
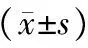
结 果
1不同周龄小鼠主动脉粥样硬化斑块的病理结构变化
20周龄ApoE-/-小鼠有纤维斑块形成,此时尚有比较完整的纤维帽,内含小的脂质中心和少量泡沫细胞,纤维帽主要由VSMCs、弹力纤维和较多的胶原纤维组成。27周龄ApoE-/-小鼠有粥样斑块形成,泡沫细胞堆积,纤维帽变薄,且含有更多的弹力纤维及胶原纤维,部分破裂。33周龄ApoE-/-小鼠粥样斑块进展明显,大量泡沫细胞崩解,深部为大量无定形坏死物质,斑块破裂、管腔狭窄明显,严重者达70%~90%。对照组C57BL/6J各周龄小鼠未见斑块的形成,中层VSMCs也未发生明显变化,见图1。
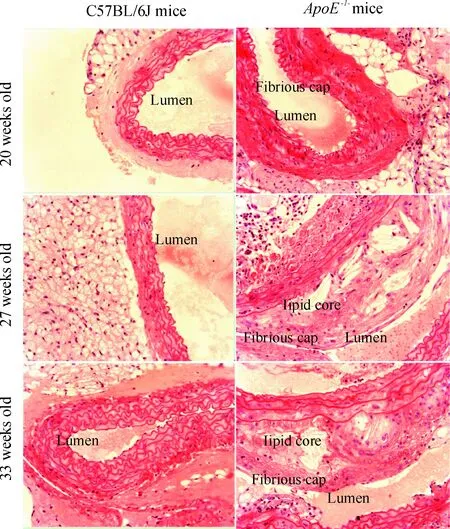
Figure 1. Pathological changes of atherosclerotic plaques in the aorta ofApoE-/-mice (HE staining, ×200). C57BL/6J mice served as controls.
图1ApoE-/-小鼠主动脉粥样硬化斑块的病理变化
2不同周龄ApoE-/-小鼠主动脉粥样硬化斑块面积的测定
从20周龄至33周龄动态连续观测结果看,随时间延长,ApoE-/-小鼠的斑块面积大小及校正斑块面积的比值呈增长趋势,说明斑块增长与时间呈正比,见表1。
表1ApoE-/-小鼠主动脉粥样硬化斑块面积

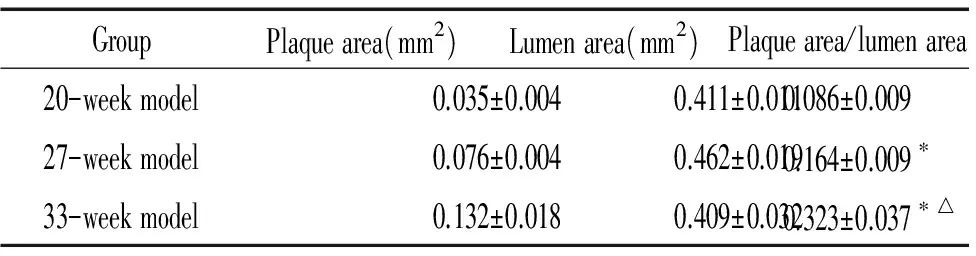
GroupPlaquearea(mm2)Lumenarea(mm2)Plaquearea/lumenarea20-weekmodel0.035±0.0040.411±0.0110.086±0.00927-weekmodel0.076±0.0040.462±0.0190.164±0.009∗33-weekmodel0.132±0.0180.409±0.0320.323±0.037∗△
*P<0.05vs20-week model group;△P<0.05vs27-week model group.
3RYR3免疫组化染色测定
与同周龄C57BL/6J小鼠比较,细胞钙离子转运蛋白RYR3在ApoE-/-小鼠动脉粥样硬化斑块中的表达明显降低(P<0.05),随着ApoE-/-小鼠周龄的增加, RYR3活性和表达明显降低(P<0.05),见图2、表2。
4RYR3含量与斑块面积之间的相关性
随着周龄的增加,RYR3表达与斑块面积/管腔面积呈负相关(r=-0.652,P<0.01)。

Figure 2. Expression of ryanodine receptor 3 (RYR3) in the aorta of C57BL/6J mice (control group) andApoE-/-mice (model group) (immunohistochemical staining, ×200). Red arrows indicate vascular smooth muscle cells expressing RYR3.
图2RYR3在小鼠主动脉中的表达
表2RYR3免疫组化染色积分吸光度值


GroupRyanodinereceptor320-weekmodel0.182±0.007#27-weekmodel0.162±0.003∗#33-weekmodel0.142±0.004∗△#20-weekcontrol0.193±0.00527-weekcontrol0.192±0.00333-weekcontrol0.189±0.002
*P<0.05vs20-week model group;△P<0.05vs27-week model group;#P<0.05vscontrol group at the same age.
讨 论
动脉粥样硬化斑块形成以内皮功能紊乱为病理学特征,主要涉及多种危险因子对血管内皮损伤、源于血管平滑肌细胞和巨噬细胞的泡沫细胞沉着入内皮间隙以及血管平滑肌细胞增殖迁移等,终致纤维脂质斑块形成。尽管动脉粥样硬化斑块的大小决定组织缺血的程度,然而决定动脉粥样硬化最终结局的却是斑块的“行为”。动脉粥样硬化斑块的组成决定其临床意义。与稳定斑块相比,不稳定斑块(易于破裂)包含着较高比例的炎症细胞及脂质和较低比例的VSMCs组成的纤维帽,这些薄纤维帽斑块的破裂是产生致命性心脏猝死最常见的原因[6]。因此VSMCs是动脉粥样硬化斑块中最重要的细胞成分之一,在动脉粥样硬化病程中一旦变化将推动其发生发展。
VSMCs是组成血管壁的主要细胞之一,具有非常强的可塑性,能在静止的分化表型和增殖表型之间转化,Ca2+在这种改变中发挥着重要作用。细胞内Ca2+浓度受细胞膜和肌质网(sarcoplasmic reticulum,SR)膜上的Ca2+通道所调控。细胞内Ca2+主要贮存于肌质网内,贮存Ca2+的释放由RYR及IP3R介导,释放于肌浆内的Ca2+在SR Ca2+-ATP酶(SR Ca2+-ATPase, SERCA)的调控下逆浓度差摄入SR。这样一来,由IP3及RYR引起的Ca2+释放最终导致细胞内Ca2+库耗竭。细胞内和肌质网内一定浓度的游离状态Ca2+对于维持VSMCs的增殖和分化至关重要。游离Ca2+浓度增高促进细胞增殖,但过度增高甚至肌质网储存Ca2+排尽可造成细胞凋亡。在动脉粥样硬化早期,凋亡频率非常低,在晚期达到高峰,伴随着VSMCs和巨噬细胞展示凋亡的特性[7-8],提示VSMCs凋亡可能通过削弱纤维帽来促进斑块破裂。
RYR是位于肌质网膜上的Ca2+释放通道,对细胞内Ca2+浓度非常敏感:1~10 μmol/L Ca2+浓度使通道激活,大于10 μmol/L Ca2+浓度抑制通道的激活[9]。截止目前,发现 RYR通道有3种亚型:RYR1、RYR2和RYR3。RYR存在于几乎所有的肌细胞类型,RYR1主要引起骨骼肌兴奋,RYR2实现心肌收缩,已证实小鼠VSMCs主要表达RYR3亚型[10]。当Ca2+通过L型Ca2+通道进入细胞膜时,激活肌质网上的IP3R、RYR1和RYR2,Ca2+从肌质网流向细胞质,即钙触发钙释放(Ca2+-induced Ca2+release, CICR)。当细胞内的Ca2+浓度达到一定水平时,肌质网上的靠近细胞膜的RYR3被激活,进一步激活该处细胞膜上的K+通道,引起自发性短暂性外向性电流(spontaneous transient outward currents,STOCs)的产生,调节细胞膜电位,使膜复极化,进而使通过细胞膜进入细胞的Ca2+减少[11-12]。
本研究表明,随着时间的延长,ApoE-/-小鼠模型中的动脉粥样硬化斑块经历从脂纹、纤维斑块至粥样斑块的不同时期,且不仅局限于主动脉根部,在冠状动脉、主动脉弓及其分叉处、颈总动脉及其分叉处、胸主动脉、腹主动脉、双肾动脉分叉处均可形成斑块,与人类全身动脉粥样硬化斑块形成的过程及好发部位相近[13],说明ApoE-/-小鼠是研究动脉粥样硬化发生发展的可靠模型;且斑块的组成也发生了明显变化,由较低比例的炎症细胞、脂质和较厚的纤维帽,逐渐转变为高比例的炎症细胞、脂质和较薄的纤维帽。随着周龄的增加,斑块面积也逐渐增加。而对照组C57BL/6J小鼠发展至脂纹期后几乎就不再进一步发展,且病变大部分局限于主动脉窦部。
且从20周龄~33周龄动态连续观测结果看,20周龄时ApoE-/-小鼠RYR3功能开始受损,随着时间延长,其活性逐渐减弱,且与校正斑块面积呈负相关。年幼小鼠体内氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)的水平不足以引起RYR功能的改变,然而慢性低水平的 ox-LDL却削弱了RYR功能的发挥。这与目前的研究结论一致[3, 14-15]。可能的解释是RYR3的丢失使VSMCs不能发挥终止RYR1,2介导的CICR[11],使细胞内Ca2+浓度持续增加。细胞内Ca2+轻度增加可以促进增殖,但过度增高甚至肌质网储存Ca2+排尽可造成细胞凋亡。在动脉粥样硬化斑块形成的晚期确实见到VSMCs的大量凋亡,由此推测,RYR3与VSMCs凋亡密切相关,且与动脉粥样硬化斑块形成密切相关。
未来研究将进一步阐述VSMCs凋亡过程中其它一些钙离子通道的功能改变及其与RYR3之间的相互关系,及用特异性作用于这些钙离子通道的药物进行干预,以期动态观察细胞钙离子转运蛋白活性的改变及其与动脉粥样硬化斑块不良预后的确切关系。
[1] Rainbow RD, Macmillan D, Mccarron JG. The sarcoplasmic reticulum Ca2+store arrangement in vascular smooth muscle[J]. Cell Calcium,2009,46(5-6):313-322.
[2] Berra-Romani R, Mazzocco-Spezzia A, Pulina MV, et al. Ca2+handling is altered when arterial myocytes progress from a contractile to a proliferative phenotype in culture[J]. Am J Physiol Cell Physiol,2008,295(3):C779-C790.
[3] Van Assche T, Fransen P, Guns PJ, et al. Altered Ca2+handling of smooth muscle cells in aorta of apolipoprotein E-deficient mice before development of atherosclerotic lesions[J]. Cell Calcium,2007,41(3):295-302.
[4] Suzuki H, Kurihara Y, Takeya M, et al. A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection[J]. Nature,1997,386(6622):292-296.
[5] 周明学,徐 浩,陈可冀,等. 几种活血解毒中药有效部位对ApoE基因敲除小鼠主动脉粥样斑块稳定性的影响[J]. 中国病理生理杂志, 2008,24(11):2097- 2102.
[6] Fernandez-Hernando C, Jozsef L, Jenkins D, et al. Absence of Akt1 reduces vascular smooth muscle cell migration and survival and induces features of plaque vulnerability and cardiac dysfunction during atherosclerosis[J]. Arterioscler Thromb Vasc Biol,2009,29(12):2033-2040.
[7] Clarke M, Bennett M. The emerging role of vascular smooth muscle cell apoptosis in atherosclerosis and plaque stability[J]. Am J Nephrol,2006,26(6):531-535.
[8] Clarke MC, Figg N, Maguire JJ, et al. Apoptosis of vascular smooth muscle cells induces features of plaque vulnerability in atherosclerosis[J]. Nat Med,2006,12(9):1075-1080.
[9] Rizzuto R, Marchi S, Bonora M, et al. Ca2+transfer from the ER to mitochondria: when, how and why[J]. Biochim Biophys Acta,2009,1787(11):1342-1351.
[10]Jaggar JH, Porter VA, Lederer WJ, et al. Calcium sparks in smooth muscle[J]. Am J Physiol Cell Physiol,2000,278(2):C235-C256.
[11]Rossi D, Sorrentino V. Molecular genetics of ryanodine receptors Ca2+-release channels[J]. Cell Calcium,2002,32(5-6):307-319.
[12]Lohn M, Jessner W, Furstenau M, et al. Regulation of calcium sparks and spontaneous transient outward currents by RyR3 in arterial vascular smooth muscle cells[J]. Circ Res,2001,89(11):1051-1057.
[13]徐 芳,刘 颖,石 磊,等. 载脂蛋白 E基因敲除小鼠动脉粥样硬化早期血管外膜成纤维细胞增殖活性增强 [J]. 中国病理生理杂志, 2010,26(8):1503- 1508.
[14]Massaeli H, Austria JA, Pierce GN. Lesions in ryanodine channels in smooth muscle cells exposed to oxidized low density lipoprotein[J]. Arterioscler Thromb Vasc Biol,2000,20(2):328-334.
[15]Massaeli H, Austria JA, Pierce GN. Overexpression of SERCA2 Atpase in vascular smooth muscle cells treated with oxidized low density lipoprotein[J]. Mol Cell Biochem,2000,207(1-2):137-141.
Relationshipbetweencellcalciumiontransporterryanodinereceptor3andatheroscleroticplaqueinapolipoproteinEgene-deficientmice
FENG Li-xia1, GE Chang-jiang1, LÜ Shu-zheng1, SUN Hai-mei2, JI Feng-qing2, HUO Yong3
(1DepartmentofCardiology,BeijingAnzhenHospital,CapitalMedicalUniversity,BeijingInstituteofHeart,LungandBloodVesselDiseases,Beijing100029,China;2DepartmentofHistology&Embryology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China;3DepartmentofCardiology,theFirstHospital,BeijingUniversity,Beijing100034,China.E-mail:cjge1116@163.com)
AIM: To investigate the change of cell calcium ion transporter ryanodine receptor 3 (RYR3) in the aorta smooth muscle cells of apolipoprotein E gene-deficient (ApoE-/-) mice, and to elucidate the relationship between RYR3 and atherosclerotic plaque inApoE-/-mice.METHODSSix-week-oldApoE-/-mice and wild-type C57BL/6J mice were used in the experiment. The animals were sacrificed for pathological observation at the time points of 20, 27 and 33 weeks after hyperlipidic diet, respectively. Four sections of the aortic root were prepared and HE and immunohistochemical staining were performed. All the sections were analyzed with a computer image analysis system.RESULTSCompared with the controls, the expression of RYR3 was markedly lower inApoE-/-mice (P<0.05). As the age ofApoE-/-mice increasing, the expression of RYR3 decreased significantly, and was negatively correlated to the plaque area corrected by lumen area (r=-0.652,P<0.01).CONCLUSIONCell calcium ion transporter RYR3 participates in the pathological process of atherosclerosis, and is closely related to the formation of atherosclerotic plaques.
Ryanodine receptor 3; Apolipoprotein E; Atherosclerosis
R363
A
10.3969/j.issn.1000-4718.2012.09.026
