腺病毒介导的shRNA下调PTEN表达对体外活化肝星状细胞增殖与凋亡的影响*
2012-11-06刘小娟张国尊孙慧聪刘林力郭金波姚冬梅张晓岚
郭 剑, 刘小娟, 张国尊, 孙慧聪, 刘林力, 郭金波, 刘 蕾, 姚冬梅, 宋 梅, 张晓岚△
(河北医科大学第二医院 1消化内科,2心脏外科,河北 石家庄 050000)
1000-4718(2012)09-1627-06
2012-03-11
2012-07-10
国家自然科学基金资助项目(No.30872513);河北省自然科学基金资助项目(No.C2010000565);河北省科技厅课题平台处项目(No.09966108D)
△通讯作者 Tel: 0311-66002955; E-mail: xiaolanzh@126.com
腺病毒介导的shRNA下调PTEN表达对体外活化肝星状细胞增殖与凋亡的影响*
郭 剑1, 刘小娟1, 张国尊1, 孙慧聪1, 刘林力2, 郭金波1, 刘 蕾1, 姚冬梅1, 宋 梅1, 张晓岚1△
(河北医科大学第二医院1消化内科,2心脏外科,河北 石家庄 050000)
目的探讨腺病毒介导的shRNA下调第10号染色体缺失的磷酸酶和张力蛋白同源物基因(PTEN)表达对体外培养的大鼠活化肝星状细胞(HSCs)增殖和凋亡的影响及其信号转导机制。方法体外培养活化HSCs,以腺病毒为载体将靶向PTEN的shRNA干扰重组体转染至体外活化的大鼠HSCs;四甲基偶氮唑盐(MTT)法检测HSCs增殖;末端转移酶标记技术(TUNEL)及流式细胞术测定HSCs凋亡;Western blotting方法检测PTEN、Bax、Bcl-2、Akt、p-Akt、ERK1/2及p-ERK1/2蛋白表达情况;实时荧光定量PCR方法检测PTEN、Akt及ERK1 mRNA表达情况。结果(1) 靶向PTEN的RNA干扰重组腺病毒成功感染体外活化HSCs,并在一定范围内呈时间依赖性地促进HSCs增殖,腺病毒感染HSCs后72 h,HSCs凋亡率显著下降(P<0.05);(2) Bax表达降低,Bcl-2表达增加(P<0.05);(3) p-Akt和p-ERK1/2蛋白表达显著增加(P<0.05);而Akt蛋白及其mRNA、ERK1蛋白及其mRNA表达均无显著改变(P>0.05)。结论RNA干扰下调PTEN基因表达可能通过Bcl-2/Bax途径促进体外活化HSCs增殖并抑制其凋亡,此外,RNA干扰下调PTEN基因表达促进p-Akt和p-ERK1/2表达增多,提示PTEN可能通过影响PI3K/Akt和ERK1/2信号通路而在调控HSCs增殖和凋亡中发挥重要作用。
肝星状细胞; 第10号染色体缺失的磷酸酶和张力蛋白同源物基因; RNA干扰; 细胞增殖; 细胞凋亡
肝星状细胞(hepatic stellate cells, HSCs)的活化在肝纤维化过程中发挥着重要作用[1]。如何抑制HSCs活化、增殖并诱导其凋亡是逆转肝纤维化的关键所在。HSCs在增殖、活化过程中受到多种细胞内信号转导通路的调控,作用于这些信号通路或者其中级联反应的重要环节已成为目前防治肝纤维化的新思路。
第10号染色体缺失的磷酸酶和张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)是迄今为止所发现的第一个具有双重磷酸酶活性的肿瘤抑制基因,可抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡[2],其蛋白产物具有脂质磷酸酶与蛋白磷酸酶双重活性,可以负性调控磷脂酰肌醇-3激酶 (phosphoinositol- 3-kinase, PI3K)/丝氨酸-苏氨酸蛋白激酶B(serine-threonine protein kinase B, Akt)和细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)信号通路介导的细胞生长和转化。已有研究发现过表达的PTEN可显著抑制体外活化HSCs的增殖,诱导其凋亡[3- 4],但PTEN的低表达对体外活化HSCs增殖、凋亡的影响及其细胞内信号转导机制仍需进一步明确。为此,本研究通过构建HSCs的PTEN低表达模型,观察下调PTEN表达对活化HSCs增殖及凋亡的影响,从而为寻求治疗肝纤维化的有效新靶点提供实验基础及理论依据。
材 料 和 方 法
1试剂与细胞系
携带靶向PTEN的短发卡状RNA并表达增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)的腺病毒(PTEN shRNA)及表达EGFP的空病毒(Ad-EGFP)由武汉市晶赛生物工程技术有限公司协助构建;小鼠抗PTEN单克隆抗体、小鼠抗Bax单克隆抗体、兔抗Bcl-2多克隆抗体、山羊抗Akt多克隆抗体、兔抗p-Akt多克隆抗体、兔抗ERK1/2多克隆抗体和兔抗p-ERK1/2多克隆抗体均购于Santa Cruz;SYBR Green Real Master Mix购于北京康为世纪生物科技有限公司;末端转移酶标记技术(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling, TUNEL)试剂盒购于上海碧云天生物技术有限公司;大鼠肝星状细胞系HSCs-T6(其表型为活化的HSCs)购自中国医学科学院北京肿瘤研究所;AD293T细胞由本实验室长期冷冻保存。
2实验分组
(1)对照组,仅以含10%胎牛血清的DMEM培养液培养细胞,在转染步骤加入无血清无抗生素DMEM代替病毒液;(2)Ad-EGFP组,转染表达EGFP的空病毒Ad-EGFP;(3)PTEN shRNA组,转染靶向PTEN的RNA干扰重组腺病毒PTEN shRNA。
3腺病毒感染HSCs
以感染复数(multiplicity of infection,MOI)50进行腺病毒感染。确定所需病毒颗粒量(细胞数×MOI),用无血清无抗生素的DMEM稀释病毒液并加入细胞生长的培养器皿,使病毒液均匀分布。置于37 ℃孵箱中孵育2 h,每隔15 min轻轻倾斜转动培养器皿,促进感染;2 h后,补加适当体积完全培养基,继续孵育到实验所需时间,通过倒置荧光显微镜观察EGFP表达。流式细胞仪检测转染效率达80%以上。
4直接细胞计数法绘制HSCs生长曲线
取对数生长期的HSCs,胰蛋白酶消化细胞,用含2%胎牛血清的DMEM培养液调整细胞浓度为2.0×108L-1,每孔1 mL,加入24孔培养板内,培养箱中孵育至70%~80%细胞融合时进行实验。每组设6复孔,于0 h、24 h、48 h和72 h分别进行细胞计数,绘制细胞生长曲线。
5MTT法测定HSCs增殖
将呈指数生长的HSCs以每孔6×103个细胞接种于96孔板中,每孔体积200 μL,按上述方法进行腺病毒感染,每组6个复孔,另设阴性对照孔。分别于腺病毒感染后24 h、48 h和72 h每孔加入5 g·L-1MTT 20 μL,继续孵育4 h,加入二甲基亚砜150 μL,酶标仪测定每孔的吸光度(absorbance,A),以无细胞培养液孔调零。细胞生长增殖率(%)=[实验组A值-对照组A值]/对照组A值×100%。
6TUNEL法检测HSCs凋亡
腺病毒感染HSCs后72 h,收集各组细胞爬片,应用TUNEL法按说明书操作检测HSCs凋亡,凋亡HSCs细胞核为棕黄色。随机选取5个高倍视野观察,计算凋亡指数。
7流式细胞术检测HSCs凋亡率
腺病毒感染HSCs后72 h,收集各组细胞,70%冰乙醇固定过夜,经碘化丙啶(propidium iodide, PI)染液处理后,流式细胞仪检测HSCs凋亡率。
8Westernblotting检测活化HSCs中PTEN、Bax、Bcl-2、Akt、p-Akt、ERK1/2和p-ERK1/2蛋白表达
腺病毒感染HSCs后72 h,提取各组细胞蛋白,考马斯亮蓝比色法测定蛋白含量。应用Western印迹技术检测HSCs的PTEN、Bax、Bcl-2、ERK1/2、p-ERK1/2、Akt和p-Akt蛋白表达,小鼠抗PTEN单克隆抗体、小鼠抗Bax单克隆抗体、兔抗Bcl-2多克隆抗体、山羊抗Akt多克隆抗体、兔抗p-Akt多克隆抗体、兔抗ERK1/2多克隆抗体、兔抗p-ERK1/2多克隆抗体及兔抗3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体均为1∶200稀释,采用NIH ImageJ 1.38软件进行定量分析。以GAPDH作为内参照,结果以目的条带和内参照的吸光度值来表示。
9实时荧光定量PCR技术检测HSCs中PTEN、Akt和ERK1mRNA表达
腺病毒感染HSCs后72 h,按Trizol试剂盒说明提取各组细胞总RNA,电泳鉴定RNA并定量,逆转录合成cDNA;PTEN、Akt、ERK1及内参照GAPDH引物参照GenBank基因序列自行设计,由北京赛百盛基因有限公司合成。PTEN:上游引物5′- GGA AAG GAC GGA CTG GTG TA -3′,下游引物5′- TGC CAC TGG TCT GTA ATC CA -3′,扩增产物大小为101 bp;GAPDH:上游引物5′- GGC AAG TTC AAC GGC ACA G -3′,下游引物5′- CGC CAG TAG ACT CCA CGA CAT -3′,扩增产物大小为122 bp;Akt:上游引物5′- GAG GAG CGG GAA GAG TG -3′,下游引物5′- GAG ACA GGT GGA AGA AGA GC -3′,扩增产物大小为672 bp;ERK1:上游引物5′-TCA TAG GCA TCC GAG ACA TC-3′,下游引物5′-TGG TAG AGG AAG TAG CAG ATG-3′,扩增产物大小为148 bp。在ABI Prism 7700实时荧光定量PCR仪上进行实时定量扩增。SYBR反应体系25 μL。反应条件95 ℃ 10 min,1个循环;95 ℃ 15 s,60 ℃ 1 min,35个循环。采用相对定量2-ΔΔCt法比较目的基因mRNA的表达差异。
10统计学处理
结 果
1PTENshRNA抑制体外活化HSCs中PTEN的表达
腺病毒感染HSCs后72 h,应用实时定量RT-PCR检测PTEN mRNA的表达。以对照组PTEN基因的表达量为1,则Ad-EGFP组、PTEN shRNA组较对照组的PTEN mRNA的相对倍数分别为0.93倍和0.63倍,PTEN shRNA组PTEN mRNA表达明显低于对照组及Ad-EGFP组(P<0.05)。Western blotting检测PTEN蛋白在各组细胞中的表达,PTEN shRNA组(1.11±0.03)显著低于对照组(1.49±0.04)及Ad-EGFP组(1.48±0.02)(P<0.05),见图1。表明shRNA可显著抑制体外培养的活化HSCs中PTEN的表达。
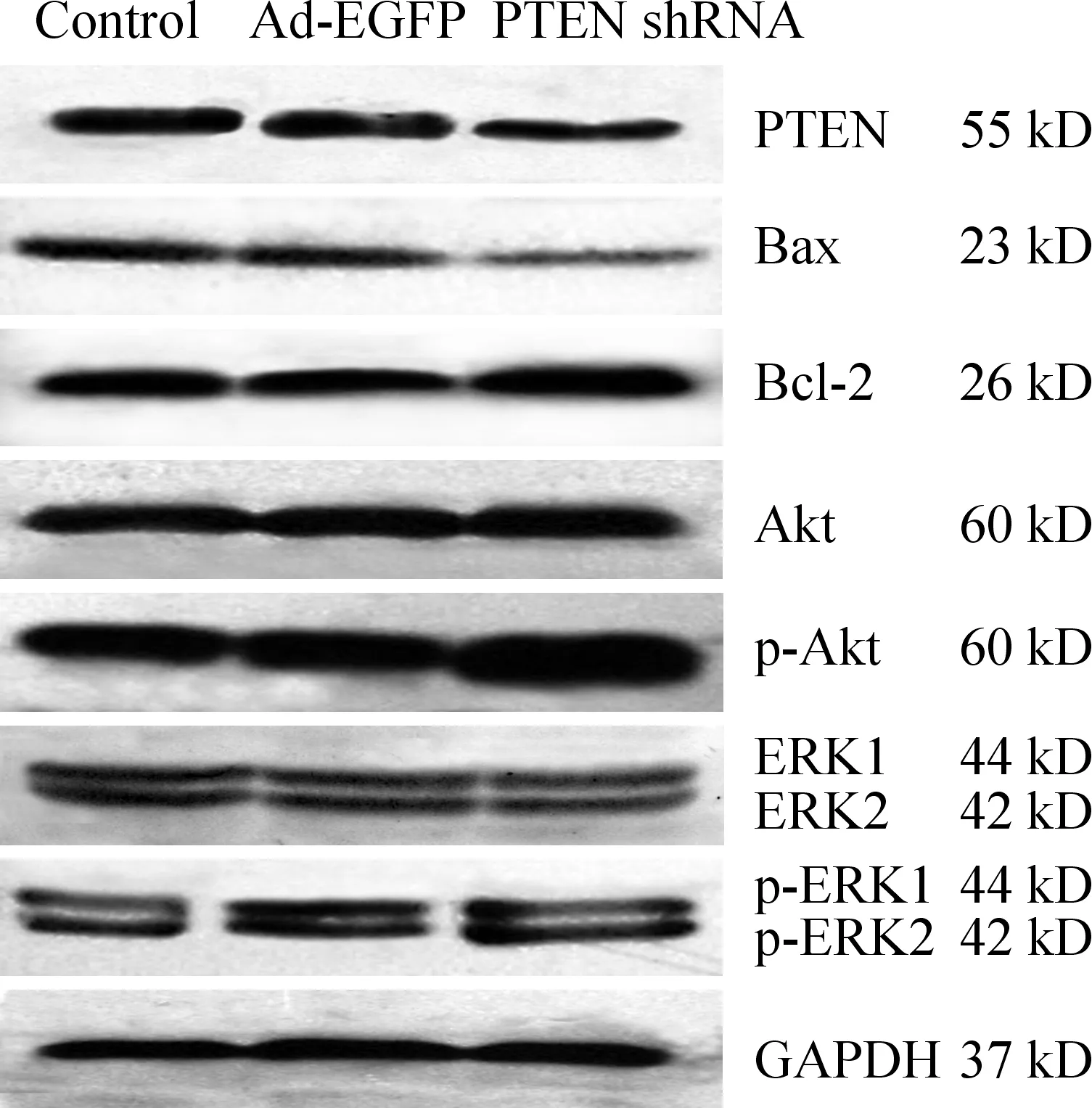
Figure 1. Western blotting analysis was used to detect PTEN,Bax, Bcl-2,Akt,p-Akt,ERK1,ERK2,p-ERK1 and p-ERK2 protein expression in HSCs in different groups.
图1Westernblotting检测各组HSCs中PTEN、Bax、Bcl-2、Akt、p-Akt、ERK1/2及p-ERK1/2蛋白表达
2PTENshRNA促进活化的HSCs增殖
在一定时间范围内,PTEN shRNA可呈时间依赖性地促进HSCs生长,增殖率于72 h达最高,较对照组升高22.5%;MTT检测结果显示,腺病毒感染活化HSCs后24 h,Ad-EGFP及PTEN shRNA对细胞增殖均无明显作用(P>0.05)。但在48 h、72 h时PTEN shRNA可显著刺激HSCs增殖,其增殖率分别为29.51%、43.29% (相对于对照组) (P<0.01),见图2、表1。
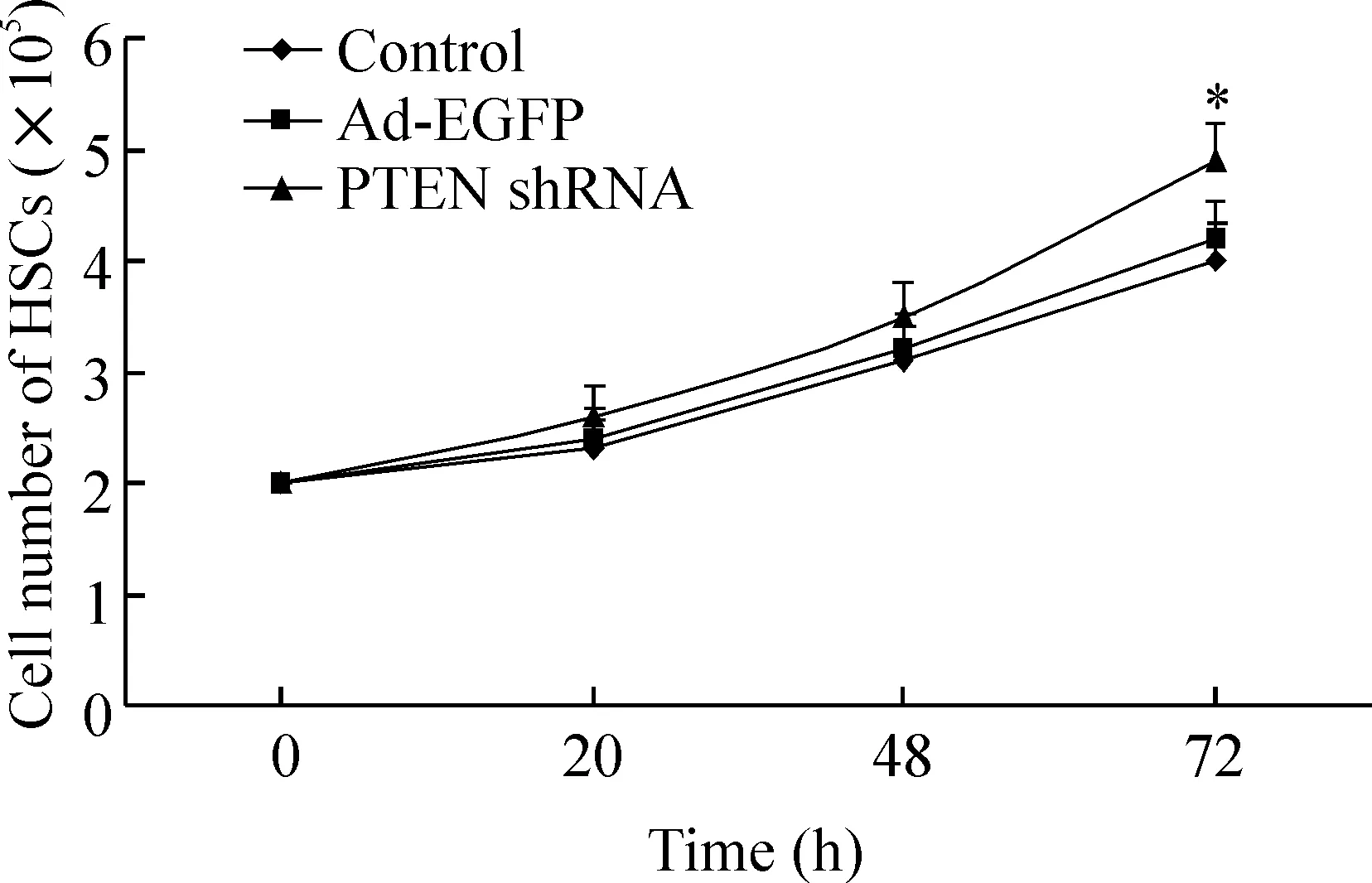

图2直接细胞计数法绘制的不同时点HSCs的生长曲线

表1 HSCs MTT结果
**P<0.01vscontrol and Ad-EGFP.
3PTENshRNA抑制活化的HSCs凋亡
TUNEL法检测结果显示,腺病毒感染HSCs后72 h,PTEN shRNA组HSCs凋亡率为2.94%±0.31%,低于对照组(5.17%±0.27%)及Ad-EGFP组(5.34%±0.43%)(P<0.05)。PI标记的流式细胞术检测结果显示,PTEN shRNA组HSCs凋亡率(1.26%±0.18%)低于对照组(3.28%±0.42%)及Ad-EGFP组(2.95%±0.41%) (P<0.05),这表明PTEN shRNA可抑制活化的HSCs凋亡,见图3、4。
4PTENshRNA对活化HSCsBax及Bcl-2表达的影响
Western blotting检测腺病毒感染HSCs 72 h Bax蛋白的表达结果显示,PTEN shRNA组(0.98±0.04)显著低于对照组(1.29±0.03)及Ad-EGFP组(1.30±0.04)(P<0.05);而对Bcl-2蛋白的检测结果显示,PTEN shRNA组(1.86±0.06)较对照组(1.48±0.04)及Ad-EGFP组(1.47±0.05)显著升高(P<0.05),对照组与Ad-EGFP组之间无显著差异(P>0.05),见图1。
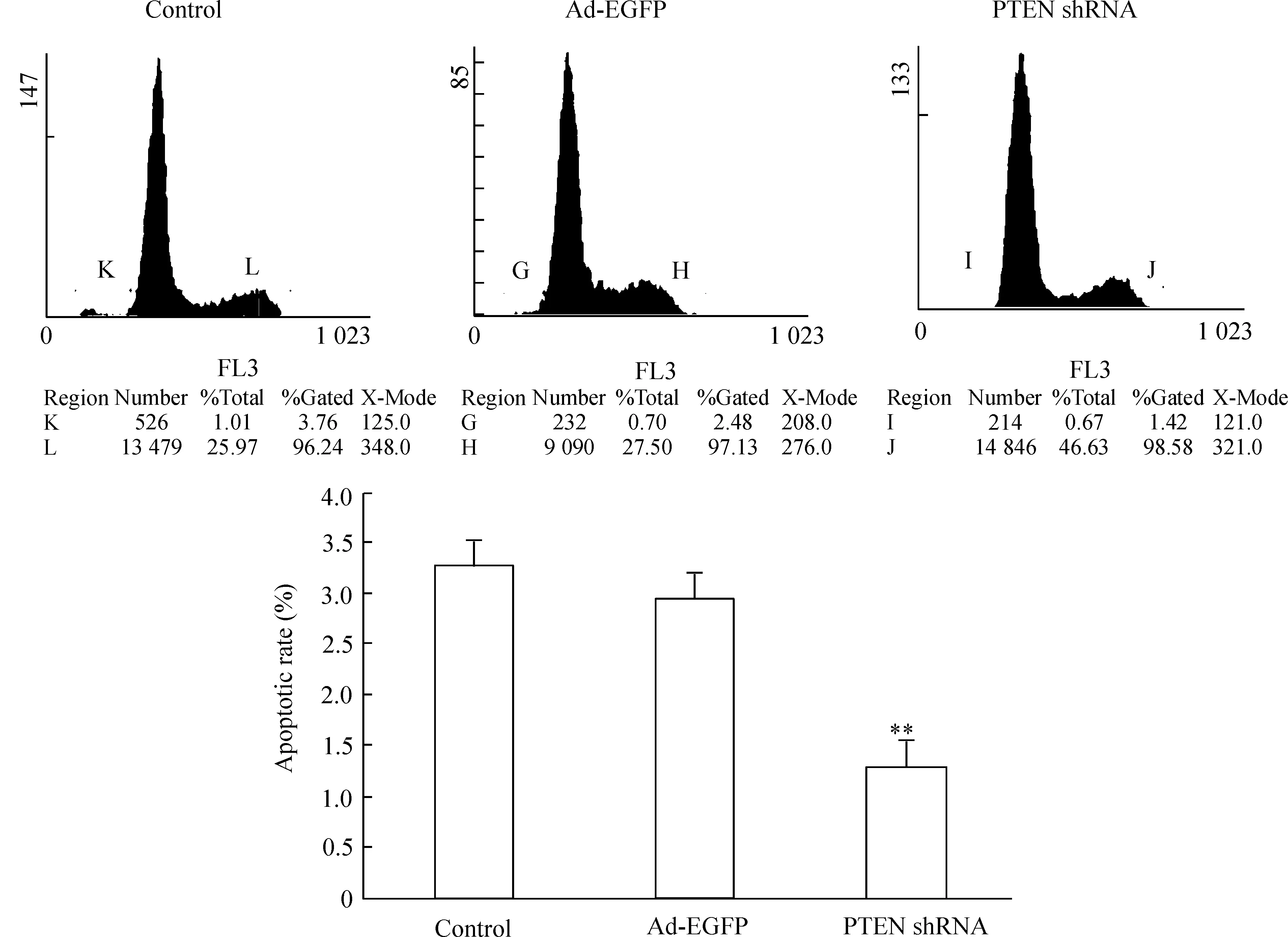

图3流式细胞术检测腺病毒感染肝星状细胞72h的凋亡率


图4TUNEL法检测腺病毒感染肝星状细胞72h的凋亡率
5PTENshRNA对HSCsAkt、p-Akt、ERK1/2、p-ERK1/2蛋白及AktmRNA和ERK1mRNA表达的影响
腺病毒感染HSCs 72 h,Western blotting检测各组HSCs的Akt和ERK1蛋白表达结果显示,Akt蛋白表达在对照组(1.05±0.02)、Ad-EGFP组(0.99±0.05)与PTEN shRNA组(1.03±0.02)间均无显著差异(P>0.05);ERK1蛋白表达在对照组(1.11±0.03)、Ad-EGFP组(1.15±0.04)及PTEN shRNA组(1.13±0.04)之间亦无显著差异(P>0.05);检测HSCs中p-Akt蛋白表达结果显示,PTEN shRNA组(1.59±0.03)显著高于对照组(1.21±0.03)及Ad-EGFP组(1.16±0.04) (P<0.05)。p-ERK1蛋白表达显示,PTEN shRNA组(1.20±0.02)显著高于对照组(0.73±0.05)和Ad-EGFP组(0.81±0.04) (P<0.05),见图1。实时荧光定量PCR检测HSCs中Akt及ERK1 mRNA表达,以对照组Akt及ERK1 mRNA的表达量为1,则Ad-EGFP组和PTEN shRNA组相对对照组的Akt mRNA表达倍数分别为0.94倍和1.05倍,Ad-EGFP组和PTEN shRNA组相对对照组的ERK1 mRNA表达倍数分别为0.99倍和1.04倍,表明两者在各组间均无显著差异(P>0.05)。
讨 论
PTEN蛋白是一种具有脂质磷酸酶和蛋白磷酸酶双重活性的特异性磷酸酶,可抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡。已有研究发现PTEN与肾纤维化[5]、肺纤维化、心肌纤维化[6]、肝纤维化[7]等多种纤维化疾病相关联。本实验构建了靶向PTEN的RNA干扰重组体,研究抑制PTEN表达后对HSCs细胞增殖及凋亡的影响。
Hettinger等[8]的研究结果表明,当抑制肿瘤细胞中PTEN表达时,可使肿瘤细胞的生存率提高,凋亡率减少。本实验在重组腺病毒成功感染HSCs的基础上,应用直接细胞计数法绘制生长曲线和MTT法测定了HSCs的增殖情况。其结果显示,PTEN shRNA可在一定范围内呈时间依赖性地促进HSCs增殖,与Hettinger等[8]的研究结果一致。
在肝损伤修复过程中,往往伴随着活化HSCs数量的减少,而细胞凋亡则是其主要机制[9],本实验采用流式细胞术检测HSCs凋亡,其结果显示:PTEN shRNA组凋亡率较对照组和Ad-EGFP组明显降低(P<0.05)。此外采用TUNEL法也显示:PTEN shRNA组HSCs凋亡率明显低于对照组及Ad-EGFP组(P<0.05)。这2种方法均表明下调PTEN表达后HSCs凋亡受到抑制。细胞凋亡受到多种细胞因子的调控,其中Bcl-2家族是最重要因子之一,Bcl-2具有抑制凋亡作用,而Bax是Bcl-2的显性抑制因子,可促进细胞凋亡[10]。本研究观察到,PTEN shRNA成功转染HSCs后,Bcl-2表达明显升高,Bax表达降低,Bcl-2/Bax比值升高,从而表明在下调PTEN表达后,HSCs凋亡受到抑制,生存期延长,这提示Bcl-2/Bax升高可能是低表达的PTEN诱导活化HSCs增殖的机制之一。
磷酸化和去磷酸化在细胞内信号级联放大系统中发挥着重要作用,而PTEN蛋白在酪氨酸和丝氨酸/苏氨酸蛋白激酶所介导的信号转导通路中发挥着重要作用。有研究表明PI3K/Akt和ERK1/2信号通路参与了活化HSCs增殖、凋亡及细胞周期的调控[11-12]。PTEN蛋白的脂质磷酸酶可以负性调控PI3K/Akt信号通路所介导的细胞生长,若PTEN失活,PI3K/Akt将持续活化,可导致细胞体积增大、分裂加速、凋亡阻滞[13]。而PTEN蛋白的蛋白磷酸酶活性可抑制ERK1/2上游的衔接蛋白Shc的磷酸化和Ras的活化,从而负性调控ERK1/2信号通路介导的细胞转化和细胞周期[14]。本研究进一步研究了下调PTEN表达后HSCs的信号转导情况,其结果显示,采用腺病毒介导的PTEN shRNA下调PTEN的表达后,活化HSCs的Akt、ERK1蛋白及其mRNA表达均无明显变化,但p-Akt和p-ERK1/2蛋白表达却明显增高,提示下调PTEN的表达后,脂质底物PIP3的去磷酸化可能受到了抑制,从而使HSCs的p-Akt表达明显升高,PI3K/Akt信号通路得以发挥其所介导的细胞生长作用,以及下调PTEN表达后可使HSCs中ERK1/2的磷酸化水平增加,这些均表明PTEN表达降低可能通过影响PI3K/Akt和ERK1/2信号通路而参与了对活化HSCs增殖和凋亡的调控。
本研究初步证实,下调PTEN表达后可激活活化HSCs中PI3K/Akt及ERK1/2信号通路,进而导致HSCs增殖加快及凋亡减少,这与我们的前期研究以及国外学者Takashima等[15]的研究结果相一致。已有研究表明,活化的Akt可以通过使Bcl-2家族成员之一的BAD的Ser136位点磷酸化,从而使Bcl-2表达增多而发挥抗凋亡作用[16],同时也能磷酸化Bax的Ser184位点使 Bax表达减少而抑制细胞凋亡[17]。由此可见,低表达的PTEN可能通过调节PI3K/Akt信号通路中Akt的磷酸化水平进而调节Bcl-2/Bax途径来发挥其抑制细胞凋亡的作用。然而,调控活化HSCs增殖和凋亡的细胞内信号转导机制有多种,各种信号转导通路之间彼此影响、相互作用,PI3K/Akt及ERK1/2信号通路仅可能是PTEN调控HSCs生理过程的信号转导机制之一。PTEN是否还通过其它信号转导机制来参与对HSCs增殖及凋亡的调节,还需要进一步的研究和探讨。
[1] Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis[J]. Annu Rev Pathol, 2011,6:425-456.
[2] Wang S, Cheng Z, Yang X, et al. Effect of wild type PTEN gene on proliferation and invasion of multiple myeloma[J]. Int J Hematol, 2010,92(1):83-94.
[3] Hao LS, Zhang XL, An JY, et al. PTEN expression is down-regulated in liver tissues of rats with hepatic fibrosis induced by biliary stenosis[J]. APMIS, 2009,117(9):681-691.
[4] 郝礼森, 张晓岚, 安君艳, 等. PTEN过表达及其突变对体外活化肝星状细胞凋亡的影响[J]. 中华消化杂志, 2009,29(8):529-533.
[5] 张 昆, 傅淑霞, 谭会斌, 等. IgA肾病PTEN表达及其对肾间质纤维化的影响[J]. 中国病理生理杂志, 2009,25(5):984-987.
[6] 王 利, 吕安林, 赵晓梅, 等. 心血管系统中PTEN基因的研究进展[J]. 中国病理生理杂志, 2010,26(7):1428-1432.
[7] 郝礼森, 张晓岚, 安君艳, 等. PTEN在肝纤维化大鼠肝组织中的动态表达[J]. 中国病理生理杂志, 2009,25(6):1137-1141.
[8] Hettinger K, Vikhanskaya F, Poh MK, et al. c-Jun promotes cellular survival by suppression of PTEN[J]. Cell Death Differ, 2007,14(2):218-229.
[9] Elsharkawy AM, Oakley F, Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis[J]. Apoptosis, 2005,10(5):927-939.
[10]Karamanolis DG, Kyrlagkitsis I, Konstantinou K, et al. The Bcl-2/Bax system and apoptosis in ulcerative colitis[J]. Hepatogastroenterology, 2007,54(76):1085-1088.
[11]Zhou Y, Jia X, Wang G, et al. PI-3 K/AKT and ERK signaling pathways mediate leptin-induced inhibition of PPARγ gene expression in primary rat hepatic stellate cells[J]. Mol Cell Biochem, 2009,325(1-2):131-139.
[12]Ming M, Han W, Maddox J, et al. UVB-induced ERK/AKT-dependent PTEN suppression promotes survival of epidermal keratinocytes[J]. Oncogene, 2010,29(4):492-502.
[13]Shim JH, Kim YS, Bahk YY. Proteome profile changes that are differentially regulated by lipid and protein phosphatase activities of tumor suppressor PTEN in PTEN-expressing U-87 MG human glioblastoma cells[J]. Proteomics, 2006,6(1):81-93.
[14]Leslie NR, Maccario H, Spinelli L, et al. The significance of PTEN′s protein phosphatase activity[J]. Adv Enzyme Regul, 2009,49(1):190-196.
[15]Takashima M, Parsons CJ, Ikejima K, et al. The tumor suppressor protein PTEN inhibits rat hepatic stellate cell activation[J]. J Gastroenterol, 2009,44(8):847-855.
[16]Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005,9(1):59-71.
[17]Xin M, Deng X. Nicotine inactivation of the proapoptotic function of Bax through phosphorylation[J]. J Biol Chem, 2005,280(11):10781-10789.
Effectsofadenovirus-mediatedshRNAtargetingPTENonproliferationandapoptosisofactivatedhepaticstellatecellsinvitro
GUO Jian1, LIU Xiao-juan1, ZHANG Guo-zun1, SUN Hui-cong1, LIU Lin-li2, GUO Jin-bo1, LIU Lei1, YAO Dong-mei1, SONG Mei1, ZHANG Xiao-lan1
(1DepartmentofGastroenterology,2DepartmentofCardiacSurgery,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China.E-mail:xiaolanzh@126.com)
AIM: To investigate the down-regulation of phosphatase and tensin homolog deleted on chromosome 10 (PTEN) gene by adenovirus-mediated short hairpin RNA (shRNA) on proliferation and apoptosis of activated hepatic stellate cells (HSCs)invitroand the related signaling transduction pathways.METHODSThe activated HSCs were culturedinvitroand transfected with recombinant adenovirus expressing shRNA targetingPTEN. The proliferation of HSCs was measured by MTT assay and the apoptosis was assessed by TUNEL and flow cytometry. Western blotting was used to detect the protein levels of PTEN, Bax, Bcl-2, Akt, p-Akt, ERK1/2 and p-ERK1/2 in HSCs, and real-time fluorescent quantitative PCR was applied to detect the mRNA expression of Akt and ERK1.RESULTSThe recombinant adenovirus expressing shRNA targetingPTENwas successfully transfected into activated HSCsinvitro, and significantly promoted the proliferation of HSCs in a time-dependent manner within a certain extent. The apoptotic rate of HSCs was significantly decreased 72 h after transfection (P<0.05). Meanwhile, reduced expression of Bax and elevated expression of Bcl-2 were induced 72 h after transfection (P<0.05). Furthermore, the expression of p-Akt and p-ERK1/2 were increased significantly (P<0.05), while no significant difference in the expression of Akt and ERK1 at mRNA and protein levels was observed (P>0.05).CONCLUSIONDown-regulation ofPTENby adenovirus-mediated shRNA dramatically promotes the proliferation of activated HSCs, and inhibits the apoptosis through Bcl-2/Bax pathway. In addition, the phosphorylation of Akt and ERK1/2 is increased, indicating that PI3K/Akt and ERK1/2 signal transduction pathways may play an important role in the regulation of proliferation and apoptosis of HSCs.
Hepatic stellate cells; Phosphatase and tensin homolog deleted on chromosome 10; RNA interference; Cell proliferation; Apoptosis
R363
A
10.3969/j.issn.1000-4718.2012.09.016
