地肤地上部水浸提液对胡麻的化感机理研究
2012-11-06党占海梁建斌牛俊义
赵 利, 党占海, 梁建斌, 牛俊义
(1.甘肃省农业科学院作物研究所,甘肃兰州 730070; 2. 甘肃农业大学,甘肃兰州 730070)
赵 利,党占海,梁建斌,等. 地肤地上部水浸提液对胡麻的化感机理研究[J]. 杂草科学,2012,30(1):17-21.
地肤地上部水浸提液对胡麻的化感机理研究
赵 利1, 党占海1, 梁建斌2, 牛俊义2
(1.甘肃省农业科学院作物研究所,甘肃兰州 730070; 2. 甘肃农业大学,甘肃兰州 730070)
为了探明地肤地上部水浸提液对胡麻的化感机理,以盆栽试验结合实验室分析,研究了不同浓度的地肤地上部水浸提液对胡麻抗氧化性酶——超氧化物歧化酶(SOD)、过氧化物酶(POD)活性及脂质过氧化产物——丙二醛(MDA)含量的影响。结果表明,在不同浓度地肤地上部水浸提液胁迫下,胡麻的SOD、POD活性均随着胁迫时间的延长呈先升高后降低的趋势,MDA含量呈平稳上升趋势;在同一处理时间段,随着处理浓度的升高,SOD、POD活性促进(抑制)率变大,MDA含量增大。表明地肤地上部水浸提液化感物质对胡麻保护性酶活性和膜脂过氧化作用有重要影响。
地肤; 水浸提液; 化感作用; 机理
化感作用(allelopathy)是自然界中的一种普遍现象。化感作用有正向和负向两种,即所谓的促进作用和抑制作用。目前人们利用化感作用在筛选能够抑草的作物品种、建立合理的耕作制度、合理管理植物残株,开发杀虫剂、杀菌剂、除草剂和植被群落演替等方面均取得了一定的成效[1-6]。植物化感物质可影响植物的激素代谢、酶活性、光合作用、呼吸作用、水分及矿物质吸收和利用等方面[7-12]。关于化感物质对植物体内保护性酶活性的影响,目前国内外进行了许多研究[13-17],但关于杂草对胡麻的化感作用机理研究国内外未见报道。以往的研究表明[18],地肤(Kochiascoparia(L.) Schrad.)为胡麻田间第一大优势伴生杂草,而地肤不同部位水浸提液对胡麻的化感作用以地上部的作用最强。因此,本研究拟通过地肤地上部水浸提液处理盛花期胡麻,研究其对胡麻抗氧化性酶-超氧化物歧化酶(SOD)、过氧化物酶(POD)活性及脂质过氧化产物—丙二醛(MDA)含量的影响,从而揭示地肤化感物质对胡麻的作用机理。
1 材料与方法
1.1 试验方法
准确称取40 g地肤地上部材料,剪成2 mm小段,加10倍的蒸馏水于20℃培养箱中浸提24 h,浸提液抽滤过滤。用上述抽滤液配制成0.1、0.05和0.025g/mL溶液,每种浓度浇灌300 mL于受体胡麻植株上,3次重复。处理后于24、36、48、60、72 h分别采样,用于SOD、POD活性测定及MDA含量测定。
1.2 酶活性的测定方法
1.2.1 超氧化物歧化酶(SOD)的活性测定 参照邹琦[19]等的方法,用淡蓝四唑(NBT)还原法。
1.2.2 过氧化物酶(POD)活性测定 参照李合生[20]等的方法,用愈创木酚法。
1.2.3 脂质过氧化产物丙二醛(MDA)含量测定 参照邹琦[19]等的方法,用硫代巴比妥酸(TBA)法。
1.3 酶活性抑制率计算
参照Williamson[21]等的方法,RI=(Ti-T0)/T0×100 %,Ti为处理值,T0为对照值。RI≥0 表示具有促进作用,RI<0 表示具有抑制作用。
1.4 试验数据的统计分析
所有试验数据均用EXCEL和DPS 7.05统计。
2 结果与分析
2.1 超氧化物歧化酶(SOD)活性变化
总体来说,从时间效应来看,在3种浓度的地肤地上部水浸提液胁迫下,胡麻SOD的活性均随着胁迫时间的延长呈先升高后降低的趋势。从浓度效应来看,胁迫24~36 h,随着处理浓度的增大,SOD活性逐渐减小。胁迫48~60 h,随着处理浓度的增大,SOD活性逐渐增大。胁迫72 h,SOD活性接近CK水平(表1)。
其中,胁迫24~36 h,0.1 g/mL和0.05 g/mL处理的SOD活性瞬间受到抑制,且随着胁迫浓度的增大,SOD酶活性下降,酶活抑制率变大。这可能是过多的自由基积累,破坏了保护酶的保护作用。此时,这2种浓度下的SOD活性与CK和0.025 g/mL处理下的差异均达显著水平。胁迫48 h后,SOD活性迅速增大,变为促进作用,且随着胁迫浓度的增大,酶活性增大,促进作用增强,至48 h达最大。说明胡麻植株通过提升SOD酶活力来抵御地肤化感物质对其产生的胁迫,此时,3种不同浓度(由大到小)处理下的SOD活性分别比对照上升20.67%、19.78%和11.20%,均与CK间差异达极显著水平。胁迫60 h时SOD活性开始下降,此时只有0.1 g/mL处理与CK及其余2种浓度间差异达极显著水平。胁迫72 h时SOD活性接近CK水平,可能是由于地肤水浸提液的胁迫程度超过了其耐受范围。此时,3种不同浓度处理下的SOD活性之间及其与CK间差异均不显著。

表1 3种浓度地肤地上部水浸提液对胡麻SOD活性的影响
注:同列中相同大写字母表示在P≥0.01时差异不显著,小写字母表示在P≥0.05 时差异不显著;下同。
2.2 过氧化物酶(POD)活性变化
从表2可以看出,从时间效应来看,在3种浓度地肤地上部水浸提液的胁迫下,胡麻植株POD活性呈先上升后下降趋势,但无论是上升还是下降,POD活性均大于对照,说明在地肤地上部水浸提液的胁迫下,胡麻的抗逆适应性增强了。从浓度效应来看,胁迫24~72 h,在同一处理时间段,随着处理浓度的增大,POD活性逐渐增大,POD活性的促进作用也增大。
在胁迫24~36 h时,3种浓度处理下的POD活性均与CK间差异不显著。胁迫48~72 h,只有0.1 g/mL处理和60 h时0.05 g/mL处理与CK间差异达显著水平,其余处理均与CK间差异不显著。而且POD活性的高峰也是出现在胁迫后48 h,与SOD 活性变化高峰相同。此时,3种浓度(由大到小)POD活性分别比CK提高81.01%、63.04%和53.37%,说明POD和SOD共同组成植物体内的活性氧清除系统,二者共同作用能有效清除植物体内的自由基和过氧化物,使活性氧维持在较低水平。

表2 3种浓度地肤地上部水浸提液对胡麻植株POD活性的影响
2.3 丙二醛(MDA)含量的变化
从时间效应来看,胡麻MDA含量随着不同浓度地肤地上部水浸提液胁迫时间的延长呈平稳上升趋势。胁迫24 h 时,3种浓度(由高到低)MDA的含量分别比对照提高8.18%、6.82%和5.91%。胁迫72 h时,3种浓度处理下的MDA含量分别比对照提高22.73%、23.64%和20.45%。MDA含量逐渐提高,表明地肤水浸提液使胡麻体内活性氧产生积累,诱发了膜脂的过氧化。
从浓度效应来看,在同一处理时间段,3种浓度处理下,随着处理浓度的升高,MDA含量增大,表明在地肤地上部水浸提液胁迫24~72 h间,随着胁迫时间的延长,对胡麻生长的影响越大(表3)。
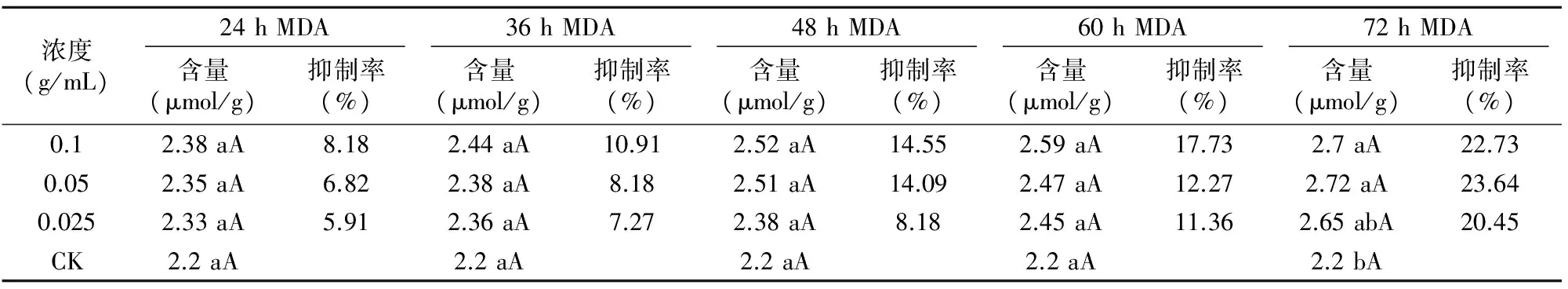
表3 3种浓度地肤地上部水浸提液对胡麻叶片MDA含量的影响
3 讨论
已有的研究表明,植物体内有氧代谢不断在叶绿体、线粒体、过氧化物酶体中产生活性氧(ROS)[22],正常情况下ROS水平由诸多的抗氧化剂(主要有POD、CAT、SOD等)控制在一定范围内,使其既适应代谢调节的需要又不致造成损伤[23]。而逆境胁迫可破坏活性氧产生与清除之间的平衡,导致植物体内活性氧的积累,蛋白质、脂类和核酸氧化破坏,造成植物体的伤害。同时,植物在逆境胁迫过程中会产生过剩的自由基,其毒害之一就是引发或加剧膜脂过氧化作用。丙二醛(MDA)是膜脂过氧化的最终产物,其含量与膜脂过氧化程度呈正相关[24]。而植物在向环境释放化感物质的时候,化感物质通过抑制植物体内对自由基有重要猝灭作用的SOD和POD等的活性,破坏细胞内自由基的产生和消除之间的平衡,氧化分解膜脂中不饱和脂肪酸的双键,引起膜的过氧化作用,膜脂过氧化产物MDA的含量增加[25-26]。
本研究表明,在地肤水浸提液胁迫下,受体胡麻叶片中SOD、POD 活性呈先升后降趋势,MDA含量持续增加。说明地肤地上部水浸提液在胁迫胡麻的过程中,释放化感物质到环境中,诱发胡麻体内活性氧代谢系统失调,产生积累,这种氧化胁迫诱导了胡麻体内抗氧化能力的增强,此时胡麻通过提高SOD和POD活性清除活性氧,使其维持在较低水平。因此在胁迫前期,抗氧化酶SOD、POD活性上升,但这种适应性反应只能在一定程度内发挥作用,当胁迫进一步加大时,胡麻体内氧化产物累积到一定程度时,即化感物质所提供的逆境已超过SOD、POD的调节能力,达到对保护酶构成伤害的程度,SOD和POD不能全面有效清除活性氧而造成积累,酶活性下降,膜脂过氧化作用加强[27],从而引起SOD、POD随着胁迫时间的延长,呈现先上升后下降趋势,而MDA含量呈持续增加趋势。可见,使受体活性氧代谢失调导致膜结构和功能破坏是胡麻化感作用的一种重要方式。本研究结果与王硕等、侯永霞等、宋亮等的研究结果一致[28-29]。
Yu等[30]认为,化感物质会对SOD、POD活性及MDA含量产生一定的影响,浓度及不同物质的互作关系可影响这些指标的活性。本研究表明,地肤地上部水浸提液对胡麻植株的SOD、POD活性及MDA含量均产生一定的影响,而且存在时间效应和浓度效应,更进一步证实了Yu等的结论。
4 结论
4.1 过氧化物歧化酶活性
在不同浓度地肤地上部水浸提液胁迫下,胡麻SOD的活性均随着胁迫时间的延长呈先升高后降低的趋势,在同一处理时间段,随着处理浓度的升高,SOD活性促进(抑制)率变大。
4.2 过氧化物酶活性
在不同浓度地肤地上部水浸提液的胁迫下,胡麻植株POD活性呈先上升后下降趋势,活性高峰出现在胁迫后48 h。且POD活性均大于对照。在同一处理时间段,随着处理浓度的升高,POD活性增大,POD活性的促进作用也增大。
4.3 丙二醛含量
胡麻MDA含量随着地肤地上部水浸提液胁迫时间的延长呈平稳上升趋势。在同一处理时间段,在3种浓度处理下,随着处理浓度的升高,MDA含量增大,MDA的促进作用增大。
[1]吕福堂,段玉梅. 化感作用在生产中的应用[J]. 生物学通报,2000,40(2):22-23.
[2]赵 静,曾强. 植物化感作用的研究对持续性农业建设的意义[J]. 农业环境与发展,1996,13(3):10-13.
[3]Rice E L. Biological control of weeds and plant diseases:Advances in applied allelopathy[M]. Oklahoma:University of Oklahoma Press,1995.
[4]孙文浩,俞子文,余叔文. 水葫芦对藻类的克制效应[J]. 植物生理学报,1988,14(3):294-300.
[5]孙文浩,俞子文,余叔文. 城市富营养化水域的生物治理和凤眼莲抑制藻类生长的机理[J]. 环境科学学报,1989,9(2):188-195.
[6]孙文浩,俞子文. 凤眼莲克藻化合物的生物检测[J]. 植物生理学通讯,1991,7(6):43-436.
[7]Politycka B. Peroxidase activity and lidid peroxidation in roots of cucumber seedlings influenced by derivatives of cinnamic and benzoic acids[J]. Acta Physiologiae Plantarum,1996,18(4):365-370.
[8]Leather G R,Einhellig F A. Bioassays in the study of allelopathy[M]//Putnam A R,Tang C S.The Science of Allelopathy.New York:John Wiley and Sons,1986:133-145.
[9]Einhellig E A. Mechanism of action of allelochemicals in allelopathy[J].Allelopathy,1995,10(1):97-115.
[10]Baziramakenga R,Leroux G D,Simard R R,et a1. Allelopathic effects of phenolic acids on nucleic acid and protein levels in soybean seedlings[J]. Canadian Journal of Botany,1997,75(3):445-450.
[11]Barkosky R R,Einhellig F A. Effects of salicylic acid on plant-water relationships[J]. Chemical Ecology,1993,19:237-247.
[12]吕卫光,张春兰,袁 飞,等. 化感物质抑制连作黄瓜生长的作用机制[J]. 中国农业科学,2002,35(1):106-109.
[13]邓日烈,吴文花,聂呈荣,等. 化感植物对受黄曲霉侵染花生植株保护酶活性的影响[J]. 花生学报,2008,37(2):18-21.
[14]王 硕,慕小倩,杨 超. 黄花蒿浸提液对小麦幼苗的化感作用及其机理研究[J]. 西北农林科技大学学报,2006,6(34):106-108.
[15]郭鸿儒,沈慧敏,杨顺义,等. 黄花蒿化感物质对受体燕麦化感作用机理的初步研究[J]. 甘肃农业大学学报,2008,43(l):102-104.
[16]陈丽萍,范雪涛,马丹炜. 入侵植物辣子草对油菜幼苗抗氧化系统的化感效应[J]. 西南农业学报,2008,21(2):332-334.
[17]耿广东,张素勤,程智慧. 香草醛对莴苣的化感作用及其作用机制[J]. 西北农业学报,2009,18(3):209-212.
[18]赵 利,牛俊义,李长江,等. 地肤水浸提液对胡麻的化感效应研究[J]. 草业学报,2010,19(2):190-195.
[19]邹 奇. 植物生理学指导 [M]. 北京:中国农业出版社,2000.
[20]李合生. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2000.
[21]Williamson G,Richardson D.Bioassay for allelopathy:Measuring treatment response with independent controls[J].Journal of Chemical Ecology,1988,14:181-188.
[22]Selote D S,Khanna-Chopra R. Drought acclimation confers oxidative stress tolerance by inducing coordinated antioxidant defense at cellular and subcellular level in leaves of wheat seedlings[J]. Physiologia Plantarum,2006,127:494-506.
[23]Kendall E J,Mckersie B D. Free radicals and freezing injury to cell membranes of winter wheat[J]. Physiol Plant,1989,76:86-94.
[24]Corbineau F,Gay-Mathieu C,Vinel D. Decrease in sunflower seed viability caused by high temperatures as related to energymetabolism,membrane damage and lipid composition [J]. Physio Plant,2002,116:489-496.
[25]邓国富,李扬瑞. 水稻的化感作用研究进展及展望[J]. 西南农业学报,2006,19(5):962-965.
[26]Oueslati. Allelopathy in two durum wheat(TriticumdurumL.) varieties[J]. Agriculture Ecosystems and Environment,2003,96:161-163.
[27]Roshehina V V,Roshchina V D. The excretory function of higher plant[J]. New York:Spinger-Verlag,1993,213-215.
[28]侯永霞,周宝利,吴晓玲,等. 辣椒秸秆腐解物化感作用的研究[J]. 应用生态学报,2006,17(4):699-700.
[29]宋 亮,潘开文,王进闯,等. 酚酸类物质对苜蓿种子萌发及抗氧化物酶活性的影响[J]. 生态学报,2006,26(10):3393-3403.
[30]Yu J Q,Ye S F,Zhang M F,et a1. Effects of root exudates and aqueous root extracts of cucumber(Cucumissativus)and allelochemicals,on photosynthesis and antioxidant enzymes in cucumber[J]. Biochemical Systematics and Ecology,2003,31:129-139.
StudyonAllelopathicMechanismofStemandLeafExtractsofKochiascoparia(L.)Schrad.onOilFlax
ZHAO Li1, DANG Zhan-hai1, LIANG Jian-bin2, NIU Jun-yi2
(1. Crop Research Institute,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China; 2. College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China)
In order to explore the allelopathic mechanism ofK.scopariaon oil flax,effects of different concentrations of stem and leaf aqueous extract ofK.scopariaon antioxidant enzymes(SOD,POD)activity and lipid peroxidation products MDA content of oil flax were tested via pot experiment and laboratory analysis. The results showed that under the stress with different concentration of stem and leaf aqueous extract ofK.scoparia,SOD and POD activity of oil flax were increased firstly,then decreased as the stress period prolonged,while the MDA content in oil flax was steadily increased. At the same stressed period,the inhibition rate of SOD and POD activity was increased respectively,and MDA content increased as the extracts concentration increased. This results showed that the allelochemicals released from stem and leaf ofK.scopariahad important role to effect protective enzyme activity and membrane liquid peroxidation of oil flax.
K.scoparia; aqueous extracts; allelopathic; mechanism
Q948.1
A
1003-935X(2012)01-0017-05
2011-12-22
现代农业产业技术体系建设专项基金(编号:CARS-17)。
赵 利(1973—),女,陕西武功人,博士,副研究员。 E-mail:zhy1972@yahoo.com.cn。
牛俊义。E-mail:niujy@gasu.edu.cn。
