缺氧对胰腺癌PANC1细胞增殖、凋亡及迁移的影响
2012-11-06朱亮徐胜南庞慧芳赵慧贞覃华黎培员李德民赵秋
朱亮 徐胜南 庞慧芳 赵慧贞 覃华 黎培员 李德民 赵秋
·论著·
缺氧对胰腺癌PANC1细胞增殖、凋亡及迁移的影响
朱亮 徐胜南 庞慧芳 赵慧贞 覃华 黎培员 李德民 赵秋
目的探讨氯化钴(CoCl2)模拟缺氧对人胰腺癌细胞株PANC1增殖、凋亡和迁移的影响。方法分别用终浓度为0(对照)、100、200、400、800 μmol/L CoCl2处理PANC1细胞24 h,采用实时定量PCR、蛋白质印迹法分别检测细胞缺氧诱导因子(HIF)-1α、血管内皮生长因子(VEGF) mRNA及蛋白的表达,采用CCK-8法检测细胞增殖,流式细胞术检测细胞凋亡,细胞划痕试验检测细胞迁移能力。结果对照组及100、200、400、800 μmol/L CoCl2处理组HIF-1α mRNA表达量分别为 1、1.08±0.12、1.12±0.09、1.04±0.11、0.66±0.07;VEGF mRNA表达量分别为1、2.69±0.35、4.81±0.54、2.19±0.21、0.79±0.08;HIF-1α蛋白表达量为0.23±0.03、0.36±0.04、1.15±0.11、1.08±0.09、0.44±0.04;VEGF蛋白表达量为0.14±0.02、0.12±0.01、0.95±0.09、0.87±0.09、0.55±0.06;细胞存活率分别为100%、(98.43±2.88)%、(76.15±0.70)%、(53.87±0.77)%、(35.23±0.67)%;细胞凋亡率分别为(5.2±1.12)%、(5.74±1.07)%、(6.82±1.85)%、(12.09±3.53)%、(31.88±6.95)%;细胞爬行距离分别为(43.24±3.67)%、(59.46±5.39)%、(80.56±8.05)%、(63.89±5.96)%、(9.09±1.59)%。与对照组相比较,处理组细胞VEGF mRNA、VEGF及HIF-1α蛋白表达、细胞爬行距离均呈先上升后下降的趋势(P<0.05),HIF-1α mRNA 表达、细胞增殖率呈剂量依赖性降低,细胞凋亡率呈剂量依赖性升高。结论CoCl2达到一定浓度时可显著抑制PANC1细胞增殖,促进细胞凋亡;CoCl2对PANC1细胞迁移效应的双向作用与高浓度CoCl2对细胞直接损伤有关。
胰腺肿瘤; 缺氧; 氯化钴; 细胞增殖; 细胞凋亡; 细胞运动
研究表明,大多数实体瘤内部微环境处于缺氧状态,且这种缺氧环境是促进肿瘤转移的重要因素之一。氯化钴(CoCl2)是一种化学制剂,由于其特殊的化学性能,常用于体外诱导化学缺氧,并在细胞增殖、迁移、应激反应等研究中广泛应用。本研究通过CoCl2体外化学反应模拟缺氧环境,观察其对人胰腺癌细胞系PANC1增殖、凋亡及迁移的影响。
材料与方法
一、细胞培养及分组
人胰腺癌细胞系PANC1由本院肝病研究所保存。解冻后置含10%胎牛血清的RPMI-1640培养基中常规培养、传代。分别应用终浓度为0(对照)、100、200、400、800 μmol/L的CoCl2(美国Sigma公司)干预细胞24 h。
二、mRNA表达检测
取上述分组培养的细胞,采用Trizol(Invitrogen公司)提取细胞总RNA,逆转录为cDNA,实时定量PCR扩增。引物序列:细胞缺氧诱导因子(HIF)-1α上游5′-TGAAGTGTACCCTAACTAGCCG-3′,下游5′-TTCACAAATCAGCACCAAGC-3′,扩增片段164 bp;VEGF上游5′-AACCATGAACTTTCTGCTGTCTTG-3′,下游5′-TTCACCACTTCGTGATGATTCTG-3′, 扩增片段129 bp;内参β-actin上游5′-GTTGCGTTACACCCTTTCTTG-3′,下游5′-GACTGCTGTCACCTTCACCGT-3′,扩增片段157 bp。PCR反应条件:95℃ 60 s, 95℃ 15 s、60℃ 30 s, 40个循环。mRNA相对表达量用2-ΔΔCt计算,ΔCt=Ct处理组-Ct对照组。以对照组mRNA表达量为1。
三、蛋白表达检测
取上述分组培养的细胞,采用RIPA蛋白裂解液裂解,提取细胞总蛋白,Bradford法测定蛋白浓度。常规行蛋白质印迹法。兔抗人HIF-1α、VEGF、β-actin多抗分别购自美国Santa Cruz公司、武汉博士德公司、美国Proteintech公司,工作浓度分别为1∶400、1∶400、1∶1000,最后ECL发光。用BioDoc-It 220凝胶成像系统(美国UVP公司)以及ImageJ分析软件对图像条带作半定量分析。
四、细胞增殖检测
取对数生长期PANC1细胞,按每孔1×104个细胞接种于96孔培养板,待细胞生长至60%融合度时分成上述各组培养24 h,每孔加入10 μl CCK-8(日本Dojindo公司),避光培养2 h。每个浓度设5个复孔。在酶标仪上测定450 nm波长的吸光度(A450值),以对照组细胞存活率为100%,细胞存活率=实验组A450值/对照组A450值×100%。
五、细胞凋亡检测
取上述各组培养的细胞,PBS洗2次后用培养液制备单细胞悬液。收集5×105个细胞,按照Annexin V-FITC凋亡检测试剂盒(南京凯基公司)说明书操作,上流式细胞仪检测细胞凋亡。
六、细胞迁移试验
取对数生长期PANC1细胞接种于6孔培养板,待细胞长满孔板时,取黄色枪头(200 μl)尖垂直板底制造人工划痕,记录初始划痕距离。PBS洗2遍后加入无血清培养基,并分成上述各组培养24 h,记录划痕距离。细胞爬行距离=细胞爬行距离/初始划痕距离×100%。
七、统计学方法
结 果
一、PANC1细胞HIF-1α、VEGF mRNA表达的变化
对照组及100、200、400、800 μmol/L CoCl2处理组HIF-1α mRNA相对表达量分别为1、1.08±0.12、1.12±0.09、1.04±0.11、0.66±0.07,800 μmol/L组细胞HIF-1α mRNA表达较对照组显著降低(F=70.776,P<0.05),其他各组表达无显著改变;VEGF mRNA相对表达量分别为1、2.69±0.35、4.81±0.54、2.19±0.21、0.79±0.08,100、200、400 μmol/L组均较对照组显著升高(F=20.280、195.323、240.833,P值均<0.05),其中200 μmol/L组达峰值,800 μmol/L组恢复到正常水平,呈先上升后下降趋势。
二、PANC1细胞HIF-1α、VEGF蛋白表达的变化
对照组及100、200、400、800 μmol/L CoCl2处理组HIF-1α蛋白相对表达量分别为0.23±0.03、0.36±0.04、1.15±0.11、1.08±0.09、0.44±0.04;VEGF蛋白表达量分别为0.14±0.02、0.12±0.01、0.95±0.09、0.87±0.09、0.55±0.06(图1)。≥200 μmol/L各组均较对照组显著升高(F=195.323、240.833、52.920;231.565、188.082、126.075;P值均<0.05),其中200 μmol/L组达峰值,呈先上升后下降趋势。
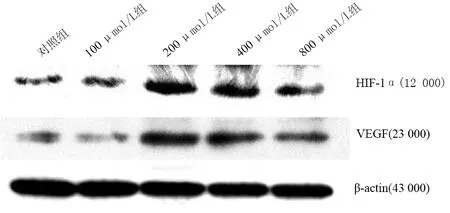
图1 各组PANC1细胞HIF-1α 、VEGF蛋白的表达
三、PANC1细胞增殖的变化
对照组及100、200、400、800 μmol/L CoCl2处理组细胞存活率分别为100%、(98.43±2.88)%、(76.15±0.70)% 、(53.87±0.77)%、(35.23±0.67)%,呈浓度依赖性抑制细胞增殖。≥200 μmol/L各组较对照组显著下降(F=3454.390、89391.356、38591.953,P值均<0.05)。且各组间存活率差异均具有统计学意义(F=2607.256、2628.763,P值均<0.01)。
四、PANC1细胞凋亡的变化
对照组及100、200、400、800 μmol/L CoCl2处理组细胞凋亡率分别为(5.2±1.12)%、(5.74±1.07)%、(6.82±1.85)%、(12.09±3.53)%、(31.88±6.95)%(图2)。400、800 μmol/L组细胞凋亡率较对照组显著升高(F=10.384,43.091,P值均<0.05), 400 μmol/L组以早期凋亡为主,800 μmol/L组以晚期凋亡为主。

图2 各组PANC1细胞的凋亡
五、PANC1细胞迁移的变化
对照组及100、200、400、800 μmol/L CoCl2处理组细胞爬行距离分别为(43.24±3.67)%、(59.46±5.39)%、(80.56±8.05)%、(63.89±5.96)%、(9.09±1.59)%(图3)。100、200、400 μmol/L组均较对照组显著增加(F=18.562、53.383、26.113,P值均<0.05),其中200 μmol/L组达峰值,而800 μmol/L组较对照组显著减少(F=218.708,P<0.05),呈先上升后下降趋势。

图3 各组PANC1细胞迁移的变化
讨 论
在实体肿瘤中,由于肿瘤细胞生长失控、新生血管结构紊乱、供给血管和肿瘤生长不相适应,肿瘤内部往往处于缺血缺氧状态,进而导致肿瘤对化疗和放疗抵抗[1]。另一方面,肿瘤可通过一系列生物学活性变化在缺氧环境下生存,其中缺氧诱导因子HIF-1α的激活是维持肿瘤细胞存活的重要因素之一。HIF-1α可通过调控多种靶基因如VEGF、葡萄糖转运子(GLUT) 等表达促进新生血管生成,调控肿瘤能量代谢以逃避或适应相对低氧环境,促进肿瘤生长、浸润和转移[2]。
使用CoCl2模拟缺氧是各种实验性缺氧培养研究中经常使用的方法。Co2+是铁螯合酶的底物,可替代氧感受器血红素中的Fe2+,阻断氧感受器与氧结合,从而模拟缺氧状态。本研究结果显示,在CoCl2模拟的轻度缺氧模型下(≤200 μmol/L),HIF-1α mRNA表达未见显著升高,而HIF-1α蛋白及其靶基因VEGF表达水平升高,提示缺氧诱导的HIF-1表达主要在转录后水平,这与Guo等[3]在神经元中的研究结果一致。但在较高CoCl2浓度水平(800 μmol/L)时,HIF-1α mRNA及蛋白表达水平均显著下降,这可能与高浓度CoCl2对细胞直接损伤效应有关,这种损伤效用可能与其所诱发的丝裂原激活的蛋白激酶(MAPK)的活化有关[4]。
目前研究表明,HIF-1α在缺氧诱导的细胞凋亡中起着双重作用,其发挥促凋亡或者抑凋亡作用取决于缺氧程度。在轻度缺氧时,HIF-1α可通过诱导抗凋亡蛋白IAP-2表达,并抑制促凋亡蛋白Bax表达从而抑制凋亡[5];当细胞处于严重缺氧状态时,HIF-1α通过稳定p53蛋白促进肿瘤细胞凋亡[6]。本结果也显示,在CoCl2≤200 μmol/L时,PANC1细胞的凋亡率无显著变化,同时伴有HIF-1α 蛋白表达水平升高,提示HIF-1α可能在轻度缺氧条件下参与了对细胞的保护;而在CoCl2≥400 μmol/L时,细胞凋亡率较对照组显著升高,同时伴有HIF-1α表达下降,这与之前物理缺氧的研究结果有所不同[6],提示CoCl2本身对细胞的损伤效应可能干扰了其所诱导的缺氧对细胞的作用。
最新研究发现,缺氧在肿瘤的浸润和转移中起着重要作用,其中HIF-1α起着关键的介导作用[7-9]。有研究表明,HIF-1α可通过诱导基质金属蛋白酶(MMPs)表达上调从而促进肿瘤转移[7]。研究还表明,缺氧状态下HIF-1α可与TGF-β或Notch通路共同作用诱导上皮间质转化的发生,从而促进肿瘤细胞迁移[8-9]。本实验结果显示,CoCl2模拟缺氧对PANC1细胞迁移的作用呈现双向性,与HIF-1α蛋白表达的变化趋势一致,提示HIF-1α可能与缺氧促胰腺癌PANC1细胞迁移的作用有关,但在严重缺氧时,细胞迁移率反而降低,同时HIF-1α蛋白表达下降,这可能是CoCl2本身对细胞损伤效应的表现。
[1] Harris AL. Hypoxia-a key regulatory factor in tumour growth. Nat Rev Cancer, 2002, 2:38-47.
[2] Kizaka-Kondoh S, Tanaka S, Harada H, et al. The HIF-1-active microenvironment: an environmental target for cancer therapy. Adv Drug Deliv Rev, 2009, 61:623-632.
[3] Guo S, Bragina O, Xu Y, et al. Glucose up-regulates HIF-1 alpha expression in primary cortical neurons in response to hypoxia through maintaining cellular redox status. J Neurochem, 2008, 105:1849-1860.
[4] Zou W, Zeng J, Zhuo M, et al. Involvement of caspase-3 and p38 mitogen-activated protein kinase in cobalt chloride-induced apoptosis in PC12 cells. J Neurosci Res, 2002, 67:837-843.
[5] Greijer AE, van der Wall E. The role of hypoxia inducible factor 1 (HIF-1) in hypoxia induced apoptosis. J Clin Pathol, 2004, 57: 1009-1014.
[6] Schmid T, Zhou J, Brüne B. HIF-1 and p53: communication of transcription factors under hypoxia. J Cell Mol Med, 2004, 8: 423-431.
[8] Haase VH. Oxygen regulates epithelial-to-mesenchymal transition: insights into molecular mechanisms and relevance to disease. Kidney Int, 2009, 76:492-499.
[9] Jiang J, Tang YL, Liang XH. EMT: a new vision of hypoxia promoting cancer progression. Cancer Biol Ther, 2011,11:714-723.
Effectsofcobaltchloridemimetichypoxiaontheproliferation,apoptosisandmigrationofhumanpancreaticcancercelllinePANC1
ZHULiang,XUSheng-nan,PANGHui-fang,ZHAOHui-zhen,QINHua,LIPei-yuan,LIDe-min,ZHAOQiu.
DepartmentofGastroenterology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
ZHAOQiu,Email:zhaoqiu@medmail.com.cn
ObjectiveTo investigate the influence of cobalt chloride (CoCl2)-mimetic hypoxia on the proliferation, apoptosis and migration of human pancreatic cancer cell line PANC1.MethodsPANC1 cells were treated with 0(control), 100, 200, 400, 800 μmol/L CoCl2respectively for 24 h. Real-time RT-PCR and Western blot were used to determine hypoxia induced factor (HIF)-1α mRNA and protein expression respectively, and cell counting kit-8(CCK-8) assays, flow cytometry and cell scratch test were used to examine the proliferation, apoptosis and migration of PANC1 cells, respectively.ResultsIn the control group and 100, 200, 400 and 800 μmol/L CoCl-2 groups, the expressions of HIF-1α mRNA were 1, 1.08±0.12, 1.12±0.09, 1.04±0.11, 0.66±0.07, and the expressions of VEGF mRNA were 1, 2.69±0.35, 4.81±0.54, 2.19±0.21, 0.79±0.08, while the expressions of HIF-1α protein were 0.23±0.03, 0.36±0.04, 1.15±0.11, 1.08±0.09, 0.44±0.04; and the expressions of VEGF protein were 0.14±0.02, 0.12±0.01, 0.95±0.09, 0.87±0.09, 0.55±0.06; and cell viability rates were 100%, (98.43±2.88)%, (76.15±0.70)%, (53.87±0.77)%, (35.23±0.67)%; while cell apoptotic rates were (5.2±1.12)%, (5.74±1.07)%, (6.82±1.85)%, (12.09±3.53)%, (31.88±6.95)%; the cell migration distance of PANC1 cells were (43.24±3.67)%, (59.46±5.39)%, (80.56±8.05)%, (63.89±5.96)%, (9.09±1.59)%. Compared with those of control group, the expressions of VEGF mRNA, VEGF and HIF-1α protein, cell migration distance showed a two-way variation (ascending first and descending later) (P<0.05), and the expression of HIF-1α mRNA and cell proliferation rate was decreased in a dose-dependent manner, while the cell apoptosis was increased in a dose-dependent manner.ConclusionsCoCl2significantly inhibits the proliferation and promotes apoptosis of PANC1 cells at certain level. CoCl2has a two-way effect on the migration of PANC1 cells, and it may be related to the direct injury of high concentration of CoCl2on cells.
Pancreatic neoplasms; Anoxia; Cobalt chloride; Cell proliferation; Apoptosis; Cell movement
10.3760/cma.j.issn.1674-1935.2012.02.011
430030 武汉,华中科技大学同济医学院附属同济医院消化内科(朱亮、徐胜南、庞慧芳、赵慧贞、覃华、黎培员、李德民、赵秋);南昌大学第一附属医院消化内科(朱亮)
赵秋,Email: zhaoqiu@medmail.com.cn
2011-11-25)
(本文编辑:吕芳萍)
