2-吡啶酮类衍生物的生物活性及合成方法的研究进展
2012-11-06张明峰吕志良
张明峰,吕志良,李 科
(第二军医大学药学院,上海 200433)
2-吡啶酮类衍生物的生物活性及合成方法的研究进展
张明峰,吕志良,李 科
(第二军医大学药学院,上海 200433)
目的介绍2-吡啶酮类化合物的生物活性以及合成方法方面的研究进展。方法查阅国内外文献资料进行分析归纳与整理。结果与结论在现有研究成果的基础上,深入对该类化合物在作用机制以及作用靶点方面进行研究将会进一步推动该类化合物的研发进程。
2-吡啶酮;抗菌;抗病毒;合成方法
2-吡啶酮类衍生物以其显著的生物活性一直是医药学以及化学领域的研究热点之一。现代药理学研究发现:具有2-吡啶酮结构的小分子化合物具有多种生物活性,如抗菌[1]、抗病毒[2]、抗肿瘤[3]、抗血栓[4],能够预防和治疗肝纤维化以及预防老年痴呆症等。2-吡啶酮类衍生物具有多种生物活性,经过结构修饰的2-吡啶酮类衍生物表现出更好的生物活性,随着对其药理作用的深入研究,该类化合物表现出良好的临床应用前景。本文主要从2-吡啶酮类化合物的生物活性以及合成方法两个方面对其近几年的研究进行综述。
1 2-吡啶酮类衍生物的活性研究进展
1.1天然提取的2-吡啶酮衍生物活性研究 Tenellin 1是从一种白僵菌属真菌的代谢产物中分离得到的一种2-吡啶酮衍生物[5],是复杂的真菌类二级代谢大家族中的一员。许多类似的2-吡啶酮结构有很奇特的生物活性,如提取于新缝匠菌属Fischeri的次级代谢产物Fisherin 2,对灵长类动物有很强的毒性;Leporin-B 3 是从曲霉菌的代谢产物提取的2-吡啶酮衍生物,对昆虫有毒性;提取于Eupenicilliumoxysporum的2-吡啶酮衍生物PF1140 4和Sambutoxin 5 对大多数真菌都有很强的抑制作用[6]。Bergmann等2007年在Nature上发表文章:类似于aspyridone-A 6类2-吡啶酮衍生物的生物合成是由一个杂交聚酮合成酶-非核糖体多肽合成酶(hybrid polyketide synthase nonribosomal peptide synthetase PKS-NRPS)参与的合成/转化反应[7](见图1)。该合成质酶由一个开放的12kb框架编码而成。
Gan等[8]从夹竹桃科植物中对抗肿瘤组分追踪的过程中发现了具有2-吡啶酮结构的Leuconicines 7-11等化合物(图2)。体外活性显示,该组化合物对那些具有药物敏感性以及对长春新碱耐药的KB细胞系并没有显著的细胞毒性作用(IC50>25 μg/ml),但是却能有效逆转耐药性(见表1)。
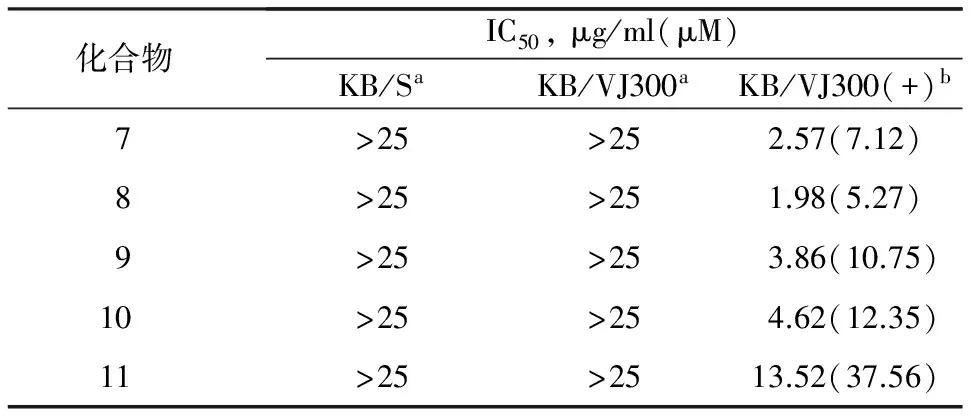
表1 化合物7-11与长春新碱相互作用的抗肿瘤活性
aKB/S为长春新碱敏感的KB细胞系,KB/VJ300为长春新碱耐药的KB细胞系,bKB/VJ300(+)为加0.1g长春新碱的细胞系。

图1 部分天然2-吡啶酮类化合物

图2 夹竹桃科植物提取的2-吡啶酮类化合物
另外,Fujimoto以及Alfatafta等[9]早在1994年就从粪生丝菌中分别提取出具有抗真菌活性的2-吡啶酮类天然产物 12,13,其结构见图3。
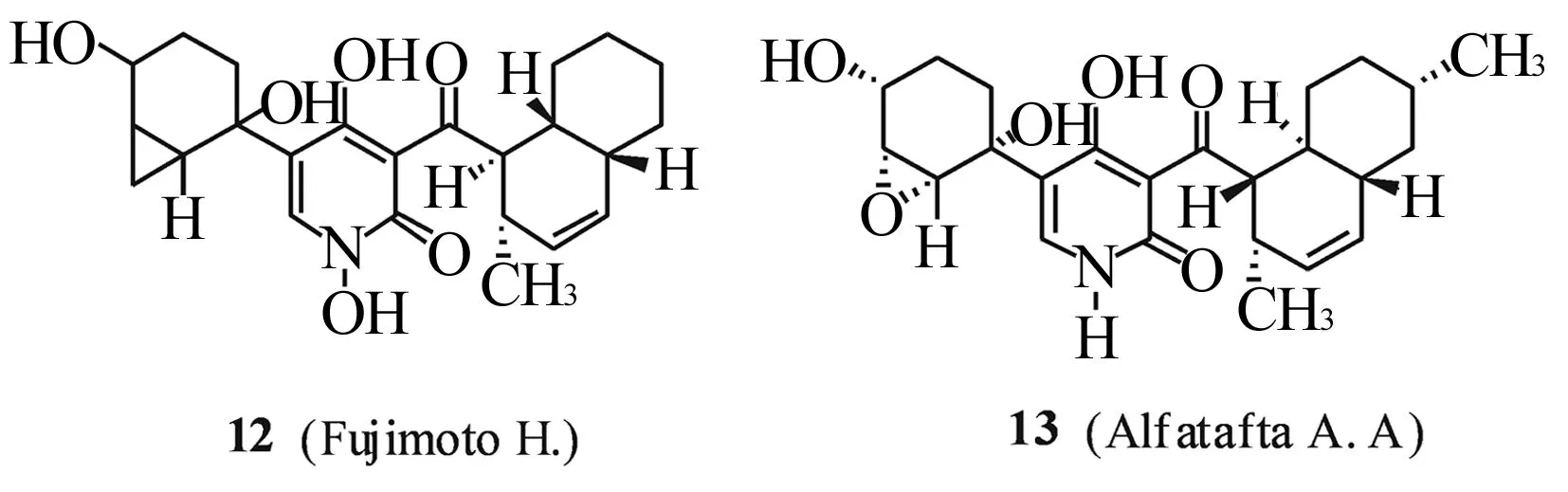
图3 粪生丝菌中提取的2-吡啶酮类天然产物
1.2化学合成2-吡啶酮衍生物活性研究 Li等[10]自1992年以来对取代苯并2-吡啶酮衍生物的合成以及该类化合物在细菌拓扑异构酶抑制活性方面进行了长达十几年的研究。作者以4-喹诺酮类抗菌药为设计母体,以3-氯-2, 4, 5, 6-四氟吡啶为起始原料,经过长期的合成条件摸索,几经更换反应路线和反应条件,最终确定了一条高产率路线从头设计并合成了数百个2-吡啶酮类衍生物。经过体内体外抗菌活性筛选后得到了数十个活性更好,毒性更低,并且水溶性更好的候选药物14~17(图4),其体内体外活性均相当或优于已上市对照药物环丙沙星(表2)[11,12]。
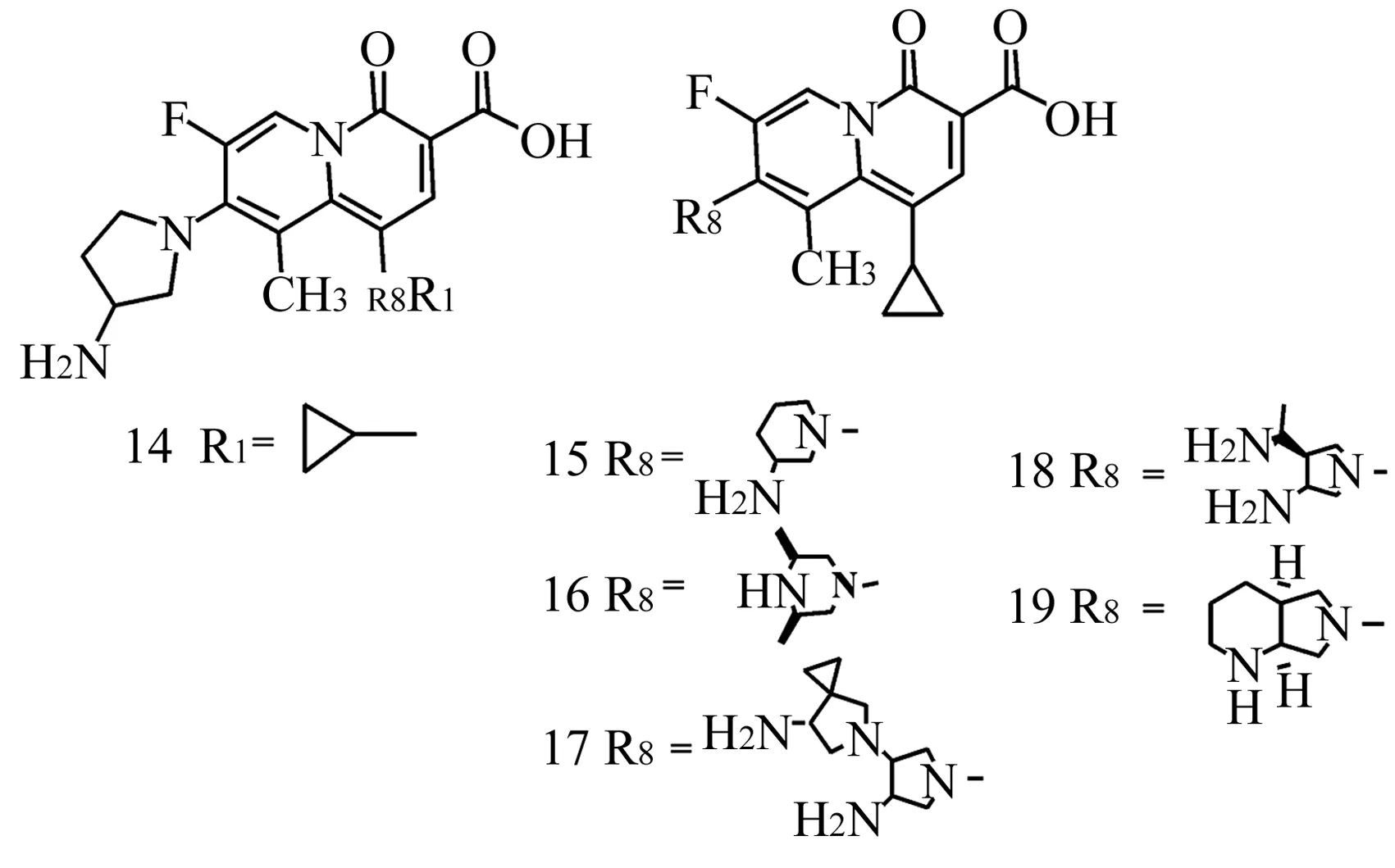
图4 取代苯并2-吡啶酮衍生物

表2 吡啶酮衍生物的旋转酶抑制活性(mg/ml)[10,12]
3C蛋白酶是人鼻病毒的关键酶,抑制其正常功能可以有效防止鼻病毒在人体内的复制进而预防人鼻病毒的大量传染。Dragovich等[2,14]在多肽3C蛋白酶抑制剂的基础上引入2-吡啶酮片段,由此得到了一类较之母体结构活性更强的衍生物。其构建2-吡啶酮环的方法是以取代2-羟基吡啶为原料,经过2-羟基吡啶的异构并脱去N上的氢原子与易离去基团交换得到终产物20(图5)。该化合物的3C蛋白酶抑制活性可以达到33 nM,优于对照药Pleconaril的58 nM。
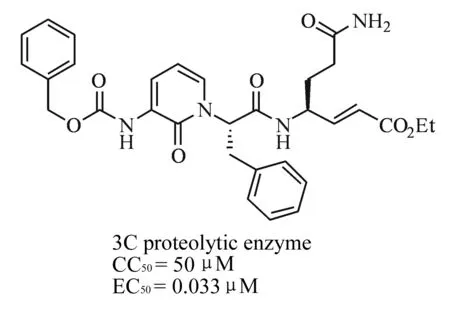
图5 2-吡啶酮类多肽3C蛋白酶抑制剂衍生物
急性冠状动脉综合征(acute coronary syndromes,ACS)越来越成为影响现代人生活质量的严重疾病之一,其主要表现包括心绞痛,心肌梗塞,暂时性心肌局部缺血等,其主要诱因为急性血块生成。近年来的机理研究表明,凝血激酶Ⅶa(tissue factor Ⅶa)是发生内源性凝血途径的关键酶之一,阻止该酶激活可以有效预防内源性凝血从而有效降低ACS发病率。Parlow等[4]在Pyrazinone类成药的基础上优化改造,以2,5-二溴吡啶为起始原料经数步反应得到目标化合物21,22(图6),由此获得了一类全新的2-吡啶酮类衍生物。而14a与TFⅦa的共结晶X-ray单晶衍射证明了该类结构与TFⅦa活性腔能很好结合发挥抑制作用。

图6 2-吡啶酮类凝血激酶Ⅶa抑制剂衍生物
Merk公司早在上个世纪80年代就已经开始了对2-吡啶酮类衍生物在抗真菌以及抗病原细菌方面的研究[15]。随着研究的进一步深入,Merk公司的Hoffman小组和Bisagni小组[16~21]发现,经过进一步结构优化的2-吡啶酮衍生物是HIV-1专属的逆转录酶抑制剂。他们所采用的典型的构建2-吡啶酮目标化合物的方法基本相同,以2-戊酮为起始原料,经过两步反应构建出2-吡啶酮母体,再与另一部分官能团对接的方法合成目标化合物23(图7)。经过十几年研究,优选出一批活性达到nM级的候选药物,为该类化合物与逆转录酶的构效关系(SAR)研究以及后续新结构的研发积累了丰富的经验。

图7 2-吡啶酮类HIV-1专属逆转录酶抑制剂
法国的Nguyen科研小组[22~25]在以上基础上对此类化合物进行了更进一步的结构优化,增加了吡啶酮环上3位和4位上官能团的多样性从而获得了高活性的抗HIV候选药物,其中化合物24~26(图8)对CEM-SS细胞系转染的HIV-1病毒抑制率达到0.2~3 nM。并且该组对合成路线进行了修改,虽然路线仍较长,但对目标化合物的多样性以及活性提高方面做出了巨大的贡献。
本课题组在前期抗乙肝病毒研究的基础上首次报道了一类以全新的方法设计合成的一系列2-吡啶酮类衍生物(图9),在体外抗HBV的细胞模型上成功的验证了其抗HBV活性[26]。其中化合物27, 28的体外抑制DNA复制活性是对照药阿德福韦的2倍以上,并且毒性极低,因此具有较高的治疗指数。
2 2-吡啶酮类衍生物合成方法研究进展
2.11+2+3环化反应过程 Hamdy等[27]以取代苯乙酮(1),取代芳醛(2)以及氰基乙酸乙酯(3)为原料进行的3组分环合反应。将1:1:1的以上三种原料投入反应器,加入8倍量的醋酸胺以及10倍量的丁醇回流反应3 h即可高产率得到目标化合物。其中2-吡啶酮环上5,6位两个碳原子由原料1提供,4位碳原子由原料2提供,一位氮原子以及2,3位碳原子由原料3提供。Chan等[27]在全合成新生霉素时将1+2+3构建2-吡啶酮环的方法巧妙的运用其中,得到了较高的产率。(见图10)
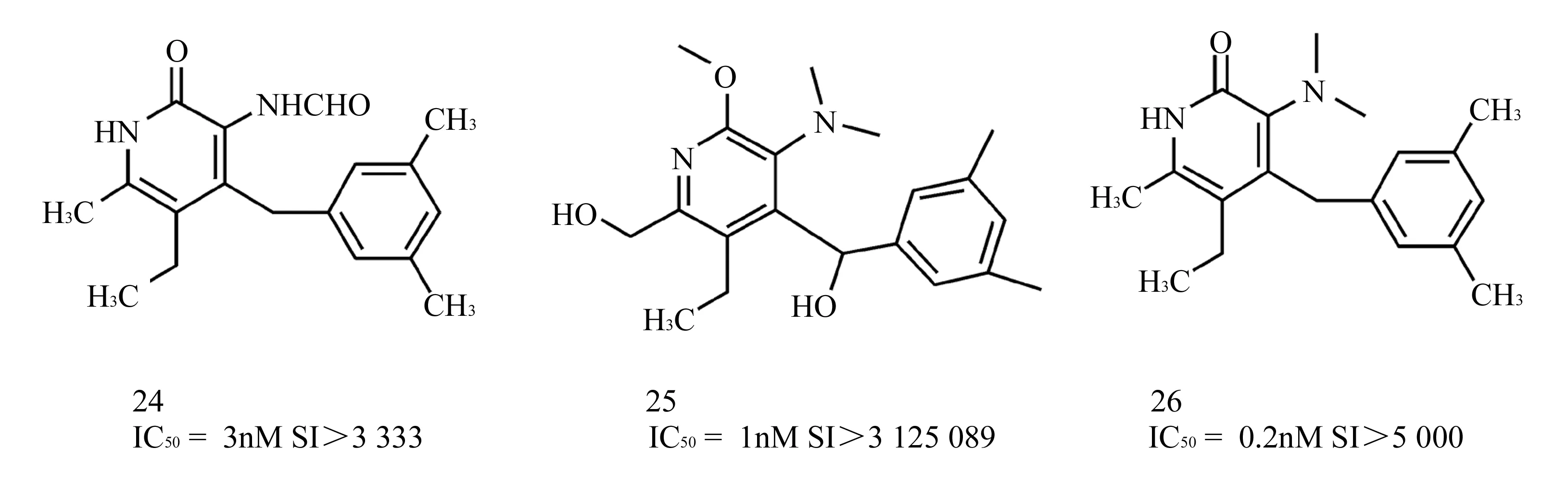
图8 2-吡啶酮类高活性抗HIV候选药物

图9 2-吡啶酮类抗HBV化合物
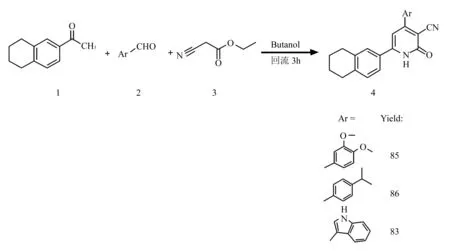
图10 1+2+3环化反应过程
2.22-卤吡啶,2-羟基或2-甲氧基吡啶转化反应过程 Wall等[29,30]以2-苯甲酰基取代苯胺(5)为原料与2-取代醋酸在三氯氧磷氧化环合得到关键中间体6即取代2-氯吡啶,中间体6在80%醋酸以及醋酸铵水溶液中加热回流数小时得到目标化合物7,产率较高,用于合成1位无取代的2-吡啶酮类衍生物,反应过程见图11。
Dollé等[22]在研究2-吡啶酮类衍生物对HIV-1逆转录酶抑制活性过程中,以2-戊酮(8)为起始原料经数步反应得到关键中间体9,中间体9在浓盐水中回流得到目标化合物10(图12)。该条路线虽然较差,但是其优点也是显而易见的,如可以对吡啶环的3,4位进行大量的结构修饰,完善3,4位在抗HIV-1活性方面的构效关系。

图11 2-卤吡啶,2-羟基或2-甲氧基吡啶转化反应过程

图12 盐酸回流转化反应过程
2.33+3环合反应过程 Mathews等[31]以中间体11得到2-吡啶酮衍生物,产率均较高。在碱性条件下,氰乙酰胺首先与缩硫酯缩合后醛基与双键移位与胺的一个游离氢脱水得到产物12;相反,在酸性条件下,氰乙酰胺首先与醛基缩合得不稳定中间体,经过高位回流反应得到缩合产物13。在不同pH条件下,缩合优先顺序的差异可以得到两种截然不同的缩合产物(图13)。除此之外,3+3环合[32,33]得到2-吡啶酮环的合成方法多见报道,其中以Merk公司[16~22]研制抗菌新药ABT-719以及法国Nguyen.课题组[22~25]合成抗HIV-1逆转录酶抑制剂研究论文为多见。
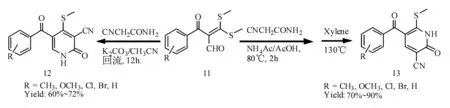
图13 3+3环合反应过程
2.4开环重排反应过程 本课题组[26]以及Abdel等[34]所采用的主要构环方法为开环重拍法,取代伯胺与原料14在甲醇作溶剂,三乙胺碱性条件下回流反应。由于取代基以及4位羰基的共同作用,苯并吡喃酮环2位碳原子带有较强的正电性,因此苯胺首先攻击2位碳原子使其开环后与甲酯发生氨解而得到目标化合物15。该反应适用范围较广,产率高,适合于合成1位芳基或脂肪基取代5位芳羰基取代2-吡啶酮类化合物。
2.5其他反应过程 Jung-Nyoung等[35]利用Pd为催化剂,甲苯作溶剂,将取代胺类与原料16反应得到系列吡啶类取代化合物17。然后在Pd/C催化下,室温下氢化反应4 h得到目标化合物18。胺类化合物为环状仲胺时,产率较高;当使用BINAP做为催化反应的配体时,产率也得到一定程度的提高。
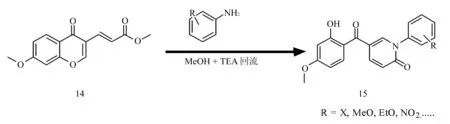
图14 开环重排反应过程

图15 催化转化反应过程
3 展望
鉴于2-吡啶酮类衍生物在抗菌,抗病毒,抗神经损伤,抗肿瘤等多方面的生物活性,因此近年来对2-吡啶酮类衍生物的生物活性以及合成方法改进方面的研究成为各大制药企业以及科研院所研究立项的热点之一。但是2-吡啶酮类衍生物在很多方面的活性机制以及作用靶点尚不明确,在现有研究成果的基础上,深入对该类化合物在作用机制以及作用靶点方面进行研究将会进一步推动该类化合物的研发进程。
[1] Alfatafta AA, Gloer JB, Scott JA,etal. Apiosporamide, a new antifungal agent from the coprophilous fungus apiospora montagnei[J]. J Nat Prod,1994,57(12):1696.
[2] Dragovich PS, Prins TJ, Zhou R,etal. Structure-based design, synthesis, and biological evaluation of irreversible human rhinovirus 3C protease inhibitors 6 structure activity studies of orally bioavailable, 2 pyridone containing peptidomimetics[J]. J Med Chem,2002,45(8):1607.
[3] Cocco MT, Congiu C, Onnis V. Synthesis and antitumour activity of 4-hydroxy-2-pyridone derivatives[J]. Eur J Med Chem,2000,5(5):545.
[4] Parlow JJ, Kurumbail RG, Stegeman RA,etal. Design, synthesis, and crystal structure of selective 2-pyridone tissue factor VIIa inhibitors[J]. J Med Chem,2003,46(22):4696.
[5] Wat C-K, Mcinnes AG, Smith DG,etal. The yellow pigments of beauveria species. Structures of tenellin and bassianin[J]. Can J Chem,1977,55(23):4090.
[6] Halo LM, Heneghan MN, Yakasai AA,etal. Late stage oxidations during the biosynthesis of the 2-pyridone tenellin in the entomopathogenic fungus beauveria bassiana[J]. J Am Chem Soci,2008,130(52):17988.
[7] Bergmann S, Schumann J, Scherlach K,etal. Genomics,driven discovery of PKS,NRPS hybrid metabolites from aspergillus nidulans[J]. Nat Chem Biol,2007,3(4):213.
[8] Gan CY, Low YY, Etoh T,etal. Leuconicines A,G and (-),eburnamaline, biologically active strychnan and eburnan alkaloids from Leuconotis[J]. J Natu Produ,2009,72(12):2098.
[9] Fujimoto H, Ikeda M, Yamamoto K,etal. Structure of fischerin, a new toxic metabolite from an ascomycete, neosartorya fischeri var. fischeri[J]. J Natu Produ,1993,56(8):1268.
[10] Li Q, Mitscher LA, Shen LL. The 2-pyridone antibacterial agents: bacterial topoisomerase inhibitors. Med Rese Revi,2000,20(4):231.
[11] Li Q, Chu DTW, Claiborne A,etal. Synthesis and structure-activity relationships of 2-pyridones: A novel series of potent DNA gyrase inhibitors as antibacterial agents[J]. J Med Chem,1996,39(16):3070.
[12] Klein LL, DeGoey DA, Thomas SA,etal. Preparation and antibacterial activity of pyridopyridone analogs: C-1 modifications. Bioi[J]. Med,Chem,Let,1997,7(9):1167.
[13] Meulbroek JA, Oleksijew A, Tanaka SK,etal. Efficacy of ABT-719, a 2-pyridone antimicrobial, against enterococci, escherichia coli, and pseudomonas aeruginosa in experimental murine pyelonephritis[J]. J Antimicrob Chemother,1996,38: 641.
[14] Dragovich PS, Prins TJ, Zhou R,etal. Structure-based design, synthesis, and biological evaluation of irreversible human rhinovirus 3C protease inhibitors 8 pharmacological optimization of orally bioavailable 2-pyridone-containing peptidomimetics[J]. J Med Chem,2003,46(21):4572.
[15] Girotra NN, Patchett AA, Zimmerman SB,etal. Synthesis and biological activity of flavipucine analogs[J]. J Med Chem,1980,23(2):209.
[16] Hoffman JM, Wai JS, Thomas CM,etal. Synthesis and evaluation of 2-pyridinone derivatives as HIV-1 specific reverse transcriptase inhibitors. 1. phthalimidoalkyl and-alkylamino analogs[J]. J Med Chem,1992,35(21):3784.
[17] Hoffman JM, Smith AM, Rooney CS,etal. Synthesis and evaluation of 2-pyridinone derivatives as HIV-1-specific reverse transcriptase inhibitors. 4,3-[2-(benzoxazol-2-yl)ethyl]-5-ethyl-6-methylpyridin-2(1H)-one and analogs[J]. J Med Chem,1993, 36(8):953.
[18] Saari WS, Wai JS, Fisher TE,etal. Synthesis and evaluation of 2-pyridinone derivatives as HIV-1-specific reverse transcriptase inhibitors 2 Analogs of 3-aminopyridin-2(1H)-one[J]. J Med Chem,1992,35(21):3792.
[19] Wai JS, Williams TM, Bamberger DL,etal. Synthesis and evaluation of 2-pyridinone derivatives as specific HIV-1 reverse transcriptase inhibitors. 3. Pyridyl and phenyl analogs of 3-aminopyridin-2(1H)-one[J]. J Med Chem,1993,36(2):249.
[20] Goldman ME, Nunberg JH, O′Brien JA,etal. Pyridinone derivatives: Specific human immunodeficiency virus type 1 reverse transcriptase inhibitors with antiviral activity[J]. Proc Nat l Acad Sci,1991,88: 6863.
[21] Saari WS, Hoffman JM, Wai JS,etal. 2-Pyridinone derivatives: a new class of nonnucleoside, HIV-1-specific reverse transcriptase inhibitors[J]. J Med Chem,1991,34(9):2922.
[22] Dolle V, Nguyen CH, Legraverend M,etal. Synthesis and antiviral activity of 4-benzyl pyridinone derivatives as potent and selective non-nucleoside human immunodeficiency virus type 1 reverse transcriptase inhibitors[J]. J Med Chem,2000,43(21):3949.
[23] Benjahad A, Croisy M, Monneret C,etal. 4-Benzyl and 4-benzoyl-3-dimethylaminopyridin-2(1H)-ones:In vitro evaluation of new C-3-amino-substituted and C-5,6-alkyl-substituted analogues against clinically important HIV mutant strains[J]. J Med Chem,2005, 48(6):1948.
[24] Dolle V, Fan E, Nguyen CH,etal. A new series of pyridinone derivatives as potent non-nucleoside human immunodeficiency virus type 1 specific reverse transcriptase inhibitors[J]. J Med Chem,1995,38(23):4679.
[25] Benjahad A, Courte K, Guillemont J,etal. 4-Benzyl-and 4-benzoyl-3-dimethylaminopyridin-2(1H)-ones, a new family of potent anti-HIV agents: optimization and in vitro evaluation against clinically important HIV mutant strains[J]. J Med Chem,2004,47(22):5501.
[26] Lv Z, Sheng C, Wang T,etal. Design, synthesis, and antihepatitis B virus activities of novel 2-pyridone derivatives[J]. J Med Chem,2010,53(2):660.
[27] Hamdy NA, Gamal-Eldeen AM. New pyridone, thioxopyridine, pyrazolopyridine and pyridine derivatives that modulate inflammatory mediators in stimulated RAW 264.7 murine macrophage[J]. Euro J Med Chem,2009, 44(11):4547.
[28] Chan BK, Ciufolini MA. Total synthesis of streptonigrone[J]. J-Org Chem, 2007,72(22):8489.
[29] Chowdhury MA, Abdellatif KRA, Dong Y,etal. Synthesis and biological evaluation of salicylic acid and N-acetyl-2-carboxybenzenesulfonamide regioisomers possessing a N-difluoromethyl-1,2-dihydropyrid-2-one pharmacophore: dual inhibitors of cyclooxygenases and 5,lipoxygenase with anti-inflammatory activity[J]. Biol Med Chem Lett,2009,19(24):6855.
[30] Wall MJ, Chen J, Meegalla S,etal. Synthesis and evaluation of novel 3,4,6,substituted 2,quinolones as FMS kinase inhibitors[J]. Biol Med Chem Let.,2008,18(6):2097.
[31] Mathews A, Anabha ER, Sasikala KA,etal. Simple methods to synthesize 2,pyridones: reactions of 2,aroyl-3,3,bis(alkylsulfanyl)acrylaldehydes and cyanoacetamide[J]. Tetrahedron,2008, 64(8):1671.
[32] Schirok H, Alonso-Alija C, Michels M. Efficient Synthesis of 6-amino-substituted pyridin-2(1H)-ones using in situ generated propiolic acid chloride[J]. Synthesis,2005,18:3085.
[33] Schirok H, Alonso-Alija C, Benet-Buchholz J,etal. Efficient regioselective synthesis of 6-amino-5-benzoyl-1-substituted 2(1H)-pyridinones[J]. J Org Chem,2005,70(23):9463.
[34] Abdel-Rahman AH, Hammouda MAA, El-Desoky SI. Synthesis of some new azole, azepine, pyridine, and pyrimidine derivatives using 6-hydroxy-4H-4-oxo[1]-benzopyran-3-carboxaldehyde as a versatile starting material[J]. Hete Chem,2005, 16(1):20.
[35] Heo JN, Song YS, Kim BT. Microwave-promoted synthesis of amino-substituted 2-pyridone derivatives via palladium-catalyzed amination reaction[J]. Tetra Let,2005,46(27):4621.
Progressonsynthesisandbiologicalactivityof2-pyridylketonederivatives
ZHANG Ming-feng, LV Zhi-liang, LI Ke
(School of Pharmacy, Second Military Medical University, Shanghai 200433,China)
ObjectiveTo introduce the progress on synthesis and biological activity of 2-pyridyl ketone derivatives.MethodsThe information described in literature both at home and abroad was reviewed.ResultsandConclusionBased on the results of existed research,deep study on the mechanism of action and the targets would further promote the development process of these compounds.
2-pyridone;antibacterial;anti-virus;synthesis
张明峰(1985-),男,硕士研究生.Tel:18817339563, E-mail:mingfeng0502@126.com.
李 科.Tel:(021)81871237,E-mail:proflike@sina.com.
R914
A
1006-0111(2012)04-0248-07
10.3969/j.issn.1006-0111.2012.04.002
2011-03-14
2012-01-19
