慢性不可预知性应激对大鼠实验性牙周炎预后的影响
2012-11-05赵雅娟陈永进
赵雅娟,张 旻,黄 飞,崔 敏,陈永进
(第四军医大学口腔医学院,陕西西安 710032)
牙周炎以牙菌斑为启动因子,宿主的自身免疫反应是加重牙周炎发展、导致牙周组织损害的重要因素[1]。相关流行病学研究已表明,应激作为一种不良因素,能够影响机体的免疫反应,在牙周炎的发生发展中起到重要的作用[2]。然而,在牙周炎经过基础治疗后的维护和愈合过程中,应激是否也会起到作用,目前尚未见相关报道。本研究拟通过建立大鼠实验性牙周炎模型,同时给予复合性心理应激,探讨应激对牙周炎预后的影响,进一步为临床上与心理因素有关的牙周炎的发生发展及干预提供实验依据和理论基础。
1 材料和方法
1.1 主要材料和设备
雄性Sprague-Dawley大鼠(第四军医大学实验动物中心提供);4-0医用编织丝线(强生医疗器材有限公司);氟西汀注射液(国药准字H12020957,天津金耀氨基酸有限公司);大鼠皮质酮(Corticosterone)、促肾上腺皮质激素(ACTH)ELISA试剂盒(上海西唐生物科技有限公司);RD1412-OF旷场实验箱、RD1208-EP高架十字迷宫(上海Mobile-datum公司)。
1.2 动物实验
1.2.1 大鼠实验性牙周炎模型的建立
取5 周龄,平均体质量(247.24 ±11.06)g SD大鼠128只,采用完全随机分组法取32只作为正常对照组(A),其余96只建立实验性牙周炎模型。参照文献[3],大鼠经10 g/L戊巴比妥钠3.5 mg/kg腹腔注射麻醉,仰卧位固定,4-0医用无菌丝线结扎每只大鼠右上颌第二磨牙颈部,丝线保留4周。A组大鼠仅实施假手术而无丝线结扎。各组大鼠均于第四军医大学口腔医院实验动物中心(SPF级)统一饲养,环境温度(22±1)℃,相对湿度(60±5)%,12 h昼夜循环照明。实验第4周,测量丝线结扎大鼠双侧第二磨牙龈沟出血指数(SBI),颊面近中、中央、远中牙周探诊深度 (PD)并取均值,用以验证牙周炎模型。
1.2.2 动物分组和应激处理
牙周炎模型建立完成后的96只大鼠随机分为牙周炎对照组(B)、牙周炎+心理应激组(C)、牙周炎+心理应激+应激对抗药物组(D),加上正常对照组(A)共4组。各组按照实验时间再随机分为4、5、6、8周4个亚组,每组8只。从第5周起,C、D组大鼠每日给予慢性不可预知性应激处理。应激方法参照文献[4-5]并进行部分改进:禁食(24 h)、禁水(24 h)、45 ℃强迫浸水(5 min)、4 ℃强迫浸水(5 min)、潮湿垫料(24 h)、昼夜颠倒(24 h)、束缚(1 h)。以上7种应激因子按随机化方法每日应用其中之一,使动物不能预料刺激的发生,以免产生适应性。其中D组大鼠在应激处理的同时每日按5 mg/kg腹腔注射氟西汀。A、B组大鼠不作任何处理,与C、D组相同条件下饲养。
1.3 应激相关指标测量
1.3.1 体质量测量
分别于实验第4、5、6、8周结束时测量各组大鼠体质量并计算其体质量增长率。
1.3.2 行为学测试[6]。
分别于实验第5、6、8周取各组大鼠进行旷场实验和高架十字迷宫实验。每只大鼠测试完毕后,用200 mL/L乙醇彻底擦拭实验箱内部,以消除上一只测试大鼠气味的影响。
1.3.2.1 旷场实验(Open field test)
旷场实验箱(100 cm×100 cm×80 cm),为不透明树脂玻璃材料制成,侧壁为白色,箱底为黑色。测试时,将大鼠放入旷场中央,正上方数字摄像机记录每只大鼠在15 min内中央活动路程(cm)、总路程(cm)。
1.3.2.2 高架十字迷宫实验(Elevated plus maze text)
高架十字迷宫为黑色不透明树脂玻璃材料制成,共有4个臂(50 cm×10 cm),成“十字”形状,距离地面70 cm。测试时,将大鼠从中央格面向闭合臂放入。正上方数字摄像机记录每只大鼠在5 min内进入开放臂和闭合臂的次数以及停留时间,结果以每只大鼠在开放臂滞留时间百分比(%)与进入开放臂次数百分比(%)来表示。
1.3.3 血清皮质酮(Corticosterone,CORT)、促肾上腺皮质激素(ACTH)测定
分别于实验第5、6、8周结束时各组大鼠经10 g/L戊巴比妥钠3.5 mg/kg腹腔注射麻醉,心脏取血1.5 mL,于4 ℃下3000 r/min 离心15 min,取上清,-80℃保存。采用ELISA法测定血清皮质酮、促肾上腺皮质激素含量,具体步骤按照试剂盒说明书操作。
1.4 组织学观察与测量
分别于实验第4、5、6、8周结束时各组大鼠经10 g/L戊巴比妥钠3.5 mg/kg腹腔注射麻醉,100 g/L多聚甲醛心脏灌注固定,取右侧磨牙区上颌骨,置于100 g/L多聚甲醛固定48 h,150 g/L EDTA脱钙,石蜡包埋,制备牙长轴近中远中方向连续切片5 μm,并确保第二磨牙近中远中根同时包含于切片内。HE染色,光学显微镜下观察牙周组织病理改变。形态学改变应用计算机图像分析软件量化。炎症反应程度用同等放大倍数下(×100)炎细胞浸润面积表示,牙槽骨丧失量用牙槽嵴顶冠方至釉牙骨质界距离表示,附着丧失量用结合上皮冠方至釉牙骨质界距离表示[7](图1)。在高倍视野下(×400)将牙周膜置于视野直径,计算右上颌第二磨牙根分叉以及近中远中牙槽嵴顶向下3个高倍视野范围内破骨细胞数[8]。
1.5 统计学分析

图1 组织学测量示意图
2 结果
2.1 牙周炎模型建立情况
实验第4周,建立牙周炎模型大鼠右上颌第二磨牙(建模牙)牙龈红肿,探诊易出血,部分结扎处牙龈糜烂,根分叉暴露。而左上颌第二磨牙(对照牙)未见明显牙周炎症状。建模牙龈沟出血指数和牙周探诊深度明显大于对照牙,差异有统计学意义(P <0.05)(表1)。
表1 牙周炎模型牙SBI、PD测量结果()
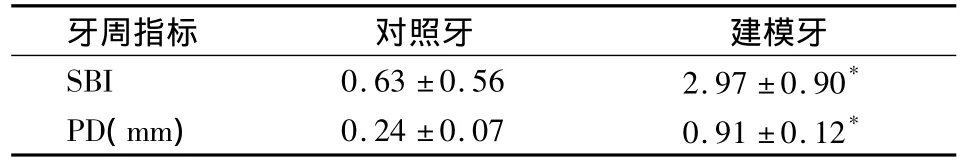
表1 牙周炎模型牙SBI、PD测量结果()
*与对照牙相比P<0.05
牙周指标 对照牙 建模牙SBI 0.63 ±0.56 2.97 ±0.90*PD(mm) 0.24 ±0.07 0.91 ±0.12*
2.2 大鼠体质量变化
实验第4周结束时,各组大鼠体质量增长量无显著差异(P>0.05)。而在实验第5、6、8周结束时,C、D组大鼠体质量增长量均明显低于A、B组,差异有统计学意义(P<0.05),B组与A组相比,各时间点均无显著差异(P>0.05)。D组与C组相比,除在第8周体质量增长量高于 C组(P<0.05)外,其他各时间点差异均无统计学意义(P >0.05)(表 2)。
表2 不同时间点各组大鼠体质量增长量比较(%,)

表2 不同时间点各组大鼠体质量增长量比较(%,)
同一时间点各组相比,不同字母组间P<0.05
时间(周) A组 B组 C组 D组4 50.06 ± 5.63a 51.16 ±6.76a 50.58 ±4.05a 50.18 ± 5.03a 5 62.51 ± 8.22a 63.91 ±7.96a 52.72 ±6.20b 54.61 ± 6.36b 6 74.52 ± 7.72a 74.12 ±7.25a 62.77 ±4.75b 64.98 ± 7.16b 8 103.06 ± 12.64a 106.31 ±8.61a 72.41 ±11.19b 88.71 ± 8.32c
2.3 行为学分析结果
2.3.1 旷场实验
实验第5、6、8周,各组大鼠中央活动路程和活动总路程两指标均以A、B组最高,其次为D组,C组最低。两指标在5周时,各组间相比均无显著差异(P>0.05);6周时,仅 C组与 A、B组相比P<0.05;8周时,C、D 组与 A、B 组相比 P <0.05;C、D两组相比中央活动路程为P<0.05,而活动总路程为 P >0.05。A、B 两组5、6、8 周相比,两指标均无显著差异(P>0.05)。C、D两组随时间延长,两指标均呈下降趋势。C组中央活动路程仅8周与5、6周相比P<0.05,活动总路程仅8周与5周相比P <0.05。D 组两指标 5、6、8周相比均为P >0.05(图2~3)。
2.3.2 高架十字迷宫实验
实验第5、6、8周,各组大鼠开放臂滞留时间百分比和进入开放臂次数百分比两指标均以A组和B组最高,其次为D组,C组最低。两指标在5周时,各组间相比P>0.05;6周时,仅C组与A、B两组相比 P<0.05;8周时,C、D组与 A、B组相比P<0.05;C、D两组相比,开放臂滞留时间百分比为 P <0.05,进入开放臂次数百分比为P >0.05,A、B两组 5、6、8周相比,两指标均无显著差异(P>0.05)。C、D两组随时间延长,两指标均呈下降趋势。C组两指标5、6、8周相比 P>0.05。D组开放臂滞留时间百分比5、6、8周相比P>0.05,进入开放臂次数百分比仅8周与5周相比有显著差异(P <0.05)(图4~5)。
2.4 血清CORT、ACTH测定结果
实验第5、6、8周,各组大鼠CORT和ACTH两指标均以A组和B组最低,其次为D组,C组最高。两指标在5周时,各组间均无显著差异(P>0.05);6 周时,C、D 组与 A、B 组 相比P <0.05,C、D 组之间,A、B 组之间则为 P >0.05;8周时,C、D 组与 A、B 组相比 P <0.05,C、D 两组相比P <0.05。A、B 两组 5、6、8 周相比,两指标均无显著差异(P>0.05)。C、D两组随时间延长,两指标均呈上升趋势。C组CORT仅8周与5周相比P <0.05,ACTH 5、6、8 周两两比较 P < 0.05。D组CORT仅8周与5周相比P<0.05,ACTH在8周与5、6周之间相比P<0.05(图6~7)。
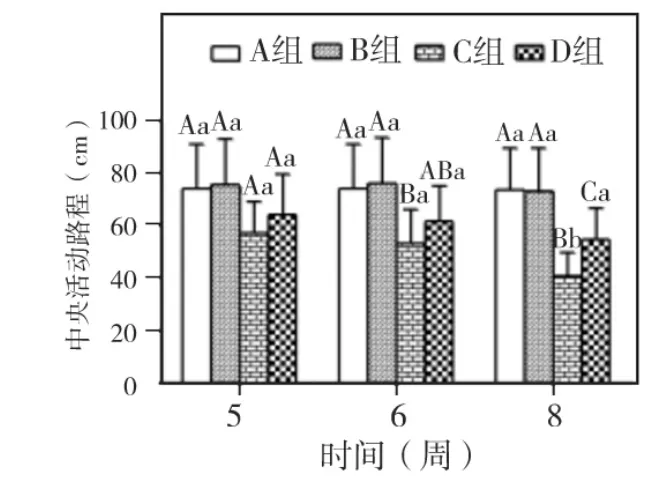
图2 各组大鼠中央活动路程
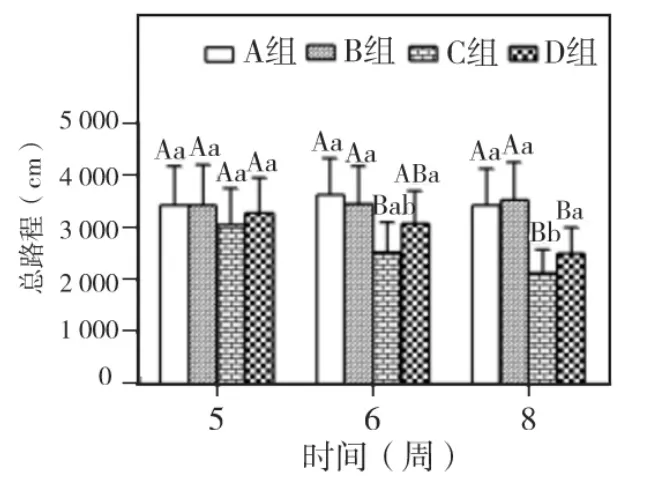
图3 各组大鼠活动总路程
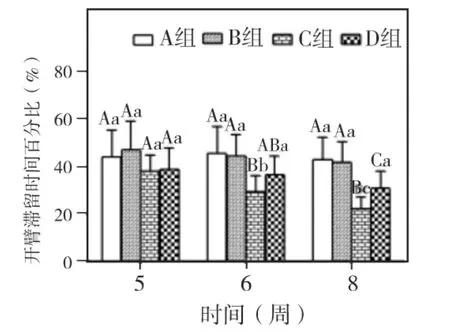
图4 各组大鼠在开放臂滞留时间百分比
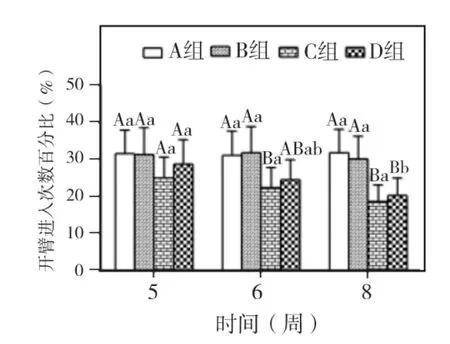
图5 各组大鼠进入开放臂次数百分比
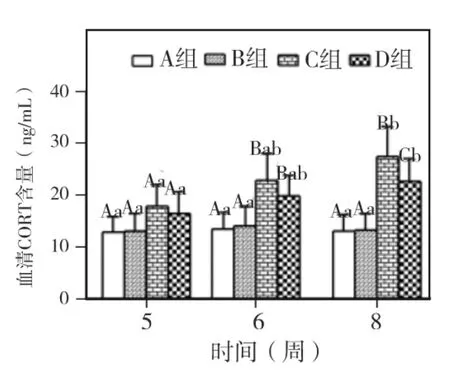
图6 各组大鼠血清CORT含量
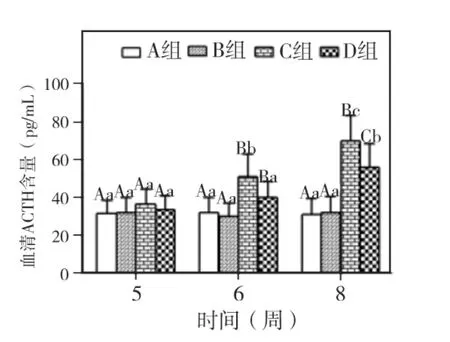
图7 各组大鼠血清ACTH含量
2.5 组织学分析
2.5.1 炎症反应
A组大鼠上颌第二磨牙牙周组织正常,牙龈上皮结构完整,上皮下未见明显炎症细胞浸润,牙龈、牙周膜纤维排列整齐,牙槽骨形态完整,未见明显吸收(图8 a,e)。炎细胞浸润面积 4、5、6、8 周之间无显著差异(P >0.05)。实验第4周,B、C、D 组可见牙龈上皮钉突增生,大量炎症细胞浸润,牙龈、牙周膜纤维排列紊乱,结合上皮向根方增殖,牙槽骨高度降低,骨小梁稀疏(图8 b~d),炎细胞浸润面积显著大于 A 组(P<0.05)。5~8周,B、C、D组炎症浸润面积均逐渐减小(图8 f~h)。5周时,B、C、D组与 A 组相比有显著差异(P<0.05);而第6周,B、D组虽大于 A 组(P<0.05),却显著小于C组(P<0.05);8周时,B组与A组相比无显著差异(P>0.05),C组仍显著大于 B、D组(P <0.05)(表 3)。
2.5.2 牙槽骨吸收、附着丧失
A组大鼠右上颌第二磨牙未见明显牙槽骨吸收,结合上皮附着于釉牙骨质界附近(图8 a,e),牙槽骨吸收、附着丧失两指标在4、5、6、8周之间无显著差异(P >0.05)。实验第4周,B、C、D组可见牙槽骨明显吸收,附着丧失明显增加(图8 b~d),与A组相比 P<0.05。5~8周,B、C、D 组可见牙槽骨重新形成、改建,上皮再附着(图8 f~h),且两指标均逐渐减小,以B组减小幅度最大,D组次之,C组最小。5周时,B、C、D组两指标与A组相比P<0.05;6周时,B、D组牙槽骨丧失与A组相比P >0.05,但显著小于 C 组(P <0.05),附着丧失B、C、D 组间无显著差异(P>0.05),但显著大于 A组(P<0.05);8周时,B、D组牙槽骨丧失与A组相比P >0.05,显著小于 C 组(P <0.05),附着丧失B、C、D组显著大于 A 组(P<0.05),且 C组显著大于B组(P<0.05)(表4~5)。
2.5.3 破骨细胞计数
A 组破骨细胞数在4、5、6、8周均较少(图9 i,m),且组间无显著差异(P>0.05)。实验第4周,B、C、D组破骨细胞数明显多于 A组(P<0.05)(图9 j~l)。5~8周,B、C、D 组可见新骨形成,破骨细胞数逐渐减少(图9 n~p),以B组减小幅度最大,D组次之,C组最小。5周时,B、C、D组与A组相比P<0.05;6周时,B、D 组与 A 组相比P>0.05;C组多于 A、B 组(P <0.05);8周时,C组多于 A、B、D 组(P <0.05),A、B、D 组间无显著差异(P >0.05)(表6)。
表3 各组炎细胞浸润面积比较(μm2,)
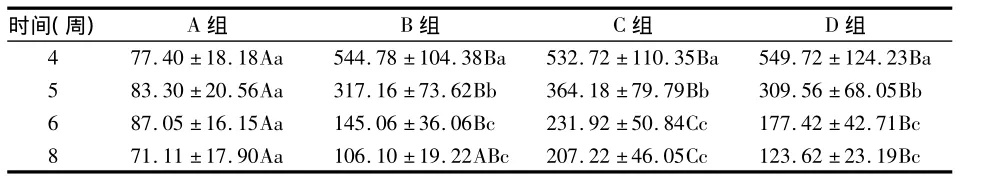
表3 各组炎细胞浸润面积比较(μm2,)
时间(周) A组 B组 C组 D组4 77.40 ±18.18Aa 544.78 ±104.38Ba 532.72 ±110.35Ba 549.72 ±124.23Ba 5 83.30 ±20.56Aa 317.16 ±73.62Bb 364.18 ±79.79Bb 309.56 ±68.05Bb 6 87.05 ±16.15Aa 145.06 ±36.06Bc 231.92 ±50.84Cc 177.42 ±42.71Bc 8 71.11 ±17.90Aa 106.10 ±19.22ABc 207.22 ±46.05Cc 123.62 ±23.19Bc
表4 各组牙槽骨吸收量比较(μm,)
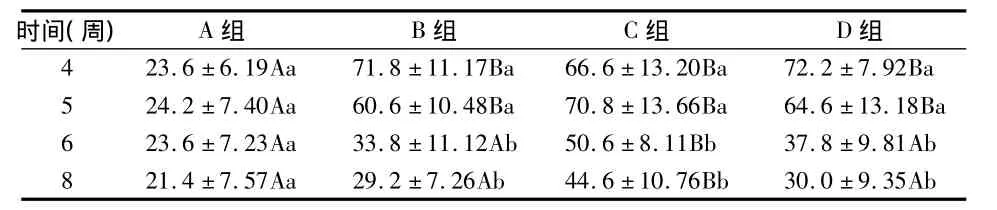
表4 各组牙槽骨吸收量比较(μm,)
时间(周) A组 B组 C组 D组4 23.6 ±6.19Aa 71.8 ±11.17Ba 66.6 ±13.20Ba 72.2 ±7.92Ba 5 24.2 ±7.40Aa 60.6 ±10.48Ba 70.8 ±13.66Ba 64.6 ±13.18Ba 6 23.6 ±7.23Aa 33.8 ±11.12Ab 50.6 ±8.11Bb 37.8 ±9.81Ab 8 21.4 ±7.57Aa 29.2 ±7.26Ab 44.6 ±10.76Bb 30.0±9.35Ab
表5 各组附着丧失比较(μm,)

表5 各组附着丧失比较(μm,)
时间(周) A组 B组 C组 D组4 4.2 ±1.64Aa 88.6 ± 18.28Ba 87.8 ±11.82Ba 82.0 ±17.87Ba 5 3.8 ±1.64Aa 80.6 ± 15.73Ba 76.8 ±15.93Bab 78.2 ±13.0Ba 6 4.0 ±1.87Aa 55.6 ± 12.74Bb 73.0 ±19.86Bab 58.6 ±13.96Bab 8 3.6 ±1.67Aa 35.8 ± 8.23Bc 57.8 ±12.79Cb 46.2 ±15.51BCb
表6 各组破骨细胞计数比较(个,)

表6 各组破骨细胞计数比较(个,)
表3~6中,大写字母为同时间组间相比P<0.05;小写字母为同组各时间点组间相比P <0.05
时间(周) A组 B组 C组 D组4 2.2 ±0.84Aa 7.8 ± 1.79Ba 7.4 ±1.95Ba 7.4 ±1.14Ba Ab 5 2.6 ±1.14Aa 5.8 ± 1.79Ba 6.4 ±1.52Bab 6.2 ±1.30Ba 6 1.8 ±0.84Aa 2.8 ± 0.84Ac 4.8 ±1.30Bb 3.4 ±1.14ABb 8 1.8 ±1.30Aa 2.2 ± 0.84Ac 4.4 ±1.34Bb 2.4 ±1.14

图8 各组牙周组织学观察(HE染色,×100,bar=150 μm)
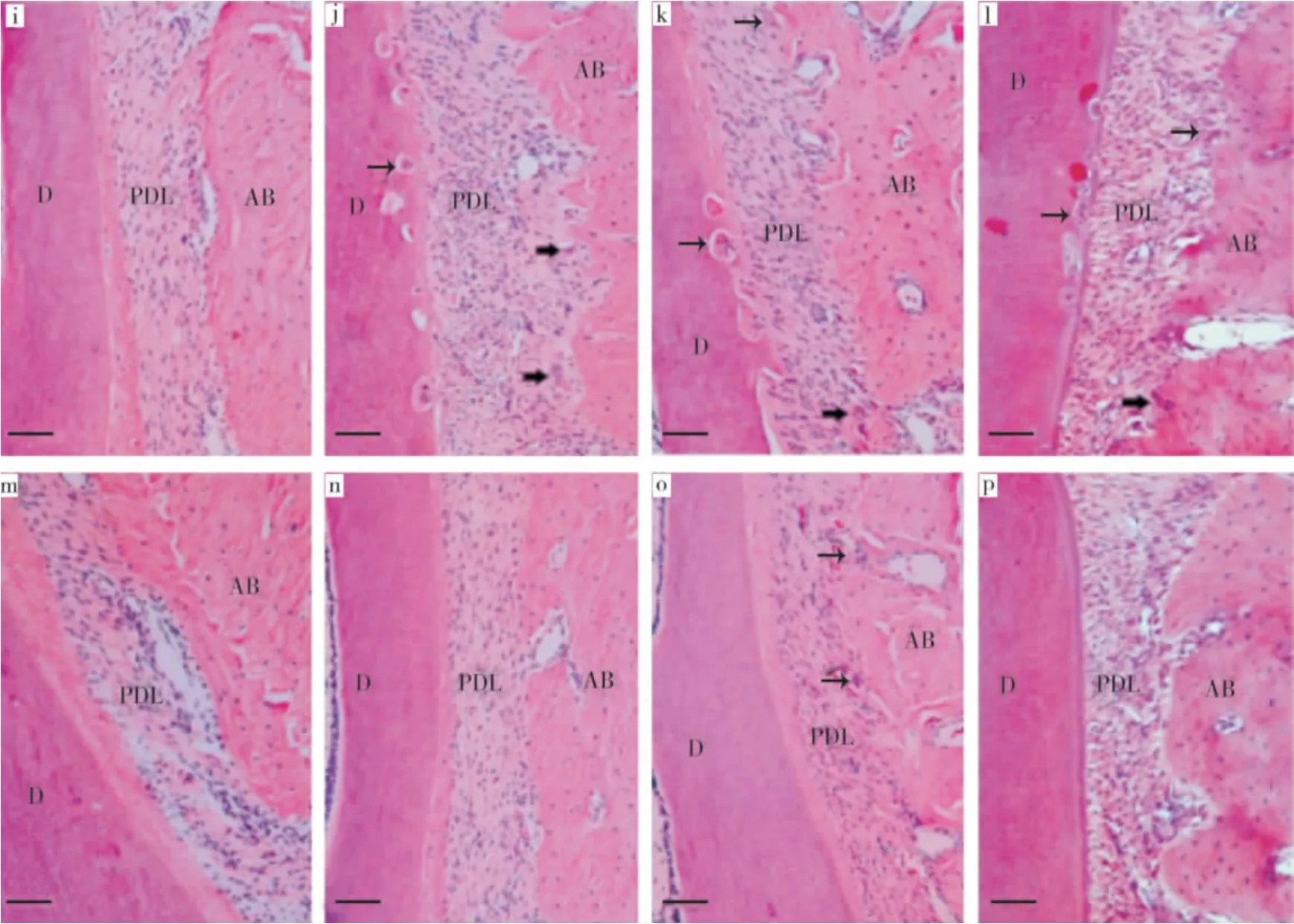
图9 各组破骨细胞情况(HE染色,×200,bar=100 μm)
3 讨论
随着社会的发展,生活压力的增加,人类承受着越来越多生理与心理上的应激。焦虑、抑郁、恐惧等不良心理状态引起的各种机能和代谢变化,成为许多疾病重要的促进因素。建立应激动物模型,对研究应激相关疾病有重要帮助作用。目前,动物心理应激方法有多种,目的是将动物置于不可避免的应激环境中,诱发其应激反应[9-10]。一般认为,机体受到心理应激刺激时,下丘脑-垂体-肾上腺轴(HPA轴)被激活,促进垂体分泌促肾上腺皮质激素,从而使糖皮质激素分泌增多[11]。而当一种应激源反复刺激机体时,HPA轴会产生去敏作用,动物表现为对刺激的耐受[12]。因此,为避免耐受,本研究采用慢性不可预知性应激,其特点是使用多种不同的应激方式,按照随机化方法应用于实验动物,并且从病因角度更好的模拟了心理疾病的发生[4-5]。结果表明,慢性不可预知性应激作用4周后,大鼠体质量增长减少,出现了焦虑、抑郁等行为异常表现,血清应激性激素皮质酮、促肾上腺皮质激素含量增加,且未出现耐受的表现。
采用丝线结扎诱导大鼠产生牙周炎是目前公认并且广泛应用的的牙周炎动物模型之一[3,13]。丝线结扎的局部压迫作用不仅能造成牙龈机械损伤,还能造成牙槽骨吸收;同时丝线能够促进局部菌斑形成与堆积,促进组织炎症反应,最终形成牙周炎。本研究对大鼠右上颌第二磨牙进行丝线结扎4周后,出现了明显的牙周损害,龈沟出血指数与牙周探诊深度与对侧相比均明显增加,组织切片表明结扎组出现牙槽骨丧失、牙龈炎症、破骨细胞活跃等,证实了该方法的的可靠性。
牙周炎是一个慢性炎症疾病,其病理发展分为活动期与修复期,在病损进展期,可见大量炎细胞浸润,牙槽骨吸收破坏明显,破骨细胞活跃,胶原纤维变性、溶解。在此阶段,若机体同时受到心理应激刺激,则会加重炎症的进程。有研究表明,心理应激能够影响牙周炎的发展[13-14]。而在经过较系统的基础治疗后,牙周炎进入修复愈合期,炎症区有新生的成纤维细胞,可见新生毛细血管、纤维结缔组织,而牙槽骨吸收处于静止状态,破骨细胞较少,原有的牙槽嵴顶部以及骨吸收陷窝区又有类骨质形成,牙根面的牙骨质也出现新生现象。有研究证实,用丝线结扎建立大鼠实验性牙周炎模型,在去除丝线后,牙周软组织损伤出现自我修复,牙槽骨出现改建[15-16]。本研究采用同样的方法模拟牙周炎从活动期进入修复期的过程,以观察心理应激对牙周炎愈合过程的影响。
有研究已表明[17],心理应激作为一种不良的外界因素,能够影响机体免疫系统以及白细胞活性,改变细胞因子释放水平,延迟成纤维细胞分化,从而延长了皮肤、黏膜伤口的愈合时间。在牙周炎的维护阶段,机体处于一个类似“从损伤到愈合”的阶段,此时若牙周支持治疗不完善,或受到局部或全身因素的影响,则极有可能引起病情反复。Axtelius等[18]发现,生活中承受更多心理压力或具有消极性格的牙周病病人比社会压力较少的病人牙周治疗效果差,预后不佳。本结果也发现,单纯牙周炎组在没有受到应激刺激时,病变组织得到了较好的恢复,而施加应激组则牙周组织修复较差,局部的炎症消除明显减慢,新生组织较少,牙槽骨仍可见部分破坏。有实验证实[19],皮质激素与儿茶酚胺类受体的激活是心理应激影响损伤愈合的重要原因。从本结果分析,心理应激组的皮质激素出现了明显升高,这也可能是心理应激影响牙周组织的修复、愈合进程的重要因素之一。
实验中还发现,应激对抗药物组大鼠体质量增长较应激组高,较少有行为异常表现,血清应激激素水平较应激组有所下降,牙周组织病变恢复亦较好。说明药物的应用能减轻应激的不良作用。Breivik等[20]研究表明,抗抑郁药噻萘普汀应用于抑郁模型大鼠,能够减轻抑郁状态对实验性牙周炎的影响。氟西汀属于抗抑郁、抗焦虑的经典药物,当机体受到应激时,交感神经兴奋,肾上腺素、去甲肾上腺素分泌增多,HPA轴激活使糖皮质激素分泌增多,抑制细胞免疫而增强体液免疫,改变了炎性细胞因子分泌状态[7],从而影响牙周炎的愈合过程。而氟西汀通过调节由应激引起的神经-内分泌效应,使大鼠机体免疫反应趋于正常,减轻心理应激以及其对牙周炎预后的不良影响。
本结果表明在牙周炎静止期,慢性不可预知性应激会影响牙周组织的愈合进程,减慢炎症的消除、骨组织的修复与重建,影响牙周炎的预后。药物对抗能够逆转心理应激对牙周炎愈合进程的影响。
[1]Amano A.Host-parasite interactions in periodontitis:microbial pathogenicity and innate immunity[J].Periodontol,2000.2010,54(1):9-14.
[2]Rosania AE,Low KG,McCormick CM,et al.Stress,depression,cortisol,and periodontal disease[J].J Periodontol,2009,80(2):260-266.
[3]Huang S,Lu F,Zhang Z,et al.The role of psychologic stressinduced hypoxia-inducible factor-1α in rat experimental periodontitis[J].J Periodontol,2011,82(6):934-941.
[4]Luo KR,Hong CJ,Liou YJ,et al.Differential regulation of neurotrophin S100B and BDNF in two rat models of depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2010,34(8):1433-1439.
[5]Yang C,Wang G,Wang H,et al.Cytoskeletal alterations in rat hippocampus following chronic unpredictable mild stress and reexposure to acute and chronic unpredictable mild stress[J].Behav Brain Res,2009,205(2):518-524.
[6]Li Q,Zhang M,Chen YJ,et al.Oxidative damage and HSP70 expression in masseter muscle induced by psychological stress in rats[J].Physiol Behav,2011,104(3):365-372.
[7]Gaspersic R,Stiblar-Martincic D,Skaleric U.Influence of restraint stress on ligature-induced periodontitis in rats[J].Eur J Oral Sci,2002,110(2):125-129.
[8]葛姝云,李德懿.应激对豚鼠牙周炎模型的影响[J].上海口腔医学,2003,12(1):30-33.
[9]Agrawal A,Jaggi AS,Singh N.Pharmacological investigations on adaptation in rats subjected to cold water immersion stress[J].Physiol Behav,2011,103(3-4):321-329.
[10]Peruzzo DC,Benatti BB,Antunes IB,et al.Chronic stress may modulate periodontal disease:a study in rats[J].J Periodontol,2008,79(4):697-704.
[11]Wagner KV,Wang XD,Liebl C,et al.Pituitary glucocorticoid receptor deletion reduces vulnerability to chronic stress[J].Psychoneuroendocrinol,2011,36(4):579-587.
[12]Rabasa C,Delgado-Morales R,Muňoz-Abellán C,et al.Adaptation of the hypothalamic-pituitary-adrenal axis and glucose to repeated immobilization or restraint stress is not influenced by associative signals[J].Behav Brain Res,2011,217(1):232-239.
[13]杜建东,余占海,杨倩,等.实验性牙周炎动物模型研究[J].实用口腔医学杂志.2007,23(6):801-804.
[14]Peruzzo DC,Benatti BB,Antunes IB,et al.Chronic stress may modulate periodontal disease:a study in rats[J].J Periodontol,2008,79(4):697-704.
[15]Cetinkaya BO,Keles GC,Ayas B,et al.The expression of vascular endothelial growth factor in a rat model at destruction and healing stages of periodontal disease[J].J Periodontol,2007,78:1129-1135.
[16]Coimbra LS,Rossa C Jr,Guimarǎes MR,et al.Influence of antiplatelet drugs in the pathogenesis of experimental periodontitis and periodontal repair in rats[J].J Periodontol,2011,82(5):767-777.
[17]Horan MP,Quan N,Subramanian SV,et al.Impaired wound contraction and delayed myofibroblast differentiation in restraint-stressed mice[J].Brain Behav Immun,2005,19(3):207-216.
[18]Axtelius B,Söderfeldt B,Nilsson A,et al.Therapy-resistantperiodontitis,psychosocial characteristics[J].J Clin Periodontol,1998,25(6):482-491.
[19]Eijkelkamp N,Engeland CG,Gajendrareddy PK,et al.Restraint stress impairs early wound healing in mice via alpha-adrenergic but not beta-adrenergic receptors[J].Brain Behav Immun,2007,21(4):409-412.
[20]Breivik T,Gundersen Y,Myhrer T,et al.Enhanced susceptibility to periodontitis in an animal model of depression:reversed by chronic treatment with the anti-depressant tianeptine[J].J Clin Periodontol,2006,33(7):469-477.
