骨髓间充质干细胞参与牙髓损伤修复的体内实验研究
2012-11-05郝靖惠白庆霞刘晓静
郝靖惠,杨 博,白庆霞,张 艳,刘晓静,陆 群
(第四军医大学口腔医学院,陕西西安 710032)
牙本质-牙髓复合体可适应各种刺激引发的防御反应,保存活力,而且其主要作用是分泌牙本质基质。牙齿发育完成后,牙髓仍通过内环境和自我保护机制起营养牙本质的作用,还能重新刺激牙本质生成来抵御外界伤害。牙髓的损伤修复取决于其受损程度,对于温和的刺激,修复涉及一个简单的成牙本质细胞生成牙本质活动的上调过程,即反应性牙本质生成过程;如遇到强烈的组织损伤,就会发生更复杂的防御修复反应,需要干/祖细胞的募集,分化为成牙本质样细胞,并上调牙本质基质的分泌活动,即修复性牙本质的生成过程。虽然在此过程中所涉及的分子也参与发育过程,但其和发育不同的是没有牙源性上皮与间充质相互作用的调节过程。对成牙本质细胞增殖分化的调节机制研究是将干细胞向临床治疗转化的关键。
Gronthos等(2000)首先提出成人牙髓中存在具备自我更新和多向分化潜能的前体细胞—牙髓干细胞(dental pulp stem cells,DPSCs),并证明其具有形成牙本质-牙髓样复合体的能力,认为牙髓干细胞在牙本质-牙髓的损伤修复中具有非常重要的作用[1]。目前,关于牙髓损伤修复的研究仅局限于牙齿本身,当牙髓损伤时,牙髓干细胞可分化为成牙本质样细胞,在损伤部位形成修复性牙本质而修复缺损,保护牙髓组织。然而,牙源性干细胞来源匮乏且扩增困难,而且牙齿是人体的器官之一,亦应考虑到其损伤后参与修复的全身性因素,如骨髓间充质干细胞,其具有自我更新及多向分化潜能,并在骨、软骨、心脏、神经、皮肤等损伤中发挥重要作用[2-6]。当牙髓损伤时,机体内骨髓间充质干细胞是否参与修复及其在修复中的作用尚未见报道。因此寻找非牙源性的间充质干细胞向成牙本质细胞方向分化参与牙本质缺损的修复就显得尤为重要。本研究利用GFP-BMMSCs嵌合SD大鼠牙本质缺损模型探讨BMMSCs是否参与牙髓损伤的修复。
1 材料和方法
1.1 主要材料和仪器
GFP转基因大鼠(第四军医大学组织工程中心提供);流式细胞仪(ELITEESP型,Beckman-Couher,美国);倒置荧光显微镜和照相系统(Olympus,日本);α-MEM 培养液(Gibco公司,美国);胎牛血清(Hyclone公司,美国);胰蛋白酶、Hoechst 33342(Sigma公司,美国);绿色荧光蛋白(GFP)多克隆抗体(Abcam,美国);FITC荧光二抗(Chemicon,美国)。
1.2 方法
1.2.1 GFP转基因大鼠 BMMSCs的培养
取3周龄GFP转基因大鼠2只,脱颈处死后750 mL/L乙醇浸泡10 min,无菌超净台内完整分离股骨、胫骨,剔净软组织,剪去骨骺端,5 mL一次性注射器吸取α-MEM培养液冲洗骨髓腔,冲出骨髓并转移至离心管中,反复吹打成全骨髓细胞悬液,800 r/min离心5 min,弃去上清,α-MEM 培养液重悬,接种至75 cm2培养瓶中,37℃、50 mL/L CO2培养箱中常规培养。48 h后首次换液,当细胞达到80%汇合时,胰酶消化传代。
1.2.2 GFP-BMMSCs嵌合 SD 大鼠模型的构建和构建后检测方法
取8周龄SD大鼠10只,随机抽取2只用于正常对照,其余8只用60Co-γ射线全身照射进行预处理,照射剂量为6 Gy。在照射完毕12 h后,24 h内经尾静脉注射SD大鼠裂红全骨髓细胞悬液与GFP大鼠骨髓间充质干细胞的混合液(1×108裂红全骨髓细胞+2×106GFP大鼠骨髓间充质干细胞)0.5 mL。
细胞移植后30 d,分别取嵌合大鼠及正常组大鼠外周血,经红细胞裂解后进行流式细胞术,检测其单核细胞中荧光细胞的比例然后脱颈处死所有大鼠,取其骨髓间充质干细胞,体外培养约5 d,待细胞汇合达60%时,流式细胞术检测骨髓间充质干细胞中荧光细胞所占的比例;同时取嵌合大鼠心脏、肝脏、肾脏,即刻送冰冻切片,Hoechest 33342衬染10 min,荧光显微镜下观察并照相。
1.2.3 GFP-BMMSCs嵌合 SD 大鼠牙本质缺损模型的构建及HE和免疫荧光染色观察
同上法制备9只GFP-BMMSCs嵌合大鼠,30 d后待移植的骨髓间充质干细胞完全嵌合,用10 g/L戊巴比妥钠液(3 mL/kg)腹腔注射麻醉,仰卧固定。750 mL/L乙醇棉球擦拭消毒左侧上颌磨牙区,用高速涡轮机和球钻在左侧上颌第一磨牙牙合面制造牙本质缺损,右侧上颌第一磨牙不做任何处理用于对照,每个牙合面缺损深度均控制在0.5~1 mm,且未见穿髓点。术后常规饲养,分别于术后5、10、15 d各处死3只大鼠,即刻分离上颌骨,40 g/L多聚甲醛固定24 h,170 g/L EDTA脱钙30 d,流水冲洗24 h后沿上颌第一磨牙矢状方向制作5 μm冰冻切片和常规石蜡切片,分别进行免疫荧光和HE染色,荧光显微镜和显微镜下观察并照相。
2 结果
2.1 GFP-BMMSCs嵌合大鼠模型的检测指标
2.1.1 嵌合大鼠外周血单核细胞及骨髓间充质干细胞中荧光细胞的比例
GFP-BMMSCs嵌合大鼠模型构建后30 d,外周血单核细胞中荧光细胞比例为7.9%(图1b),而正常大鼠仅为0.3%(图1a),嵌合大鼠BMMSCs中荧光细胞的比例为33.4%(图1d),而正常大鼠仅为0.7%(图1c)。
2.1.2 GFP-BMMSCs嵌合大鼠各脏器中荧光细胞的分布
嵌合大鼠心脏(图2a~b)、肝脏(图2c~d)、肾脏(图2e~f)中均发现有少量绿色荧光细胞,且出现在毛细血管周围。
2.2 GFP-BMMSCs嵌合SD大鼠牙本质缺损牙齿HE染色
正常对照组(图3a),牙髓组织由成牙本质细胞层、多细胞层和固有牙髓细胞构成,成牙本质细胞成柱状排列在髓腔内壁。缺损5 d组(图3b),牙髓组织成牙本质细胞层部分坏死,牙髓小血管扩张,炎症明显,缺损部位所对应的髓腔内壁出现修复性牙本质。缺损10 d组(图3c),缺损对应的髓壁处出现大量狭长形态的细胞层,髓室内小血管增生。缺损15 d组(图3d),牙髓炎症明显减轻,缺损部位所对应的髓腔内壁出现修复性牙本质。
2.3 GFP-BMMSCs嵌合SD大鼠牙本质缺损牙齿免疫荧光染色
正常对照组(图4a,b)髓腔内存在少量表达绿色荧光的细胞。缺损5 d组(图4c,d),髓腔内绿色荧光的细胞数量增加。缺损10 d组(图4e,f),髓腔内绿色荧光的细胞数量继续增加,并分布在缺损所对应的髓壁。缺损15 d组(图4g,h),髓腔内绿色荧光细胞数量较10 d组减少。
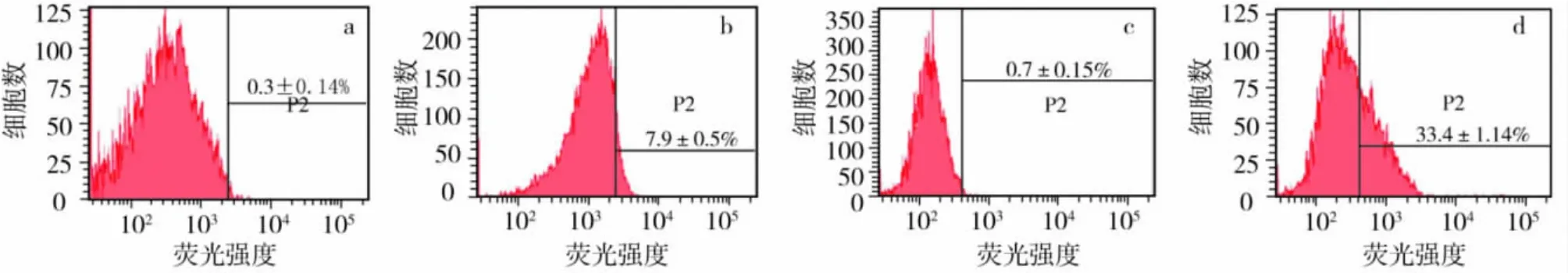
图1 流式细胞术结果

图2 冰冻切片结果(×200)

图3 HE染色结果
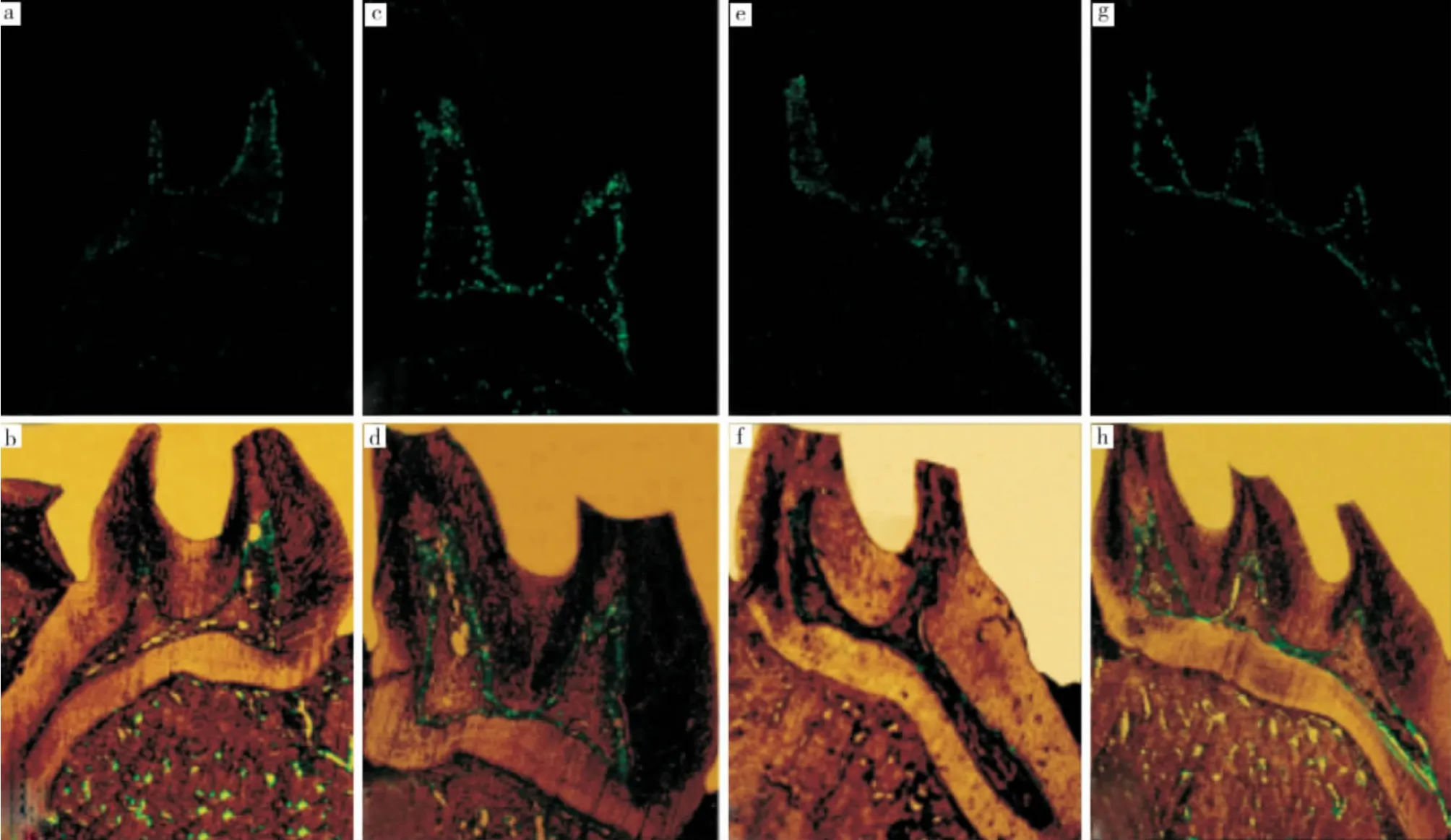
图4 免疫荧光染色结果(×40)
3 讨论
牙髓与牙本质在胚胎发生上联系密切,对外界刺激有互联效应,当牙本质缺损时,外界刺激必然会通过牙本质小管引起牙髓反应。当牙齿受到酸蚀、磨耗等进展缓慢的刺激,牙本质缺损程度较小时,成牙本质细胞合成分泌活动上调,分泌基质进而矿化形成反应性牙本质;而当牙齿受到牙折、深龋等强烈且进展快速的刺激,牙本质缺损程度较大时,会激发牙髓产生生物保护性反应为主的炎症反应,牙髓组织中有分化潜能的干细胞或前体细胞会分化为新的成牙本质细胞,分泌大量的细胞外基质并矿化形成修复性牙本质[7]。
骨髓间充质干细胞是存在于骨髓中的一种多能成体干细胞,能够自我更新,并具有多向分化的潜能[2],被认为是组织工程中的重要种子细胞。Mikako等研究发现骨髓间充质干细胞可以修复皮肤缺损[6];Beeres等利用骨髓间充质干细胞成功修复心肌损伤[8];于金华等已观察到BMMSCs具有形成牙本质-牙髓复合体样结构的能力[9]。以上研究均为干细胞修复组织缺损方面积累了一定的经验,也使得研究骨髓间充质干细胞对牙本质牙髓损伤进行修复成为牙齿损伤修复新的研究方向。绿色荧光蛋白(GFP)转基因大鼠为干细胞示踪提供了良好的动物来源,本课题组前期研究已经证明了GFP-BMMSCs体外扩增后持续稳定表达绿色荧光,并具有多向分化性,为后续实验提供了良好的示踪干细胞[10]。同时,体外实验中已经证明:骨髓间充质干细胞在牙胚细胞条件培养液的诱导下,可分化为成牙本质样细胞[11]。
以往利用GFP嵌合模型的研究中,有学者成功的观察到GFP标记的骨髓细胞迁移到骨折损伤部位、脑梗塞损伤区以及肾炎损伤区[3,12-13]。本研究于细胞移植后30 d通过流式细胞术检测GFP嵌合模型大鼠外周血单核细胞和骨髓间充质干细胞中荧光细胞的比例以及心脏、肝脏、肾脏等组织冰冻切片观察到荧光细胞的分布,证实了通过尾静脉注射的GFP-BMMSCs已嵌合至SD大鼠体内,且大部分细胞归巢到骨髓。本实验首次使用GFP-BMMSCs嵌合SD大鼠模型研究 BMMSCs在牙髓损伤修复中的作用,观察到在未造牙本质缺损的对照组,也有少量的荧光细胞的分布,这可能是由于60Co射线的照射对大鼠各组织器官造成一定的损伤,而与此相比,在牙本质缺损组,有更多的GFP-BMMSCs可迁移到损伤的牙髓部位,上述结果表明骨髓间充质干细胞与牙髓牙本质修复密切相关,因此,可考虑通过增强骨髓细胞的迁移分化能力来发展干细胞在牙髓损伤中的治疗。
本研究还发现在牙本质缺损15 d组,牙髓充血消失,牙髓组织已基本恢复正常,而荧光细胞的数量有所减少,推测可能是骨髓间充质干细胞修复损伤后又归巢到骨髓或者逐渐凋亡,目前,关于骨髓间充质干细胞在修复损伤后的去向问题尚无报道,还有待于进一步研究。
在目前已有的研究中,关于骨髓间充质干细胞对组织损伤修复的机制有两种不同的观点:有学者认为骨髓间充质干细胞是通过分化为损伤部位的细胞而参与修复的[3,6];另有学者则认为骨髓间充质干细胞是迁移到损伤部位通过分泌组织修复相关因子调节组织损伤处的炎症而参与损伤的修复[15]。有鉴于此,我们将继续利用 GFP-BMMSCs嵌合SD大鼠牙本质缺损模型来研究骨髓间充质干细胞修复牙髓损伤的具体机制。
已有研究证明:wnt信号通路在牙齿发育过程中起着重要作用。我们前期的体外研究也发现:经典wnt通路可能负向调节骨髓间充质干细胞向成牙本质样细胞的分化。据此提出假说:当牙本质缺损程度较重,致牙髓损伤时,能否通过抑制wnt通路来增强骨髓间充质干细胞向成牙本质样细胞的分化,从而促进牙本质-牙髓损伤的修复。故还将继续利用GFP-BMMSCs嵌合大鼠牙本质缺损模型研究wnt通路对机体内骨髓间充质干细胞的迁移以及在牙髓损伤修复中的作用,以期通过调节经典wnt通路来促进牙本质-牙髓损伤的修复,为将来临床治疗较严重的牙本质缺损提供新的治疗策略。
[1]Gronthos S,Mlankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci,2000,97(25):13625 - 13630.
[2]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[3]Taguchi K,Ogawa R,Migita M,et al.The role of bone marrow-derived cells in bone fracture repair in a green fiuorescent protein chimeric mouse model[J].Biochem Biophysical Res Co,2005,331(1):31-36.
[4]Taguchi K,Ogawa R,Migita M,et al.Mesenchymal stem cell injection after myocardial infarction improves myocardial compliance[J].Am J Physiol Heart Circ Physiol,2006,290(6):H2196-2203.
[5]Chiba Y,Kuroda S,Maruichi K,et al.Transplanted bone marrow stromal cells promote axonal regeneration and improve motor function in rat spinal cord injury model[J].Neumsurgery,2009,64(5):991-999.
[6]Sasaki M,Abe R,Fujita Y,et al.Mesenchymal stem cells are recruited into wounded skin and contribute to wound repair by transdifferentiation into multiple skin cell type[J].J Immunol,2008,180(4):2581-2587.
[7]彭彬.牙髓病学[M].北京:人民卫生出版社,2010:47-49.
[8]Beeres SL,Atsma DE,van der Laarse A,et al.Human adult bone marrow mesenchymal stem cells repair experimental conduction block in rat cardiomyocyte cultures[J].J Am Coll Cardiol,2005,46(10):1943 -1952.
[9]Yu JH,Wang YJ,Deng ZH,et al.Odontogenic capability:bone marrow stromal stem cells versus dental pulp stem cells[J].Biol Cell,2007,99(8):465 - 474.
[10]段晴月,董金山,陆群,等.绿色荧光蛋白转基因小鼠骨髓间充质干细胞的体外培养和鉴定[J].牙体牙髓牙周病学杂志,2010,20(4):196 -199.
[11]董金山,段晴月,陆群,等.骨髓间充质干细胞向成牙本质样细胞分化的体外实验研究[J].牙体牙髓牙周病学杂志,2010,20(4):192 -195.
[12]Tanaka R,Komine-Kobayashi M,Mochizuki H,et al.Migration of enhanced green fluorescent protein expressing bone marrow-derived microglia/macrophage into the mouse brain following permanent focal ischemia[J].Neuroscience,2003,117(3):531-539.
[13]Hayakaw M,Ishizaka H,Hayakawa J,et al.Role of bone marrow cells in the healing process of mouse experimental glomerulonephritis[J].Pediatr Res,2005 ,58(2):323 - 328.
[14]Wu YJ,Chen LW,Scott PG,et al.Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis[J].Stem Cells,2007,25(10):2648 -2659.
[15]Wise AF,Ricardo SD.Mesenchymal stem cells in kidney inflammation and repair[J].Nephrology,2012,17(1):1 - 10.
