炭疽双组分疫苗的研究
2012-11-04卢锦标王国治
魏 东 卢锦标 王国治
中国食品药品检定研究院,北京 100050
炭疽双组分疫苗的研究
魏 东 卢锦标 王国治▲
中国食品药品检定研究院,北京 100050
目的 通过研究由重组炭疽保护性抗原与灭活炭疽芽孢杆菌菌体抗原组成的炭疽候选疫苗免疫小鼠,对其免疫效果进行评价。 方法 将小鼠随机分成4个实验组,在免疫后不同时间点采血进行抗体检测、MTT法淋巴细胞增殖试验、ELISPOT法IFN-γ细胞因子的测定以及保护力试验。 结果 各组疫苗均能诱导较强的体液免疫应答。第3周rPA组及rPA+炭疽菌体组经rPA抗原刺激后的刺激指数均高于对照组(P<0.05)。ELISPOT结果显示,各实验组经特异性抗原刺激后均有较高的IFN-γ分泌。rPA抗原与炭疽菌体抗原有较好的保护力,由rPA与炭疽菌体组成的疫苗对炭疽活芽孢的攻击保护率为100%。 结论 由rPA抗原与灭活炭疽菌体抗原组成的新型炭疽疫苗能诱导小鼠产生体液免疫应答和细胞免疫应答,具有较好的保护力,该疫苗有希望成为新一代炭疽疫苗。
炭疽疫苗;保护性抗原;体液免疫;细胞免疫
我国现用炭疽疫苗为减毒活疫苗[1],成分为去除荚膜质粒pXO2的减毒活芽孢。该疫苗采用皮上划痕方式接种,难以保证有效接种剂量。活疫苗具有一定残余毒性,国外对该疫苗使用仍存在一定争议。目前,美国使用的炭疽疫苗为AVA疫苗,由炭疽培养液经除菌过滤后加氢氧化铝佐剂吸附制备而成,其主要成分是保护性抗原(protective antigen,PA)。该疫苗免疫程序周期过长,保护期短,需18个月内肌内注射5次,每年需加强免疫1次[2]。当前,对PA在新型炭疽疫苗设计中的主导作用已经达成共识,PA对疫苗的保护力起关键作用[3-5]。现有研究同时表明,活疫苗的保护效果好于以PA为主的炭疽疫苗,说明除PA外还有其他抗原成分对疫苗保护效果起重要作用[6]。
炭疽杆菌极有可能被用作生物战剂和制造生物恐怖[7],对社会稳定造成极大威胁,所以各国都在研制更为安全有效的新疫苗。炭疽芽孢杆菌在生命周期具有不同形态,从芽孢出芽增殖,到营养态菌体细胞,再到休眠体芽孢,可能存在不同的具有保护作用的抗原[8-11]。本研究以重组保护性抗原(recombinant protective antigen,rPA)为主要成分[12],加灭活入炭疽菌体抗原,设计新型炭疽疫苗,并以小鼠作为模型,对炭疽疫苗的免疫学作用进行初步研究,为新型炭疽疫苗的研制奠定基础。
1 材料与方法
1.1 仪器及试剂
Al(OH)3佐剂由兰州生物制品研究所有限责任公司菌苗二室提供,rPA抗原、灭活炭疽菌体抗原由中国食品药品检定研究院细菌一室提供。MTT(美国Sigma公司);辣根过氧化物酶标记羊抗小鼠IgG(北京中杉生物技术有限公司);ELISPOT小鼠IFN-γ检测试剂盒(瑞典Mabtech公司)豚鼠由中国食品药品检定研究院实验动物中心提供。MK3酶标仪(芬兰Labsystems Dragon公司)ELISPOT自动读板仪(美国CTL公司)。
1.2 分组及免疫
将80只6~8周龄的Balb/c小鼠,随机分为4组,每组20只。(1)Al(OH)3佐剂对照组;(2)rPA组(10 μg/0.2 mL/只);(3)炭疽菌体组(1亿菌 /0.2 mL/只);(4)rPA +炭疽菌体组(剂量同前)。分别在第0、2周免疫,注射部位均为后肢肌内。分别于第3、4周每组取5只动物进行检测。用淋巴细胞分离液分离脾脏淋巴细胞进行ELISPOT和MTT等细胞免疫应答的检测,将分离的血清做ELISA体液免疫应答的检测。
1.3 抗体检测
包被抗原,rPA包被浓度为5 μg/mL,炭疽菌体浓度均为1亿/mL,4℃过夜。封闭液封闭1 h后,每孔加入100 μL的50倍开始倍比稀释的待检血清,按ELISA操作步骤分别加入辣根过氧化物酶标记的羊抗小鼠IgG抗体,底物显色,终止反应,并在波长450 nm处检测吸光值A450。
1.4 淋巴细胞增殖试验(MTT法)
分离的外周血单个核细胞加入96孔细胞培养板,每孔加入100 μL 2.5×106/mL浓度的细胞,用完全培养液稀释rPA抗原为20 μg/mL,炭疽菌体抗原浓度均为0.1 亿/mL。试验孔各加100 μL,均做复孔,同时用完全培养液作阴性对照,ConA作阳性对照。在37℃,5%CO2的二氧化碳培养箱中培养3 d,每孔加入 15 μL MTT(5 mg/mL),于 37℃,5%CO2的二氧化碳培养箱中继续培养4 h,离心弃上清液,加入100 μL细胞裂解液后用酶标仪测定吸光值A570/630,测定波长570 nm,参考波长630 nm。计算复孔的A570/630平均值,计算刺激指数(SI),(SI=实验孔A570/630/阴性对照孔A570/630)。
1.5 脾淋巴细胞分泌细胞因子IFN-γ的测定
取96孔IFN-γ检测细胞培养板,细胞及抗原操作同1.4。于37℃,5%CO2的二氧化碳培养箱中孵育48 h后,按ELISPOT操作依次加入检查抗体等试剂,洗板,显色,计数斑点数。
1.6 保护力试验
第2次免疫后2周,每组取10只小鼠,腹腔注射弱毒株炭疽芽孢6亿/只。每天观察小鼠状态,连续观察14 d。
1.7 统计学处理
2 结果
2.1 抗体效价结果
2.1.1 抗rPA抗体结果 rPA组和rPA+炭疽菌体组均能诱导产生PA抗体,各组第4周的rPA抗体效价较第3周均有小幅增加。第3周rPA组小鼠血清中的rPA抗体高于rPA+炭疽菌体组(P<0.05)。第4周两组rPA抗体效价比较差异无统计学意义(P>0.05),见图1。

图1 抗rPA抗原IgG抗体效价
2.1.2 抗炭疽菌体抗体结果 炭疽菌体组和rPA+炭疽菌体组都可产生高效价的抗炭疽菌体抗体,且第4周较第3周抗体效价均有升高趋势,各组间比较差异均无统计学意义(P>0.05),见图2。

图2 抗炭疽菌体抗原IgG抗体效价
2.2 脾淋巴细胞增殖结果
第3周rPA组及rPA+炭疽菌体组经rPA抗原刺激后的刺激指数均高于对照组,差异均有统计学意义(P<0.05)。炭疽菌体组及rPA+炭疽菌体组经炭疽菌体抗原刺激后的刺激指数与对照组比较,差异无统计学意义(P>0.05),见图3。第4周各组间比较差别无统计学意义(P>0.05)。
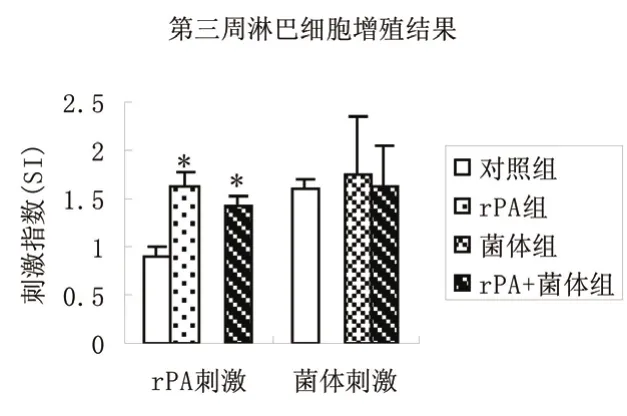
图3 第3周脾脏淋巴细胞增殖结果
2.3 ELISPOT测定IFN-γ结果
2.3.1 第3周ELISPOT结果 rPA组及rPA+炭疽菌体组经rPA抗原刺激后产生的斑点数均高于对照组,差异均有统计学意义(P<0.01)。炭疽菌体抗原的刺激作用较为强烈,由于孔中斑点数太多,仪器无法计数,见表1。

表1 第3周抗原刺激后IFN-γ斑点计数结果(2.5×105 cell)
2.3.2 第4周ELISPOT结果 除了rPA组,其他实验组经各种抗原刺激后产生的斑点数均高于对照组,差异均有统计学意义(P<0.01),结果见表2。

表2 第4周抗原刺激后IFN-r斑点计数结果(2.5×105 cell)
2.4 保护力试验结果
每只小鼠在6亿炭疽活芽孢的攻击下,除对照组外其余各组保护率均为100%,结果见表3。这表明,除rPA外,炭疽菌体抗原对小鼠的免疫保护也起着重要作用。

表3 小鼠攻毒试验结果(存活数/总数)
3 讨论
以PA为主要成分疫苗保护力来自其诱导产生的抗体对炭疽毒素的中和作用,但其对炭疽芽孢杆菌在体内的繁殖及毒素分泌没有直接抑制作用,而且炭疽毒素是由炭疽菌体分泌产生。如果疫苗中加能入抑制炭疽菌体繁殖的成分,有可能提高疫苗的保护效果[13-14]。本研究以PA为主要成分辅以灭活炭疽菌体抗原,设计新型炭疽疫苗,以小鼠作为模型,对新型炭疽疫苗的免疫学作用进行初步研究。
在细胞免疫检测方面采用了淋巴细胞转化试验和ELISPOT试验。淋巴细胞转化试验是通过检测特异性抗原刺激后细胞增殖来评价疫苗的细胞免疫应答。rPA抗原体外能刺激脾淋巴细胞增殖,第3周的试验中,rPA组和rPA+炭疽菌体组经rPA抗原刺激后的刺激指数均高于对照组。ELISPOT试验是通过检测特异性抗原刺激后分泌细胞因子的淋巴细胞数量来评价疫苗的细胞免疫应答。免疫后经不同刺激物刺激后产生的斑点数均高于对照组,说明新型疫苗能诱导较强的细胞免疫应答。通过ELISA方法测定抗体效价来评价体液免疫应答。对于主要在细胞外生长的细菌,有效的体液免疫应答能起到重要的保护作用。rPA组和rPA+炭疽菌体组均能诱导产生PA抗体。炭疽菌体可以诱导较强的体液免疫应答,炭疽菌体组和rPA+炭疽菌体组都可产生较高效价的抗炭疽菌体抗体。
保护力试验中每只小鼠腹腔注射6亿炭疽活芽孢进行攻击,除对照组外其余各组保护率均为100%。单纯的炭疽菌体能提供很好的保护作用,提示在以PA为主要成分的基础上,辅以灭活炭疽菌体成分,有可能提供更全面的保护。由于实验条件所限,攻毒菌株采用炭疽弱毒菌株,有待使用强毒株进行攻击试验来进一步验证新型炭疽疫苗的保护效果。但从目前的实验结果看来,rPA与灭活炭疽菌体抗原除成的双组分疫苗是一种有希望的炭疽疫苗。
[1] 国家药典委员会.中国药典(三部)[S].北京:中国医药科技出版社,2010:74-76.
[2] Pittman PR,Kim-Ahn G,Pifat DY,et al. Anthrax vaccine: immunogenicity and safety of a dose-reduction, route-change comparison study in humans[J].Vaccine,2002,20(9-10):1412-1420.
[3] Kaur M,Bhatnagar R.Recent progress in the development of anthrax vaccines[J].Recent Pat Biotechnol,2011,5(3):148-159.
[4] Peachman KK,Li Q,Matyas GR,et al. Anthrax vaccine antigen-adjuvant formulations completely protect New Zealand white rabbits against challenge with Bacillus anthracis Ames strain spores[J].Clin Vaccine Immunol,2012,19(1):11-16.
[5] Little SF,Ivins BE,Webster WM,et al. Effect of aluminum hydroxide adjuvant and formaldehyde in the formulation of rPA anthrax vaccine[J].Vaccine,2007,25(15):2771-2777.
[6] Little SF,Knudson GB.Comparative efficacy of Bacillus anthracis live spore vaccine and protective antigen vaccine against anthrax in the guinea pig[J].Infect Immun,1986,52(2):509-512.
[7] Inglesby TV,O'Toole T,Henderson DA,et al. Anthrax as a biological weapon,2002:updated recommendations for management[J].JAMA,2002,287(17):2236-2252.
[8] Gauthier YP,Tournier JN,Paucod JC,et al. Efficacy of a vaccine based on protective antigen and killed spores against experimental inhalational anthrax[J].Infect Immun,2009,77(3):1197-1207.
[9] Lee DY,Chun JH,Ha HJ,et al. Poly-gamma-d-glutamic acid and protective antigen conjugate vaccines induce functional antibodies against the protective antigen and capsule of Bacillus anthracis in guinea-pigs and rabbits[J].FEMS Immunol Med Microbiol,2009,57(2):165-172.
[10] Brahmbhatt TN,Darnell SC,Carvalho HM,et al. Recombinant exosporium protein BclA of Bacillus anthracis is effective as a booster for mice primed with suboptimal amounts of protective antigen[J].Infect Immun,2007,75(11):5240-5247.
[11] Brossier F,Levy M,Mock M.Anthrax spores make an essential contribution to vaccine efficacy[J].Infect Immun,2002,70(2):661-664.
[12] Jinbiao Lu,DongWei,YefuWang,et al. High-level expression and singlestep purification of recombinant Bacillus anthracis protective antigen from Escherichia coli[J].Biotechnol Appl Biochem,2009,52(Pt2):107-112.
[13] Cybulski RJ Jr,Sanz P,McDaniel D,et al. Recombinant Bacillus anthracis spore proteins enhance protection of mice primed with suboptimal amounts of protective antigen[J].Vaccine,2008,26(38):4927-4939.
[14] Enkhtuya J,Kawamoto K,Kobayashi Y,et al. Significant passive protective effect against anthrax by antibody to Bacillus anthracis inactivated spores that lack two virulence plasmids[J].Microbiology,2006,152(Pt10):3103-3110.
Research of the immunological response of anthrax candidate vaccine
WEI Dong LU Jinbiao WANG Guozhi
National Institutes for Food and Drug Control, Beijing 100050, China
ObjectiveTo evaluate the immune response of a new anthrax candidate vaccine,which is composed of recombinant PA antigen and somatic antigen of vegetative Bacillus anthracis.MethodsMice were randomly divided into four experimental groups, and they were tested at different times for serum ELISA,MTT cell proliferation, ELISPOT and efficacy test.ResultsELISA results showed that all groups can induce humoral immunoresponse. Lymphocyte proliferation was detected on the 3rd week in groups containing rPA. ELISPOT result showed that the number of spleen lymphocytes which secreted IFN-γ after stimulated with specific antigen was higher in experimental groups than control group. Mice immunized with rPA and somatic antigen were fully protected against an intraperitoneal challenge with live Bacillus anthracis spores.ConclusionThe new anthrax candidate vaccine composed of rPA and somatic antigen can induce significant humoral and cellular immune response, which would be a new generation of anthrax vaccine.
Anthrax vaccine; Protective antigen; Humoral immunity; Cellular immunity
R392
A
2095-0616(2012)11-24-03
国家科技重大专项课题(2009ZX10004-804)。▲
2012-04-18)
