氮、磷对富油荒漠微藻混养生长及总脂的影响
2012-11-02徐檬徐小琳李春
徐檬,徐小琳,李春,2
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,石河子832003;2北京理工大学生命学院,北京100081)
微藻生物柴油是一种优良的可再生新能源,对于解决人类面临的能源短缺和全球变暖两大危机具有潜在的重大战略意义,微藻能源的产业化已成为世界各国研究与发展的重点[1]。然而,目前的富油藻种在含油率和生长速率之间普遍存在着严重的矛盾[2],同时,对环境条件变化敏感,耐受性差;细胞个体小,细胞采收及油脂提取不方便等问题。这些矛盾和问题导致了微藻能源成本高、生产效率低,阻碍了微藻能源产业化的发展[3]。
荒漠微藻主要是指生长在荒漠化土地上的藻类。作为先锋拓殖生物,荒漠微藻生命力顽强,能够在条件恶劣的环境下生长、繁殖[4]。与传统用于生产油脂的微藻相比,荒漠微藻环境适应性强,可以耐受较大的温度变化、高盐碱度和强光辐射,因此适合于低成本的大规模户外培养。荒漠微藻的应用开发具有极大潜力,目前已经涉及到沙漠治理、食品、纺织、化妆品和医疗保健品等方面,但还没有将荒漠微藻用于开发生物能源的报道。因此,广泛筛选具有富油能力的荒漠微藻,对微藻生物柴油应用研究具有重要的意义。
本研究通过人工分离得到可进行混养生长的富油荒漠微藻,并对培养方式及培养基中的氮和磷对其生长和油脂积累的影响进行了研究,以期为富油荒漠微藻的进一步研究及大规模培养提供参考。
1 材料与方法
1.1 试验材料
土壤样品采集于新疆地区的戈壁、沙漠和盐碱地。
土壤样品经研磨后,称取10g溶于500mL无菌水中,纱布过滤4次以除去杂物,将过滤得到的澄清溶液以5%(V/V)的接种量接种到50mL BG11液体培养基中,在25℃、光照4500lx和光暗比(L∶D)12h∶12h的光照培养箱中富集培养15d,获得混合藻液。将藻液梯度稀释105至106倍,均匀涂布于含有1.3%琼脂的固体BG11培养基表面,在上述培养条件下倒置培养15d。挑取固体平板上的单藻落进行显微镜观察,纯种微藻接种至BG11液体培养基中,培养条件同上;不纯藻种继续重复上述稀释涂布过程,直至得到纯种藻株。
试验用BG11培养基[5]进行培养。
1.2 试验仪器与试剂
GXZ-380C智能光照培养箱(宁波东南仪器有限公司);UV2100紫外可见分光光度计(美国UNICO);80i荧光数码生物显微镜(日本 Nikon);FD-1-50冷冻真空干燥机(北京博医康实验仪器有限公司)。
试验中所用试剂均为分析纯,购于北京化工厂。
1.3 试验方法
所有试验除特殊说明之外,均在装液量为300 mL的500mL三角烧瓶中进行。
以培养至指数生长期的藻液为种子液,调整其初始密度为OD670=0.2,以10%(V/V)接种量接种后,置于温度25℃、光照4500lx、光暗比(L∶D)12 h∶12h的光照培养箱中培养,每天定时摇瓶3或4次。同时,定期采用显微镜进行观察以确定微藻是否正常生长或是否存在杂菌污染现象。
1.3.1培养方式对微藻生长和油脂积累的影响
取种子液,自养培养接种于BG11液体培养基,异养和混养培养接种于含有10g/L葡萄糖的BG11液体培养基;自养和混养培养的培养条件如前所述,异养培养组置于无光照的25℃恒温培养箱中培养。
1.3.2混养氮浓度对微藻生长和油脂积累的影响
取种子液,分别接种于氮浓度为50、100、200、400、800、1600mg/L的含有10g/L葡萄糖的BG11液体培养基,置于光照培养箱中培养。
1.3.3混养磷浓度对微藻生长和油脂积累的影响
取种子液,分别接种于磷浓度为2、4、8、16、32 mg/L的含有10g/L葡萄糖的BG11液体培养基,置于光照培养箱中培养。
1.3.4氮磷比(mol∶mol)对微藻生长和油脂积累的影响
以磷酸氢二钾为磷源,固定硝酸钠使氮浓度为200mg/L,取种子液,分别接种于氮磷比为17.1、34.2、68.3、136.7、273.3的含有10g/L葡萄糖的BG11液体培养基,置于光照培养箱中培养。
1.4 测量指标及方法
1.4.1生物量
采用干重法,培养液于稳定期第4天8000r/min下离心5min,收集微藻细胞,蒸馏水洗涤1次,冷冻干燥至恒重。
采用下式计算生物量:

1.4.2细胞密度
用无菌水将微藻溶液按浓度梯度稀释,测定藻液在670nm处的吸光值(OD670),并用血球计数板计数微藻个数,建立微藻细胞密度与吸光度OD670的标准曲线,曲线方程如下:

式(2)中:X为微藻的吸光值OD670,Y 为微藻细胞密度(×107个/mL),R2=0.995。
1.4.3油脂的提取与测定
微藻细胞破碎采用酸热法[6],油脂提取采用氯仿-甲醇法[7]。用以下公式计算油脂含量:


2 结果与分析
2.1 富油荒漠微藻的筛选
经过3次分离纯化得到113株纯种微藻,经形态学鉴定全为绿藻门,其中球藻属43株,栅藻属70株。在自养培养条件下,113株荒漠微藻的含油量在10%~24%,生物量产率在10mg/(L·d)~24 mg/(L·d),油脂产率在1.5mg/(L·d)~4.6 mg/(L·d)之间。选择其中油脂产率较高的13株藻种进行进一步自养、混养培养研究,结果见表1。
由表1可知:藻株11在自养和混养培养方式下油脂产率均高于其他藻株,故选择11号藻株为目的藻株进行后续试验。该藻株细胞为球状,单细胞,细胞壁薄;具有一个明显的细胞核。直径5μm~8μm之间。生殖个体直径较大,无性生殖产生似亲孢子。根据《中国淡水藻类—系统、分类及生态》进行检索分类[8],初步鉴定其为蛋白核小球藻 (Chlorella pyrenoidosa)。
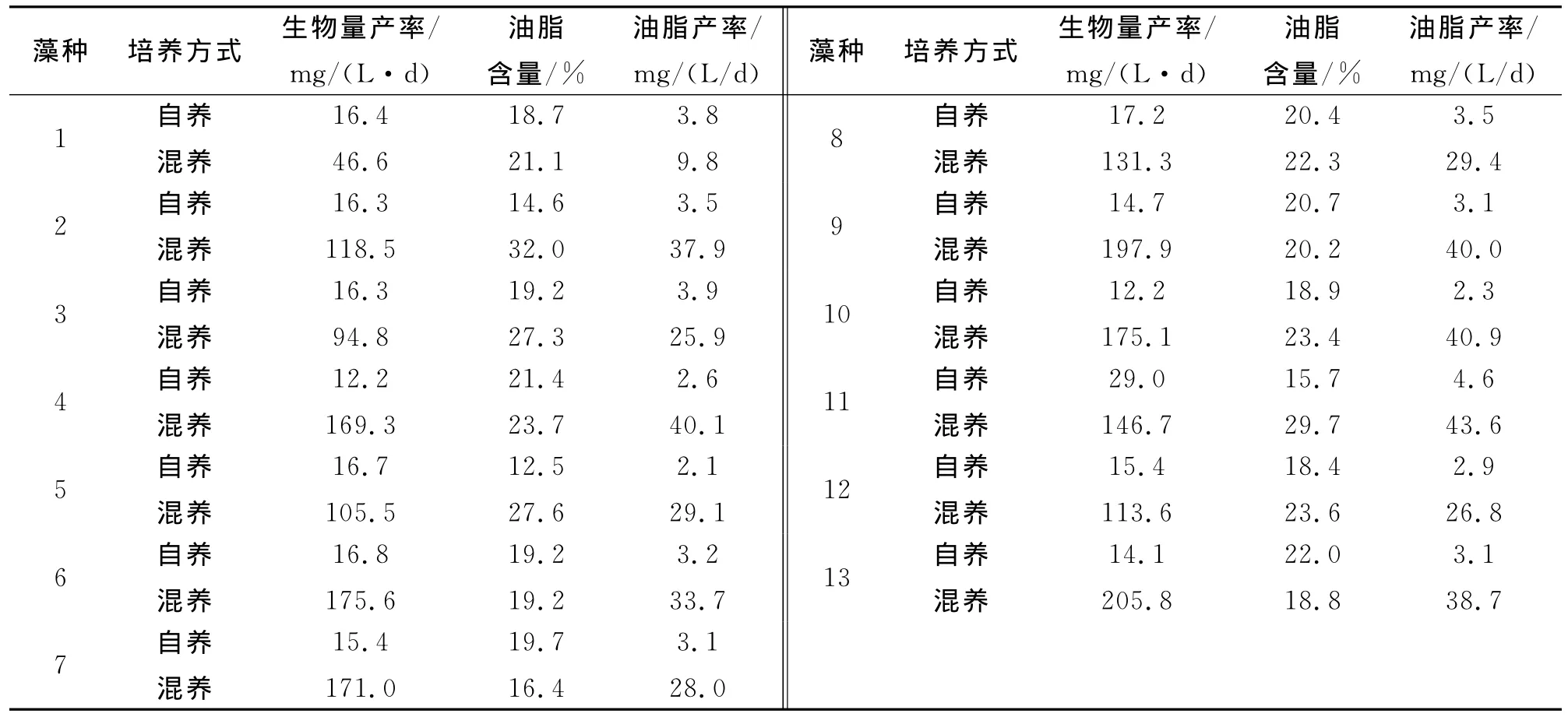
表1 荒漠微藻生物量及油脂含量测定结果Tab.1 The biomass and lipid content of desert microalgae
2.2 培养方式对荒漠微藻C.pyrenoidosa生长和油脂积累的影响
微藻根据其营养方式分为光能自养、化能异养2种,相应地其培养方式可分为光能自养型、异养型和混养型3种,培养方式的不同对微藻油脂含量与组成有较大影响。研究考察荒漠微藻C.pyrenoidosa在3种不同培养方式下的生长及油脂积累情况,结果如图1所示。
兴趣点,就是目标要向主体本身的学习、生活兴趣靠近。只有和兴趣相近的目标,才能激发主体更大的动力,获得更多的可能性。据调查,主体对目标有兴趣,那目标达成的可能性比对目标没有兴趣达成的可能性高两倍以上。

图1 不同培养方式对荒漠微藻C.pyrenoidosa的生长及油脂积累的影响Fig.1 Effect of different cultivation methods on the growth and lipid accumulation of desert microalgae C.pyrenoidosa
由图1a可知:荒漠微藻C.pyrenoidosa在异养和混养方式下的延滞期较短,而在自养方式下的延滞期较长。在异养和混养方式下该藻可以较快的达到稳定期,培养15d即可达到最大细胞密度,而在自养方式下该藻生长缓慢,需要近60d才能达到稳定期,且细胞密度较低。在混养方式下指数生长期的生长速率最大,15d即可获得最高的细胞密度3.5×107个/mL,而在异养和自养方式下细胞密度较低。
由图1b可知:混养培养时荒漠微藻C.pyrenoidosa的生物量产率是自养培养的5.3倍,油脂含量最高达30.0%,比自养培养增加了91.1%。异养培养时油脂含量比自养培养时增加了49.0%,但生物量产率有所降低。
微藻油脂产率由生物量和油脂含量共同决定,因此,尽管异养培养时荒漠微藻C.pyrenoidosa的含油量较高,但是低生物量导致其应用价值较低。Tamarys等[9]研究也发现,在混养条件下普通小球C.vulgaris的生物量浓度为自养条件下的3.5倍。这是由于在自养培养时,微藻细胞密度的增加致使培养核心区域的遮光效应增大,光衰减现象严重,光合作用效率降低,导致微藻细胞生长变缓,生物量和油脂产率均较低。
异养培养时,微藻可以利用葡萄糖进行生长代谢,启动了不同的代谢途径,使油脂含量提高,但可能由于光照对微藻的生长起着重要作用,因此在黑暗环境中异养培养时,其生长和油脂的积累受到明显抑制。
混养培养时,微藻一方面能利用光能和CO2进行光合作用进行自养代谢,另一方面又能以有机碳作为补充碳源和能源进行异养代谢,因此,光照和有机碳源的联合作用促进了微藻细胞的生长和油脂积累。故选择混养培养方式进行后续试验研究。
2.3 混养氮浓度对荒漠微藻C.pyrenoidosa生长和油脂积累的影响
氮是影响微藻生长及代谢最主要的因素之一,微藻对氮盐的喜好和利用能力因种而异。氮浓度的变化对藻细胞内的脂质含量、组成具有显著影响[10]。
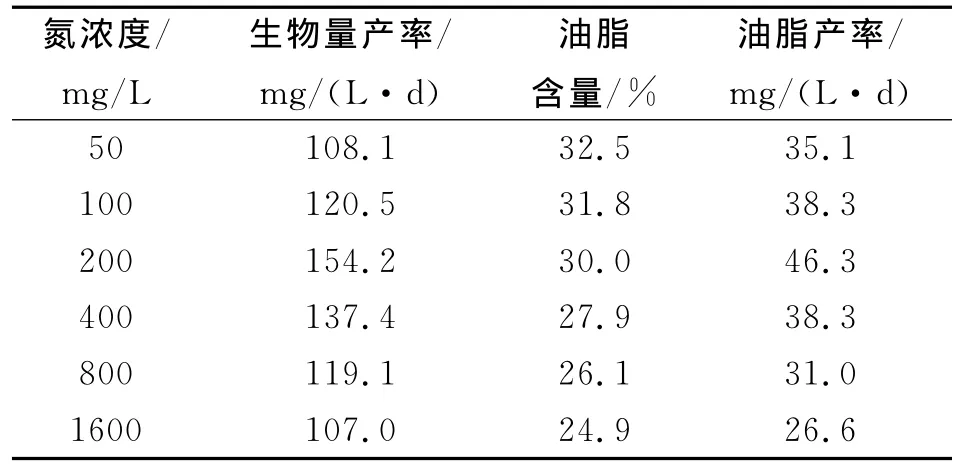
表2 氮浓度对荒漠微藻C.pyrenoidosa生长和油脂积累的影响Tab.2 Effect of nitrogen concentration on the growth and lipid accumulation of desert microalgae C.pyrenoidosa
由表2可知:当氮浓度在50~200mg/L时,荒漠微藻C.pyrenoidosa的油脂产率及生物量产率均随着氮浓度的升高增加,但当氮浓度大于200mg/L时油脂产率及生物量产率随着氮浓度升高而减少。油脂产率及生物量产率均在氮浓度为200mg/L时达到最大值,分别为46.3mg/(L·d)和154.2mg/(L·d)。油脂含量随着氮浓度的升高而降低,在氮浓度为50mg/L达到最高32.5%。表明荒漠微藻C.pyrenoidosa在低氮条件下能大量积累油脂,与目前许多小球藻研究报道相一致。
Illman等[11]将5株小球藻培养在低氮条件下,除一株小球藻油脂含量并没有显著提高外,其余4株油脂含量均提高了约1倍。Arief等[12]研究也表明正常生长的普通小球藻C.vulgaris在经过一段时间的缺氮培养后,油脂含量也有所提高。一般氮源浓度增加时,蛋白质含量提高,而油脂和碳水化合物的含量降低。油脂作为微藻细胞主要的储能物质,在适宜的生长条件下并不会在胞内大量积累油脂。氮缺乏可导致微藻蛋白质含量降低,而碳水化合物或油脂含量升高。氮胁迫虽然可以大幅度提高微藻胞内油脂的含量,但同时微藻的生长也受到了限制,生物量较低,油脂产率因而并没有得到大幅度的提高。氮过量会抑制微藻细胞生长,这可能是由于营养盐浓度过高,会造成盐度升高,引起细胞渗透压变化。因此,荒漠微藻C.pyrenoidosa的最优混养氮浓度为200mg/L。
2.4 混养磷浓度对荒漠微藻C.pyrenoidosa生长和油脂积累的影响
磷也是微藻生长所需的一种基本营养元素。磷是细胞能量转换的重要元素,也是细胞膜和核酸的重要组成成分。磷在微藻细胞碳、氮代谢活动中起着重要的作用。
本研究考察了不同磷浓度对荒漠微藻C.pyre-noidosa的生长及油脂积累的影响,结果如图2所示。
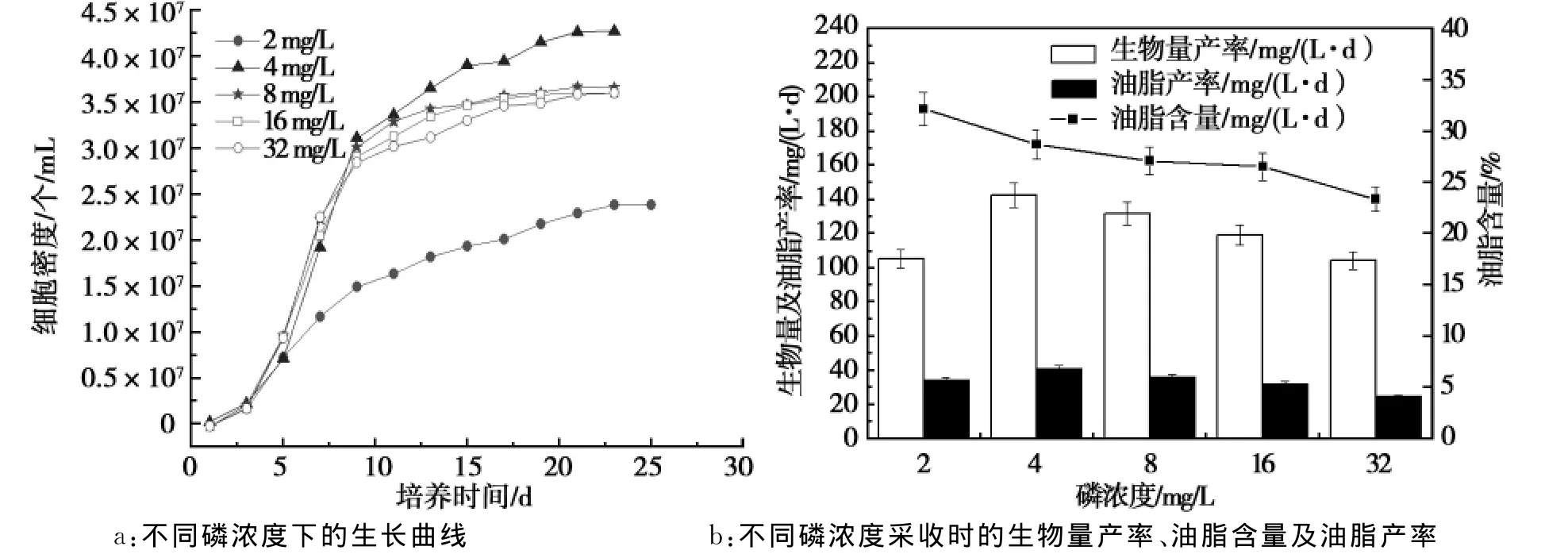
图2 磷浓度对荒漠微藻C.pyrenoidosa的生长及油脂积累的影响Fig.2 Effect of phosphorus concentration on the growth and lipid accumulation of desert microalgae C.pyrenoidosa
由图2可知:当混养培养基中的磷浓度高于或低于4mg/L时,荒漠微藻C.pyrenoidosa生长均受到磷浓度的限制,在磷浓度为4mg/L时,细胞密度可以达到最高4.3×107个/mL(图2a),油脂产率及生物量产率也达到最高,分别为40.9mg/(L·d)及142.5mg/(L·d)(图2b)。在低磷浓度时荒漠微藻C.pyrenoidosa油脂含量较高,随着磷浓度增大油脂含量降低,当磷浓度在2mg/(L·d)时,油脂含量最高可达32.2%,但生物量受磷浓度限制,造成综合油脂产率不高。当磷浓度在4~32mg/L范围内时,生物量产率随磷浓度增大而降低。
其原因可能是由于磷缺乏会限制H+-ATP酶的活性,不利于细胞内ATP的合成,细胞代谢活性降低,从而严重影响细胞的生长[13]。高磷条件会增强细胞的代谢活性,提高光合作用效率,故具有较快的生长速率和较大的生物量。但磷含量过高的条件下的生物量降低,这可能是由于在生长后期,氮源被耗尽,N/P比例失调,不利于藻细胞的分裂。磷不仅参与碳水化合物在藻细胞不同细胞器之间的重新分配,还参与能量的代谢,如ATP[14]。磷胁迫条件下也能降低微藻蛋白质的含量并增加油脂的含量,但其影响因种而异。有研究表明磷限制条件下,角毛藻、鲁兹巴夫藻、栅藻的油脂含量增加。但也有微藻如微绿球藻、融合微藻和绿色鞭毛藻中,磷限制反而导致油脂含量降低[15]。因此,荒漠微藻C.pyrenoidosa的最优混养磷浓度为4mg/L。
2.5 氮磷比(mol/mol)对荒漠微藻 C.pyrenoidosa生长及油脂积累的影响
有研究[16]表明,藻细胞的生长代谢特性不仅与环境中的营养盐浓度有关,而且与N/P比值有很大关系。本研究考察了不同N/P比(mol∶mol)对荒漠微藻C.pyrenoidosa细胞生长和油脂积累的影响,结果见图3所示。
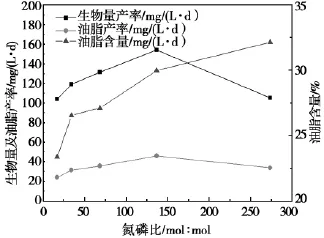
图3 氮磷比对荒漠微藻C.pyrenoidosa生长和油脂积累的影响Fig.3 Effect of N/P on biomass and lipid accumulation of desert microalgae C.pyrenoidosa
由图3可见:在N/P=136.7时可获得获得最大生物量产率和油脂产率;随着N/P的升高,细胞的油脂含量持续升高,N/P值从15增加到280时,油脂含量从占干重的23.4%升至32.2%左右。N/P在15~35时,油脂含量增加最快;而在N/P>35时增加含氮量油脂含量增加趋势减缓。
上述试验结果表明,在N/P<136.7时,氮源是藻细胞生长的限制因素,氮源的增加可明显促进藻的生长。但当N/P>136.7时达到氮饱和状态,细胞的生长不再取决于氮源,而是取决于磷浓度。
Craggs[17]的研究表明微藻的化学组成为C∶N∶P=106∶16∶1(原子比值),故后来的学者多以16∶1作为微藻生长的最适氮磷比例,但其忽略了微藻在不同的生长过程中对营养盐的需求各不同。从荒漠微藻C.pyrenoidosa的生长速率、生物量和油脂积累量等多方面考虑,本研究结果表明:该藻混养生长的适宜N/P约为137,要远高于一般藻类最适生长N/P标准16。可能是在微藻进行混养时,细胞增长迅速,细胞中的蛋白质、核酸等物质大量合成,需要消耗大量的氮磷。因此,综合考虑生物量产率和油脂产率确定最优N/P为136.7。
3 结论
(1)从新疆地区荒漠化土样中筛选出一株高产油荒漠蛋白核小球藻(Chlorella pyrenoidosa),在自养条件下其生物量产率及油脂产率分别可达29.0 mg/(L·d)和4.6mg/(L·d)。
(2)荒漠微藻C.pyrenoidosa的最适培养方式为混养培养。
(3)氮磷限制均有利于荒漠微藻C.pyrenoidosa总脂的积累,但不利于其生长,综合考虑油脂产率,荒漠微藻C.pyrenoidosa混养最优氮浓度为200mg/L;最优磷浓度为4mg/L;最优氮磷比为136.7,此时生物量产率和油脂产率分别为优化前的5.3倍和10.1倍。
[1]Evan Stephens,Ian L Ross,Jan H Mussgnug,et al.Future prospects of microalgal biofuel production systems[J].Trends in Plant Science,2010,15(10):554-564.
[2]姜进举,苗凤萍,冯大伟,等.微藻生物柴油技术的研究现状及展望[J].中国生物工程杂志,2010,30(2):134-140.
[3]Octavio Perez-Garcia,Froylan MEEscalante,Luz Ede-Bashan,et al.Heterotrophic cultures of microalgae metabolism and potential products[J].Water Research,2011,45:11-36.
[4]陈兰周,刘永定,李敦海,等.荒漠藻类及其结皮的研究[J].中国科学基金,2003(2):90-93.
[5]Rippka,R,Deruelles,J,Waterbury,J,et al.Generic assignments,strain histories and properties of pure cultures of cyanobacteria[J].Journal of General Microbiology,1979,111:1-61.
[6]曹健,汪晨辉,曾实,等.卷枝毛霉 Mucor circinelloides 3.2208油脂几种提取方法的比较[J].中国油脂,2004,29(4):38-40.
[7]Bligh E G,Dyer W J.A rapid method of the total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[8]胡鸿钧.中国淡水藻类—系统、分类及生态[M].北京:科学出版社,2006:605.
[9]Tamarys Heredia-Arroyo,Wei Wei,Roger Ruan,et al.Mixotrophic cultivation of Chlorella vulgaris and its potential application for the oil accumulation from nonsugar materials[J].Biomass and Bioenergy,2011,35:2245-2253.
[10]Rodolfi L,ZittellivC G,Bassi N,et al.Microalgae for oil:strain selection,induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J].Biotechnology and Bioengineering,2009,102(1):100-112.
[11]Illman A M,Scragg A H,Shales S W.Increase in Chlorella strains calorific values when grown in low nitrogen medium[J].Enzyme and Microbial Technology,2000,27(8):631-635.
[12]Arief Widjaja,Chao Chang Chien,Yi Hsu Ju.Study of increasing lipid production from fresh water microalgae Chlorella vulgaris[J].Journal of the Taiwan Institute of Chemical Engineers,2009,40(1):13-20.
[13]Khozin-goldberg I,Cohen Z.The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monadus subterraneus[J].Phytochemistry,2006,67(7):696-701.
[14]Merzlyzak M N,Chivunova O B,Gorelova O A,et al.Effect of nitrogen starvation on optical properties,pigments and arachidonic acid content of the unicellular algaParietochloris incisa(Trebouxiophyceae,Chlorophyta)[J].Journal of Phycology,2007,43(4):833-843.
[15]Reitan K I,Rainuzzo J R,Olsen Y.Effect of nutrient limitation on fatty acid and lipid content of marine microalgae[J].Journal of Phycology,1994,30(6):972-979.
[16]Asterio Sanchez Miron,Marie-Carmen Ceron Garcla,Francisco Garcla Camacho et a1.Growth and biochemical characterization of microalgal biomass produced in bubble column and airlift photobioreactors:studies in fed-batch culture[J].Enzyme and Microbial Technology,2002,31:1015-1023.
[17]CraggsRJ.Advanced integrated wastewater ponds[C]//ShiltonA.Pond Treatment Technology,IWA Scientifc and Technical Report Series,London:IWA,UK,2005:282-310.
