黄瓜花叶病毒和番茄花叶病毒双价抗性RNA沉默表达载体的构建
2012-11-02秦荣张伟刘炜炜张建云黄家风
秦荣,张伟,刘炜炜,张建云,黄家风
(石河子大学绿洲农作物病害防控重点实验室,石河子832003)
黄瓜花叶病毒(Cucumber mosaic virus,CMV)是一种寄主范围非常广范的植物病毒,能够侵染85科365属1000多种单子叶植物和双子叶植物,并且常与其它病毒以复合侵染的方式危害不同的作物。CMV与番茄花叶病毒(Tomato mosaic virus,ToMV)复合侵染是造成新疆加工番茄坏死条斑病的重要因素[1-2],严重影响其品质和产量。利用基因工程原理将病毒本身的一些基因转化至植物基因组中获得抗性植株是当前病毒病防治的主要途径。
转录后基因沉默是植物在进化过程中形成的针对外源核酸分子入侵(如病毒侵入、转基因和转座子)的自我防卫机制,在dsRNA的诱导作用下,能够高效、特异地降解与dsRNA同源的mRNA分子。如果将植物病毒的cDNA片段构建成能编码dsRNA或自我互补的发夹型RNA(hpRNA)结构,将其导入植物就能诱导植物发生高效的基因沉默,降解与双链同源的病毒RNA分子,便可获得抗病的转基因植物[3-4]。利用该方法,Wang等[5]将大麦黄矮病毒(BYDV)的多聚蛋白基因构建成反向重复序列转入大麦,Hu等[6]将CMV的CP基因、晏立英等[7]将花生条纹病毒(PStV)的CP基因分别构建成反向重复序列转入烟草,分别获得高效的抗病毒转基因植株。由于田间病毒往往以复合侵染的方式危害,因此构建针对2个或多个病毒的沉默表达载体已成为利用该原理进行转基因的迫切需要。
本研究以严重危害新疆加工番茄的2种病毒CMV与ToMV为目标,通过重组PCR技术将ToMV部分移动蛋白基因(△MP)和CMV的部分复制相关蛋白基因(Rep)进行融合,并将其以反向重复的方式插入到内含子两侧,构建到植物表达载体上,为进一步转化植物和利用RNA沉默原理进行植物广谱抗病研究奠定基础。
1 材料与方法
1.1 材料
大肠杆菌DH5α、植物表达载体pBIN438、含黄瓜花叶病毒(CMV)复制酶Rep基因的质粒pMD-Rep、含番茄花 叶病毒 (ToMV)运动 蛋白(MP)基因的质粒pMD-MP由本实验室提供;含有正向大豆内含子的pBlue SK重组质粒pBlue SKIntron由丹麦科学家I.Elisabeth Johansen惠赠(以下记作pSK);pMD18-T Vector、各种限制性内切酶、T4DNA连接酶,Taq DNA聚合酶、dNTP等购自宝生物工程(大连)有限公司;质粒小量制备试剂盒、胶回收试剂盒为北京鼎国昌盛生物技术有限责任公司产品;PCR引物由华大基因科技股份有限公司合成;其余试剂为进口或国产分析纯化。
1.2 △MP-Rep融合基因的获得
根据ToMV MP基因和CMV Rep基因序列分别设计特异性引物 MP-F和Rep-R,中间引物 M-R和R-M。其序列见表1。

表1 PCR扩增所用引物序列Tab.1 Sequences of primer pairs for PCR amplification
基因融合分两步进行,首先以pMD-MP为模板,以MP-F和M-R为引物,扩增ToMV的MP基因片段;以pMD-Rep为模板,以R-M 和 Rep-R为引物扩增CMV的Rep基因片段。PCR反应参数设置如下:94℃5min,94℃30s,56℃45s,72℃1min,30个循环,72℃10min。然后将上述获得的2个PCR产物混合作为模板,以△MP-F和Rep-R为引物进行PCR扩增,获得ToMV和CMV的融合基因,记作△MP-Rep。
PCR反应体系:模板各加1μL;引物各为0.5 μL(浓度为20μmol/L);PCR Mix 12.5μL;双蒸水9.5μL。PCR扩增反应参数设置如下:94℃5 min,94℃30s,53℃45s,72℃1min,30个循环,72℃10min。利用琼脂糖凝胶电泳分离上述PCR扩增产物,割胶回收。
1.3 dsRNA介导融合基因的沉默表达载体的构建
将上述PCR扩增到的融合基因△MP-Rep克隆到载体pMD18-T上,通过PCR筛选目标基因以正向方式插入的克隆。
用限制性内切酶KpnⅠ和XhoⅠ切取融合基因△MP-Rep,将其连接到用同样酶切开的pBlue SKIntron载体的Intron下游,获得中间质粒,记作pSK△MP-Rep-K;用限制性内切酶BamHⅠ和PstⅠ切取融合基因△MP-Rep,将其连接到用同样酶切下的pBlue SK-Intron载体的Intron上游,获得中间质粒,记做:pSK-△MP-Rep-B。然后用限制性内切酶KpnⅠ和PstⅠ从pSK△MP-Rep-K上切下Intron和△MP-Rep片段,插入用同样酶切开的pSK-△MP-Rep-B(切去了Intron)上,获得被Intron隔开的正、反向插入了△MP-Rep的重组质粒,记作pSK-Intron△MP-Rep(i/r)。最 后 用 BamHⅠ 将pSK-Intron△MP-Rep(i/r)上包含Intron在内的反向重复融合基因切下,插入用同样酶切且已去磷酸化的双元表达载体pBIN438上,筛选转化重组体得到△MP-Rep基因的反向重复植物表达载体pBIN438-△MP-Rep(i/r)。
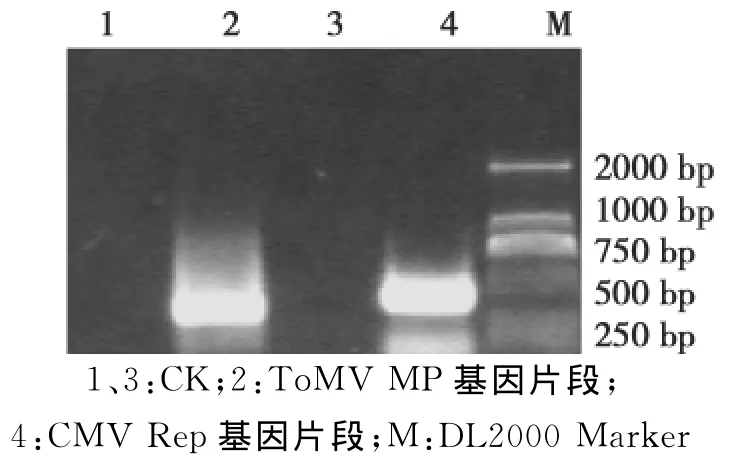
图1 △MP基因和△Rep基因的PCR扩增Fig.1 PCR amplification of△MP gene and△Rep gene
2 结果与分析
2.1 目标基因的获得
2.1.1单个基因片段的获得
以pMD-MP为模板,MP-F和 M-R为引物,扩增得到约340bp大小的目标条带,克隆测序后明确该片段为ToMV的MP基因片段,大小为332bp(图1);以 pMD-Rep为模板,Rep-R 和 R-M 为引物,扩增到约380bp的目标条带,克隆测序后明确该片段为CMV的Rep基因片段,为379bp(图1)。
2.1.2融合基因的获得
将上述获得的2个单基因片段同时作为模板,以MP-F和Rep-R为引物,通过重组PCR获得约720bp的目标条带,将其克隆到pMD18-T上,经测序和序列分析后明确该片段为ToMV MP基因和CMV Rep基因的融合片段,大小为711bp,记作△MP-Rep(图2)。为此获得含有ToMV和CMV 2个植物病毒基因的融合基因。
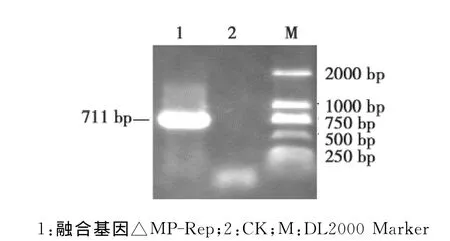
图2 融合基因的△MP-Rep的PCR扩增Fig.2 PCR amplification of fusion gene△MP-Rep
2.2 含△MP-Rep融合基因反向重复植物表达载体的构建
将克隆在pMD18-T上的融合基因△MP-Rep,用引物Rv-m和Rep-R通过PCR反应筛选正向插入的克隆。用限制性内切酶KpnⅠ和XhoⅠ切取融合基因△MP-Rep,将其连接到用同样酶切开的pBlue SK-Intron载体的Intron下游。用引物MPLF和Intron-F通过PCR鉴定扩增到约900bp的目标条带(图3),表明△MP-Rep已成功插入至Intron下游,该片段为反向插入的△MP-Rep和Intron(220bp)片段。将获得的中间质粒记作pSK△MP-Rep-K。
同样用限制性内切酶BamHⅠ和PstⅠ将融合基因△MP-Rep从pMD18-T载体上切下,插入用同样酶切开的pBlue SK-Intron的Intron上游。用引物组合 MP-LF和Intron-R通过PCR也扩增到约900bp的目标条带(图3),表明△MP-Rep成功插入至Intron上游,该片段为正向插入的△MP-Rep和Intron片段。将获得的中间质粒记作pSK-△MP-Rep-B。
然后用限制性内切酶KpnⅠ和PstⅠ从pSK-△MP-Rep-K上切下Intron和△MP-Rep片段,插入用同样酶切开的去除了Intron的pSK-△MPRep-B上。用引 物 组合 MP-LF/Intron-R 和 MPLF/Intron-F分别进行PCR鉴定,都能扩增到约900bp的目标条带(图5),它们分别为正向插入的△MP-Rep与Intron片段、反向插入的△MP-Rep与Intron片段,由此说明,融合基因以反向重复的方式和Intron一起插入到了pBlue SK-Intron上。通过BamH I酶切进一步验证,可以获得约1700bp(包括Intron和融合基因的反向重复序列)的电泳条带,这表明 pSK-Intron △MP-Rep (i/r)载体构建成功(图4)。
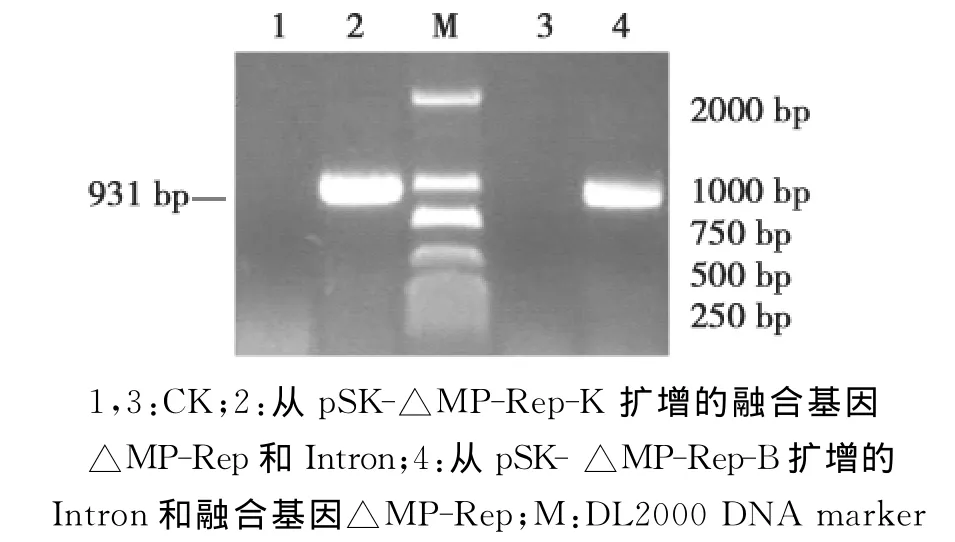
图3 融合基因△MP-Rep在pBlue SK-Intron上的PCR鉴定Fig.3 PCR amplification of fusion gene△MP-Rep from pBlue SK-Intron
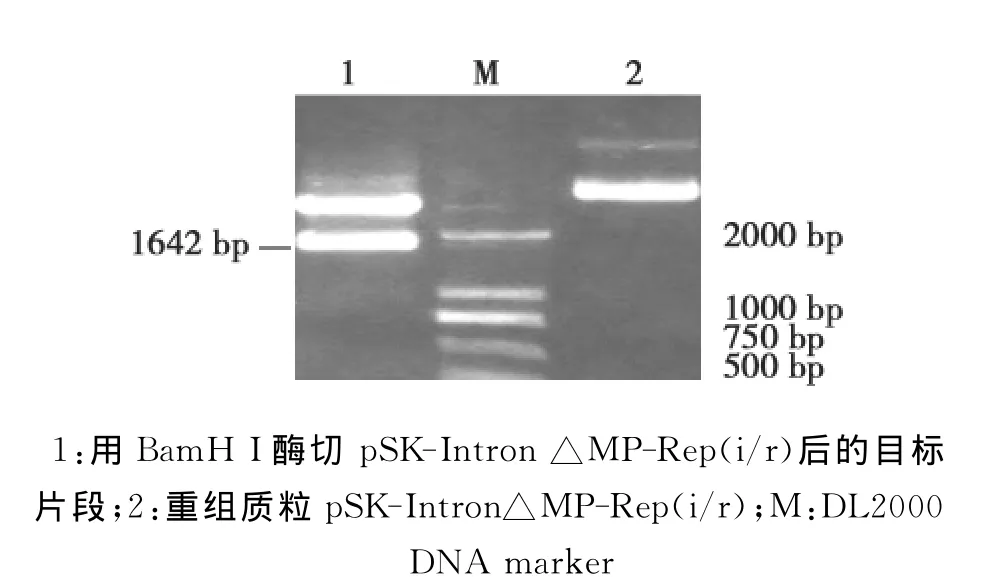
图4 融合基因△MP-Rep在pSK-Intron△MP-Rep(i/r)的酶切鉴定Fig.4 Enzyme digestion analysis of fusion gene△MP-Rep from pBlue-Intron△MP-Rep(i/r)
将上述用BamH I酶切获得的1700bp片段,插入用同样酶切且去磷酸化的双元表达载体pBIN438上。用引物组合 MP-LF/Intron-R和 MPLF/Intron-F分别进行PCR鉴定,都能扩增到上述约900bp目标条带(图5);用BamH I酶切鉴定再次得到同样大小的约为1700bp目标片段(图6)。结果表明,包含Intron在内的2个融合基因△MPRep以反向重复的方式已连接到pBIN438上,含2种病毒基因的植物表达载体pBIN438△MP-Rep(i/r)构建成功。
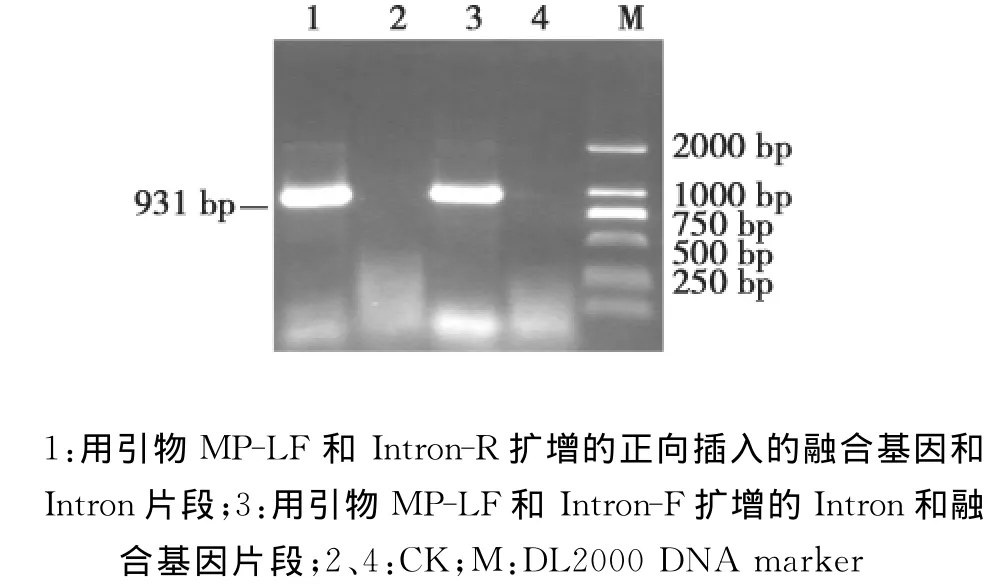
图5 融合基因△MP-Rep在pBIN438上的PCR鉴定Fig.5 PCR amplification of fusion gene△MP-Rep from pBIN438
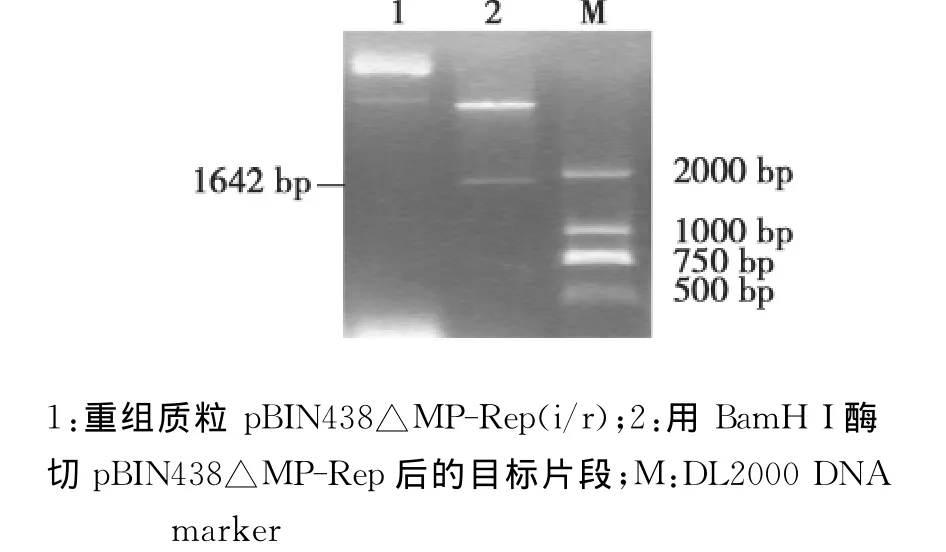
图6 融合基因△MP-Rep在pBIN438△MP-Rep(i/r)的酶切鉴定Fig.6 Enzyme digestion analysis of fusion gene△MP-Rep from pBIN438△MP-Rep(i/r)
3 结论和讨论
利用重组PCR技术将ToMV△MP和CMV△Rep进行融合,获得全长约711bp的融合基因△MP-Rep,再将其以反向重复的方式与大豆内含子相连,并定向插入到植物表达载体pBIN438上35S启动子下游,构建成功含2种病毒基因的植物表达载体pBIN438△MP-Rep(i/r)。
dsRNA是诱导植物基因沉默的关键期起始因子,在植物中表达形成dsRNA就可以诱导基因沉默。将植物病毒的cDNA片段构建成能转录产生dsRNA的结构,导入植物就能诱导植物发生高效的抗病毒反应。从理论上讲,任何一段病毒序列转入植物后通过表达dsRNA诱导基因沉默,均可诱发植物的抗病性。就非编码区而言,基因序列在病毒种内甚至在病毒属内是高度保守的,因此选择种内及属内保守的基因序列,得到的抗病毒植株可对不同致病力的病毒株系产生抗性,可以获得较广的抗病性。因此本研究分别选择了CMV和ToMV序列高度保守的基因片段作为沉默靶标。
在反向重复序列的长度选择上,从理论上来讲,dsRNA的长度达到21~23bp就可发生沉默,但实际应用中为了达到比较好的沉默效果,一般选择200~500bp的基因片段。片段过大不利于重组质粒的遗传操作,片段太小影响沉默效率[8-9]。因此本研究在进行目标基因选择时,为了既便于遗传操作,又可以达到基因沉默的目的,分别选取了379bp的CMV△Rep基因片段和332bp的ToMV△MP基因片段作为目标片段。人工构建具有间隔序列的反向重复序列时,间隔序列可以是任一段核酸,如果是内含子则获得的结构稳定性好,在大肠杆菌里面复制更加稳定;当进入植物后能够被剪切形成没有冗余的dsRNA,从而增强RNA沉默的效应[10]。研究表明,在植物体内转录形成含Intron的发夹结构(ihpRNA),则沉默效率与hpRNA相比可从58%提高至96%,甚至可高达 100%[11-12]。因此,本研究在构建双价抗病毒dsRNA沉默表达载体时成功引入了Intron序列,但是该载体转入植物体后是否可以诱导植物获得高效、双价抗病性,还需要进一步将其转化烟草和加工番茄,通过转基因植株的抗病性鉴定及病毒基因组的表达量和小分子RNA的积累水平来明确。
[1]许文博,都业娟,黄家风.加工番茄上CMV与ToMV的ELISA检测及相关性分析[J].石河子大学学报:自然科学版,2009,27(2):199-201.
[2]赵祥树,向本春,刘升学,等.新疆天山北部地区加工番茄上ToMV和CMV的动态分析[J].石河子大学学报:自然科学版,2010,28(5):561-564.
[3]Di N E,Brunetti A,Tavazza M,et al.Hairpin RNA-mediated silencing of Plum pox virus P1and HC-Pro genes for efficient and predictable resistance to the virus[J].Transgenic Res,2005,14:989-994.
[4]Frizzi A,Huang S.Tapping RNA silencing pathways for plant biotechnology[J].Plant Biotechnol J,2010,8:655-677.
[5]Wang M B,Abbott D C,Waterhouse P M.A single copy of a virus-derived transgene encoding hairpin RNA gives immunity to barley yellow dwarf virus[J].Mol Plant Pathol,2000,1(6):347-356.
[6]Hu Q,Niu Y B,Zhang K,et al.Virus-derived transgenes expressing hairpin RNA give immunity to Tobacco mosaic virus and Cucumber mosaic virus[J].Virology Journal,2011,8:41.
[7]晏立英,许泽永,陈坤荣,等.反向重复RNA介导转基因烟草对花生条纹病毒抗性[J].农业生物技术学报,2007,15(4):702-707.
[8]Smith N A,Singh S P,Wang M B,et al,Gene expression:total silencing by intron-spliced hairpin RNAs[J].Nature,2000,407(6802):319-320.
[9]黄昌军,钱亚娟,李正和,等.病毒诱导的基因沉默及其在植物功能基因组研究中的应用[J].中国科学,2012,42(1):3-15.
[10]牛颜冰,雷霄飞,申林炎,等.烟草花叶病毒和黄瓜花叶病毒双价RNA沉默抗病载体的快速构建[J].中国生物工程杂志,2009,29(1):76-80.
[11]Smith N A,Singh S P,Wang M B,et al.Gene Expression:Total Silencing by Intron-spliced Hairpin RNAs[J].Nature,2000,407:319-320.
[12]Stoutjesdijk P A,Singh S P,Liu Q,et al.HpRNA-mediated targeting of the Arabidopsis FAD2gene gives highly efficient and stable silencing[J].Plant Physiology,2002,129(4):1723-1731.
