燕麦蛋白-葡聚糖湿热反应产物的功能性质研究
2012-11-02陈世超钱海峰
陈世超,钱海峰
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
燕麦蛋白-葡聚糖湿热反应产物的功能性质研究
陈世超,钱海峰*
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
以燕麦蛋白质为研究对象,通过β-葡聚糖对其进行湿热复合改性。研究不同条件下,复合产物的功能性质随着反应条件的变化规律,并对工艺条件进行优化。结果表明,随着燕麦蛋白和β-葡聚糖湿热复合反应时间的延长,在中性至弱碱性pH条件下,采用不同比例燕麦蛋白和葡聚糖的复合产物功能性质都有了不同程度的改善,同时,接枝度变大,颜色逐渐变深。在100℃,pH9,反应物比例为1∶1(w/w),反应120min的最佳工艺条件下,燕麦蛋白的溶解性提高到82%,复合物乳化性与乳化稳定性显著提高。
燕麦蛋白质,β-葡聚糖,湿热反应,乳化性,溶解性
1 材料与方法
1.1 材料与仪器
燕麦 购自无锡三里桥农贸市场;燕麦β-葡聚糖 购自张家口一康生物有限公司;2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)
Sigma公司;十二烷基硫酸钠(SDS) 化学纯;磷酸氢二钠、磷酸二氢钠等 均为分析纯。
水浴锅 上海一恒科学仪器有限公司;搅拌器 IKA RW 20digital;HH—S数显恒温油浴锅 金坛市金伟实验仪器厂;722型分光光度计 上海精密科学仪器有限公司;FJ-200高速分散均质机 上海标本模型厂。
1.2 实验方法
1.2.1 燕麦蛋白质的制备 参考Gang Liu等方法制备燕麦蛋白质[5]。
1.2.2 燕麦蛋白中蛋白质含量测定 采用凯氏定氮法,参考GB/T5009.5-1985《食品中蛋白质的测定方法》。
1.2.3 燕麦β-葡聚糖-蛋白质复合物的制备 将β-葡聚糖与燕麦蛋白质分别溶于缓冲溶液中,按照一定反应物比例,将二者混合均匀,100℃反应,每30min取出,冰浴5min终止反应后,得到复合产物。其中,分别改变缓冲溶液的pH(pH7﹑8、9的磷酸盐缓冲溶液,0.1mol/L)与反应物配比(燕麦蛋白质∶β-葡聚糖为3∶1,1∶1和1∶3)进行实验。
1.2.4 溶解性的测定 取样配成蛋白含量1%(w/v)溶液,在30℃水浴下搅拌分散,然后10000r/min高速离心15min,取上清液,采用凯氏定氮法测定蛋白质含量。
溶解度NSI(%)=上清液中蛋白含量/样品中蛋白含量×100%
1.2.5 乳化性及乳化稳定性的测定 参照浊度法[6],适当改进:取样溶解成蛋白含量为1mg/mL的溶液,取30mL该溶液和10mL色拉油,在高速分散器上以10000r/min的转速分散1min。立即从底部取50μL乳状液,加到5mL 0.1%的SDS溶液中,摇匀,迅速在500nm下测吸光度,以SDS溶液为空白,0min时测得的吸光值A0作为乳化活性EA。乳化稳定性用ESI=A0× 10/(A0-A10)表示,其中A10为乳状液放置10min时测得的吸光值。
1.2.6 接枝度的测定(TNBS法) 取样液稀释一定倍数,加入1mL 0.01%TNBS溶液,于50℃水浴避光加热30min。反应完成后,立刻加入2mL 0.1mol/L无水亚硫酸钠终止反应,室温下放置15min后,测定420nm下的吸光值,以水为空白对照[7]。
蛋白质接枝度(DG)的计算公式:

式中,A0为未反应时TNBS所测蛋白质自由氨基数;At为反应t时刻蛋白质自由氨基数。
1.2.7 褐变指数的测定 取样品液1mL,加入5mL 0.1g/100mL SDS,磁力搅拌20min,取稀释液在420nm波长处测定吸光度,以0.1g/100mL SDS溶液为空白。
2 结果与讨论
2.1 燕麦蛋白质与β-葡聚糖的理化成分分析

表1 燕麦蛋白质的成分(%,w/w,干基)Table 1 Chemical compositions of oat protein

表2 燕麦β-葡聚糖的成分(%,w/w,湿基)Table 2 Chemical compositions of oat β-glucan
燕麦蛋白质纯度90%,主要杂质为多糖。为排除样品中含有的多糖对反应本身造成干扰,取燕麦蛋白质作为对照。燕麦β-葡聚糖纯度为80%。燕麦蛋白和燕麦β-葡聚糖的成分如表1和表2。
2.2 不同pH条件下复合产物功能性质的变化
蛋白质与多糖的湿热反应程度,有很多影响因素,例如:温度﹑加热时间﹑反应物比例﹑pH和多糖分子量等。考虑到实际燕麦加工过程中[2],采用90~100℃,确定100℃为实验温度。同时,中性与碱性pH更容易促进反应的进行[8],同时pH越大,颜色变化越明显。因此,本实验采用pH7﹑8和9的缓冲溶液进行实验。同时,将燕麦蛋白质溶于相应的缓冲溶液,平行处理,作为空白。
2.2.1 复合产物的乳化性及乳化稳定性 蛋白质作为乳化剂,可以吸附在分散粒子的表面,其亲水链深入水相,形成吸附膜降低了表面张力,又形成空间保护层阻止胶粒的聚集。而多糖作为稳定剂,大多滞留在分散介质,通过水化或缔合改变介质流变性而阻止胶粒的聚集[9]。

图1 不同pH(7、8、9),反应物比例为1∶1(w/w),乳化性(A500nm)随时间变化Fig.1 Effects of pH on emulsifying properties of reaction compounds(ratio of reaction materials 1∶1)
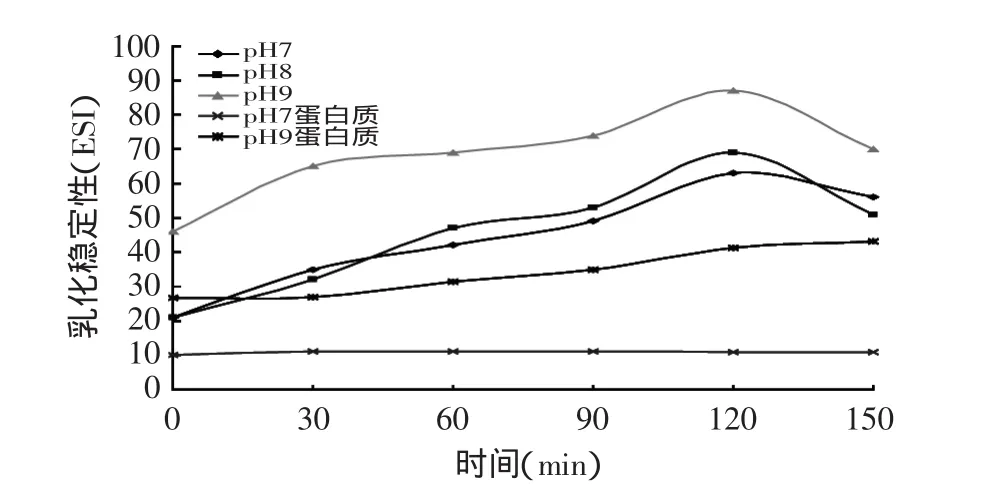
图2 不同pH(7、8、9),反应物比例为1∶1(w/w),乳化稳定性随时间变化Fig.2 Effects of pH on emulsifying stability of reaction compounds(ratio of reaction materials 1∶1)
从图1与图2可以看出,不同pH(7、8、9)时,相对于原蛋白,三者的乳化性及其稳定性均有不同程度的提高。这表明蛋白质与多糖的相互反应,赋予体系不同于两者单独存在时的功能表现。此时,共价键合的蛋白质-多糖复合物既保留了蛋白质的表面活性又具有多糖的亲水性能,乳化性和稳定性都有不同程度的提高[10]。随着时间延长,蛋白质的疏水基团逐渐暴露,亲油性增大,复合物更加易于分散在油/水界面,表现为乳化性随热处理时间而增大。当热处理过度时,可能导致蛋白质分子聚合,乳化性下降[11]。而多糖的加入,增加了油/水乳化系统中水相的黏度,同时会降低油/水界面张力,提高乳化稳定性[12]。
另外,pH9时复合产物的乳化性及其稳定性变化比pH7和pH8时更加显著。这三者的不同,是因为不同pH下蛋白质与多糖的反应速度不同。美拉德反应本质上是碱催化反应,因此pH偏向碱性有利反应的进行。在此范围内,随着反应程度的提高,乳化特性提高更快[13]。
从图1与图2可知,燕麦蛋白质与β-葡聚糖复合产物的乳化性质,与单一的加热后蛋白质(pH7蛋白质,pH9蛋白质)相比,显著增大。随着时间的延长,pH7蛋白质和pH9蛋白质的乳化特性在前120min略有升高,之后随着时间进一步延长(120~150min)而降低。这和燕麦蛋白质-β-葡聚糖复合物的规律一致,但不明显。这表明,燕麦蛋白质中含有的糖类与燕麦蛋白质的反应可以忽略。
2.2.2 复合产物溶解性的测定 从图3可得,随着反应时间延长,反应产物的溶解性明显升高。这是因为随着反应的进行,蛋白质分子上亲水基团增多,从而使溶解度增大。同时,β-葡聚糖的引入,从空间上保护了蛋白质,防止蛋白质聚集[13]。随着反应进一步进行,美拉德反应进入到最终阶段,前面的裂解产物继续反应,产生类黑精,同时与蛋白质发生交联,阻碍反应的进行,表现为溶解度变化不明显[14]。并且,从pH7到pH9,溶解性逐渐增大。这可能是由于在较高的pH时,蛋白质和多糖更加容易结合,亲水基团越多,溶解性越好。pH过高,碱性太强,蛋白质的一级结构可能发生变化,会影响反应的进行。本实验中(pH9)没有观察到此现象。

图3 不同pH(7、8、9),反应物比例为1∶1(w/w),溶解性随时间变化Fig.3 Effects of pH on solubility of reaction compounds(ratio of reaction materials 1∶1)
从图3可知,燕麦蛋白质与β-葡聚糖复合产物的溶解性,与单一的加热后蛋白质(pH7蛋白质,pH9蛋白质)相比,显著增大。随着加热的进行,pH7蛋白质和pH9蛋白质的溶解性在前120min略有升高,之后随着时间进一步延长(120~150min)而降低。这和燕麦蛋白质-β-葡聚糖复合物的规律一致,但不明显,这表明,燕麦蛋白质中含有的糖类与燕麦蛋白质的反应可以忽略,因此,下文不再做此比较。
2.2.3 复合产物的接枝度 从图4可知,随着时间延长,接枝度明显升高。并且,pH越高(从pH7到pH9),接枝度越大。这样,在反应过程中,亲水基团比例逐渐增大,产物的溶解性增大,同时乳化特性也增大,这与性质的变化相吻合。
对于接枝度的变化,是因为在蛋白质与多糖的接枝反应中,与蛋白质中伯氨基接触的还原性醛基才能发生反应。反应开始后,伯氨基不可能立即全部暴露在分子的表面,随着加热时间的延长,蛋白质结构部分展开,多糖与蛋白质受热逐步结合,接枝度逐渐提高[15]。当反应进行到最终阶段,前面的裂解产物继续反应,生产色素,阻碍反应的进行,接枝度保持不变或变化不明显。
多糖的分子量对蛋白质和多糖反应有一定影响。分子量越大,空间效应使得反应降低,反应时间也更长,这也解释了本实验结果与某些文献结果的差别[9]。
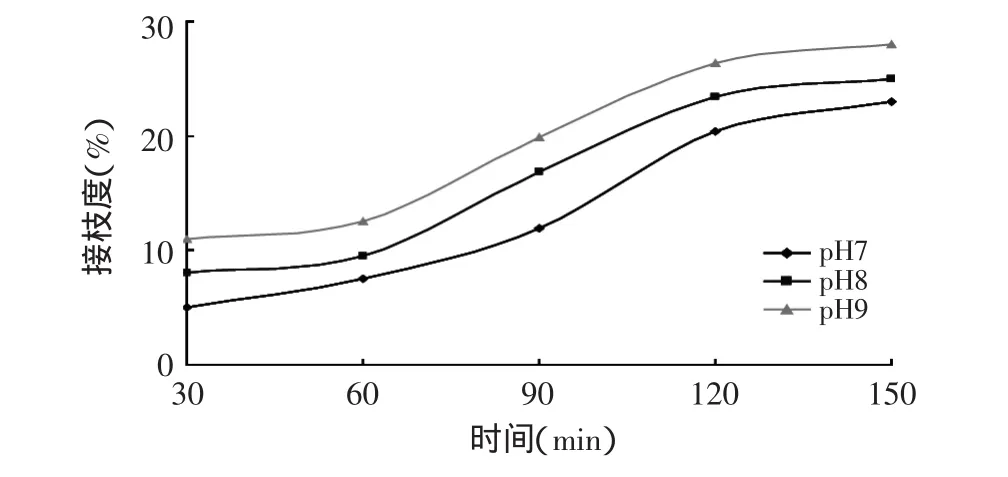
图4 不同pH(7、8、9),反应物比例为1∶1(w/w),接枝度随时间变化Fig.4 Effects of pH on grafting degree of reaction compounds(ratio of reaction materials 1∶1)
2.2.4 复合产物的褐变指数 颜色变化是蛋白质与多糖反应之后的一个十分重要并且极其显著的特征。它的变化取决于食品的种类与反应的进程。从图5可以看到,随着时间延长,不同pH复合物的褐变程度均变大。这和其他报道是一致的[9]。另外,随着pH增大,蛋白质与多糖反应产物的吸光度明显增加。这是因为在碱性介质中,氨基酸呈阴离子形态,此时,氨基易于发生反应。由于邻近n原子的影响,糖碱基C1上电子密度增大,使1,2-烯醇化转为困难,所以在碱性介质中,一般进行2,3-烯醇化[15],使得颜色变化明显。而褐变的不断发生,影响反应的进一步进行,同时对实际应用造成一定困扰。

图5 不同pH(7、8、9),反应物比例为1∶1(w/w),褐变程度随时间变化Fig.5 Effects of pH on browning of reaction compounds(ratio of reaction materials 1∶1)
综上,复合产物的功能性质在pH9时变化更加明显。同时,在120min时,功能性质最大,褐变程度相对较低,此时接枝程度也最大,因此确定pH9,反应120min。
2.3 不同反应比例条件下复合物功能性质的变化
蛋白质与多糖分子间的作用是在一定的基团间进行的。在一定范围内,反应物的分子碰撞几率增大,利于反应的进行。但当加到一定程度时,考虑到蛋白质分子与多糖分子的空间位阻,分子间碰撞几率降低,不利于反应的进行。本实验控制燕麦蛋白质浓度0.5%,改变反应物蛋白质与多糖的比例(燕麦蛋白∶β-葡聚糖为1∶3,1∶1和3∶1w/w),检测二者复合物的性质变化,结果如图6和图7。
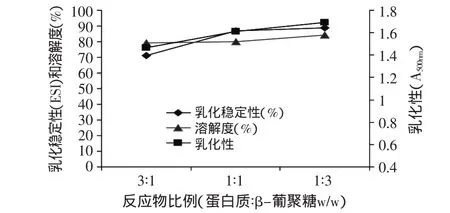
图6 反应物比例对复合物功能性质的影响Fig.6 Effects of ratio of reaction materials on functional properties of reaction compounds(pH9)

图7 反应物比例对复合物接枝度与褐变颜色的影响Fig.7 Effects of ratio of reaction materials on grafting degree and browning of reaction compounds(pH9)
如图6,不同反应物比例所得复合产物的乳化特性﹑溶解性与原蛋白相比都有很大提高。总体来说,复合产物的溶解性随着β-葡聚糖含量的增多而变大,1∶1与1∶3比例相差不大。复合产物的乳化性则先升高,反应物配比从1∶1到1∶3变化不明显。乳化稳定性也表现出类似的趋势。
如图7,从接枝度而言,比例3∶1时接枝度较小,1∶1开始变大,这可能是由于随着糖含量的增大,蛋白质的氨基与多糖的羰基的接触机会增多,结合几率也增大的缘故。同时,随着β-葡聚糖含量的增大,褐变也增大。当比例增大到1∶3时,接枝度变化不大,这可能是因为β-葡聚糖含量过大,空间位阻会影响二者的过多结合。
综合一系列测定结果以及考虑到生产实际,液相体系中,在反应温度100℃时,pH9,反应物比例为1∶1(w/w),反应120min时,得到的复合产物功能性质最佳,此时溶解性提高到82%,乳化性与乳化稳定性显著提高,是一种有效的改性方法。
3 结论
本实验通过β-葡聚糖对燕麦蛋白质进行湿法改性。结果表明:随着时间的延长,不同pH与反应物比例的复合产物其功能性质都有不同程度的改善。同时,接枝度变大,颜色逐渐变深。考虑到颜色变化对生产实际带来的不便,确定100℃,pH9,反应物比例为1∶1,反应120min为最佳工艺。此时,溶解性提高到82%,乳化性与乳化稳定性显著提高,可为燕麦蛋白的湿热改性提供参考。
[1]路长喜,周素梅,王岸娜.燕麦的营养与加工[J].粮食工程技术,2008(1):89-92.
[2]胡新中,魏益民,任长忠.燕麦品质与加工[M].北京:科学出版社,2009:45-52.
[3]齐军茹,杨晓泉,廖劲松.液相体系制备大豆酸沉蛋白-葡聚糖共价复合物及其反应机制(Ⅰ)共价复合物的制备[J].食品科学,2008,29(2):111-114.
[4]Fabien G,Said B,Anne R.Modification of bovine-lactoglobulin by glycation in a powdered state or in aqueous solution:adsorption at the air-water interface[J].Colloids and Surfaces B:Biointerfaces,2001(21):37-45.
[5]Gang Liu,Ji Li,Ke Shi,et al.Composition,secondary structure and self-assembly of oat protein isolate[J].Agric Food Chem,2009,57(11):4552-4558.
[6]Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Agric Food Chem,1978,26(3):718-723.
[7]Adler Nissen J.Determination of the degree of hydrolysis of food protein hydrolysis by trintrobenzene-sulfonic acid[J].J Agric Food Chem,1979,27(6):1256-1262.
[8]刘娟.酪蛋白-葡聚糖接枝改性研究[D].无锡:江南大学,2008.
[9]纪崴.酶法及美拉德反应改进大米蛋白功能性质的研究[D].无锡:江南大学,2009.
[10]吴姣.米渣蛋白改性和改性产物的乳化性及应用的研究[D].南昌:南昌大学,2007.
[11]Nakai S,Modler H W.Food Proteins:properties and characterization[M].New York:Wiley-VCH Publishier,1996:99-121.
[12]Hennock M,Rahalkar R R,Richmond P.Effect of xanthan gum upon the rheology and stability of oil-water emulsion[J]. Food Science,1984,49(5):1271-1274.
[13]刘燕.大豆蛋白-多糖接枝反应的研究与应用[D].无锡:江南大学,2006.
[14]Fennema O R.食品化学[M].王璋,许时婴,江波,等译.第3版.北京:中国轻工业出版社,2003:147-150.
[15]吴惠玲,王志强,韩春,等.影响美拉德反应的几种因素研究[J].现代食品科技,2010,26(5):441-444.
Functional properties of reaction products between oat proteins and glucans by wet-heated reaction
CHEN Shi-chao,QIAN Hai-feng*
(School of Food Science and Technology,State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
β-glucans were used to modify the functional properties of oat proteins by wet-heated reaction.The functional properties of reactions products were determined under different conditions.Results indicated that the functional properties of reactions products improved significantly in different process.At the same time,the degree of grafting increased and the color was darken.Under the condition of 100℃and pH9 at the ratio of 1∶1(w/w),reaction time was 120min,the solubility of the reaction products could reach 82%,while the emulsifying properties and the emulsifying stability increased significantly.
oat proteins;β-glucans;wet-heated reaction;emulsifying properties;solubility
TS210.1
A
1002-0306(2012)01-0132-04
燕麦是公认的营养价值很高的粮食作物,同时含有两种高营养物质蛋白质与β-葡聚糖。燕麦蛋白质的氨基酸组成平衡,具备人体必需的8种氨基酸,特别是含有大米等食品中缺少的赖氨酸,生物价较高。而燕麦β-葡聚糖是一种分子量较小的非淀粉多糖,具有很高的粘度,可以明显降低人体血浆和肝脏胆固醇水平。并具有降低血压的作用,除此之外还具有增稠、乳化和亲水等性质,可作为性能良好的食品添加剂[1]。燕麦蛋白质营养价值比较高,但是溶解性差。目前燕麦片﹑燕麦粉是大多数人获得燕麦蛋白的途径[2]。在蛋白质中引入多糖,是对蛋白质的一种改性,可以显著改善蛋白质的溶解性等功能性质。目前国内这方面的研究主要集中在大豆蛋白和大米蛋白。对于燕麦蛋白,国内关于该技术领域的研究还鲜见报道。对于蛋白-多糖共价复合物的研究,现有制备方法有干法与湿法[3]。其中,干法制备糖蛋白复合物,反应时间长,固相反应物之间接触不均匀、不充分,产物性能比较不稳定。而湿热法蛋白质与多糖之间接触的几率更大,在相对较短反应时间下,反应程度更高,在蛋白-蛋白接触面上存在重要的结构改变[4]。本文主要考察其与β-葡聚糖在液相体系中,经不同条件作用后,复合物各种功能性质的变化,并对蛋白质与多糖反应机理进行初步探讨。
2011-01-25 *通讯联系人
陈世超(1984-),女,硕士研究生,研究方向:谷物功能成分。
