PCNA蛋白突变体的真核表达载体构建及鉴定*
2012-10-30刘小会淡松松秦焕焕高学娟刘朗夏
刘小会,淡松松,秦焕焕,高学娟,刘朗夏
(暨南大学生命与健康工程研究院,广州510632)
PCNA蛋白突变体的真核表达载体构建及鉴定*
刘小会,淡松松,秦焕焕,高学娟△,刘朗夏
(暨南大学生命与健康工程研究院,广州510632)
目的 构建带FLAG标签的细胞增殖核抗原(PCNA)蛋白Y211A、Y211D突变型重组质粒,真核表达及鉴定。方法 以FLAG-PCNA野生型基因为模板,运用PCR定点突变技术扩增出带突变位点的基因序列,将其插入真核表达载体pCMVN-FLAG,进行双酶切实验和测序验证。然后,利用脂质体将重组质粒转染至293T细胞,Western blotting鉴定融合蛋白的表达。结果 FLAG-PCNA(Y211A)、FLAG-PCNA(Y211D)重组质粒测序结果正确,获得PCNA蛋白突变体。结论 成功构建了带FLAG标签的PCNA蛋白Y211A、Y211D真核表达载体,验证了突变型PCNA融合蛋白的表达,为PCNA蛋白功能的深入研究奠定了基础。
PCNA蛋白;突变体;真核表达
细胞增殖核抗原(proliferating cell nuclear antigen,PCNA)是一种在增殖细胞中合成或表达的核抗原,相对分子质量约为36×103,是真核细胞DNA聚合酶δ的辅助因子,与DNA合成和细胞增殖相关,是近年来认为更能有效评估肿瘤细胞增殖活性的重要标志物,也是当前研究的热点之一[1-3]。
许多文献曾报道,表皮生长因子受体(epithelial growth factor receptor,EGFR)在细胞增殖与肿瘤分化中发挥着重要作用。Shao-Chun Wang博士报道EGFR可以磷酸化PCNA上的Y211位点,减少PCNA的降解,从而促进细胞增殖、参与DNA损伤修复[4-6]。本研究运用PCR定点突变技术将211位酪氨酸碱基TAC分别突变成丙氨酸碱基GCC、天冬氨酸碱基GAC,以获得突变型PCNA蛋白基因。将构建的pCMV-NFLAG-PCNA Y211A和Y211D重组质粒,分别转染至293T真核细胞,对表达的融合蛋白进行鉴定,为进一步探讨PCNA蛋白在肿瘤细胞中的生物学作用提供实验基础。
1 材料与方法
1.1 主要实验设备 凝胶扫描成像系统、垂直电泳槽、梯度PCR仪均购自美国Bio-Rad公司。
1.2 主要试剂 限制性内切酶BamHI和XhoI,T4连接酶,DNA marker及PCR扩增试剂盒均购自TaKaRa公司;质粒小提、凝胶回收试剂盒购自天根生物技术公司。标准低分子量蛋白购自Pharmacia公司。PCR引物由英俊公司合成。GST融合蛋白纯化树脂购自GE Healthcare公司。转染试剂GenEscortTMⅡ购自Wisegen公司。RIPA裂解液购自碧云天生物技术公司。FLAG一抗购自Sigma公司。鼠源二抗购自Biorule公司。
1.3 质粒与菌株、细胞株 质粒pCMV-N-FLAG-PCNA、真核表达载体pCMV-N-FLAG及大肠杆菌DH5α均为本实验室所保存。
1.4 方法
1.4.1 目的基因的获得以及重组质粒的构建验证 根据GeneBank检索到的PCNA基因序列,设计扩增其全长序列的引物;根据pCMV-N-FLAG空载的多克隆位点图谱,在引物的5′端引入限制性内切酶BamHI,3′端引入限制性内切酶XhoI识别序列;结合实验要求,设计带突变碱基位点的引物,FLAGPCNA全长引物、突变体引物序列如表1所示。以pCMV-NFLAG-PCNA为模板,进行PCR反应,先扩增带有突变位点的前、后两端DNA序列,反应条件为:94℃5min,94℃30s,55℃30s,72℃延伸30s,30个循环,72℃5min,扩增产物大小分别为633bp和153bp,用1%琼脂糖凝胶电泳分析鉴定及胶回收纯化。然后,将前后两段序列互为引物和模板,进行拼接,反应条件:94℃2min,94℃30s,60℃30s,72℃延伸30s,7个循环。紧接着,全长基因上、下游引物加入到反应体系,反应条件:94℃ 30s,63.2℃ 30s,72℃延伸1min,30个循环,扩增带突变位点、786bp的全长基因,1%琼脂糖凝胶电泳分析鉴定及胶回收纯化。随后,将BamHI和XhoI双酶切的PCR产物,插入到双酶切处理后的pCMV-N-FLAG空载体中,进行连接转化,酶切验证后,送至上海英俊生物技术公司进行测序。

表1 构建FLAG-PCNA突变体重组质粒的上下游引物设计
1.4.2 细胞转染 人胚肾T细胞293T细胞用含10%胎牛血清DMEM培养基,37℃、5%CO2细胞培养箱中常规培养,每2~3天传代一次,用0.25%胰酶消化传代。六孔板中,每孔接种5×105,待细胞贴壁后进行转染。野生型和突变型重组质粒分别与转染试剂GenEscortTMⅡ以2μg∶4μL比例,用DMEM稀释混匀,室温静置孵育30min后,将复合物加之细胞中,4~6h后,更换成含10%胎牛血清DMEM培养基,培养48h。
1.4.3 细胞裂解及Western blotting鉴定表达蛋白 转染收取的细胞用PBS清洗2~3次之后,用RIPA裂解液(含蛋白酶抑制剂)进行裂解和BCA法蛋白浓度测定。取30μg蛋白进行SDS-PAGE电泳,转至PVDF膜后,用1×TBST洗膜3次,10分/次,5%脱脂奶粉室温封闭1h。然后,用鼠源FLAG单克隆抗体(1∶2 000),4℃,孵育过夜。次日,1×TBST洗膜3次后,鼠二抗(1∶2 000)室温孵育30min,经1×TBST洗膜3次后,ECL曝光显影。
2 结 果
2.1 目的基因片段的扩增 利用PCR从模板质粒pCMV-NFLAG-PCNA(Wt)上扩增出带突变位点的FLAG-PCNA Y211A和Y211D基因前、后两段DNA序列,大小分别为633bp和153bp(图1A)。随后将其拼接,PCR扩增出带突变位点的全长基因序列,大小为786bp(图1B),均与预期DNA片段大小相符。
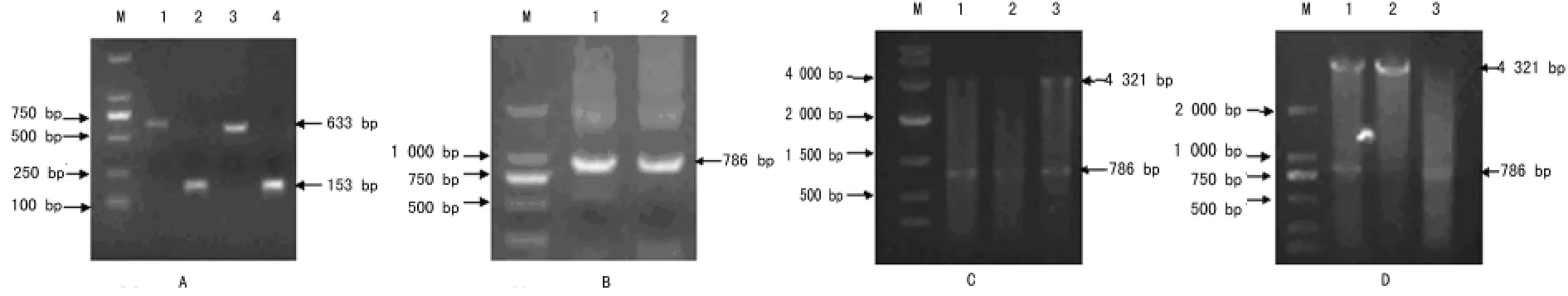
图1 FLAG-PCNA Y211A和Y211D基因的PCR结果

图2 重组质粒的DNA测序结果
2.2 重组质粒的鉴定 突变型重组质粒连接转化后,分别挑取3个单克隆进行扩大培养,质粒提取后分别用BamHI和XhoI进行双酶切鉴定。琼脂糖凝胶电泳可见大小786bp的目的条带,表明目的基因已经成功插入pCMV-N-FLAG载体中(图1C、D)。比较DNA测序报告箭头所指位点,表明211位的酪氨酸碱基TAC,已分别突变成丙氨酸(GCC,A)和天冬氨酸碱基(GAC,D)(图2)。证明突变型FLAG-PCNA Y211A和Y211D质粒已成功构建。

图3 Western blotting验证分析融合蛋白的表达
2.3 Western blotting鉴定融合蛋白 野生型和突变型重组质粒转染过293T细胞,经Western blotting用FALG抗体孵育验证后,发现突变型PCNA蛋白同野生型PCNA蛋白均可以正常表达,蛋白大小与预期相符,结果见图3。
3 讨 论
PCNA蛋白的异常与肿瘤的发生发展密切相关,它几乎存在于所有迅速增殖的细胞核中,它的出现明显与细胞增殖有关,其在静止细胞中含量很低,从G1末期开始增加,在S期达到高峰,是评价细胞增殖状态的重要指标,同时还是鉴别某些良性肿瘤和恶性肿瘤的指标和预后评估指标[3,7]。蛋白质磷酸化修饰是PCNA半衰期调节的主要机制。文献报道PCNA蛋白上的Y211磷酸化后,可显著增强细胞增殖,降低乳腺癌等恶性肿瘤患者生存率[4-6]。本研究将211位的酪氨酸分别突变成天冬氨酸以模拟该位点的磷酸化,突变成为丙氨酸以阻断该位点的磷酸化[8-11],构建 pCMV-N-FLAG-PCNA Y211A 和Y211D真核表达载体后,转染至293T真核细胞并鉴定融合蛋白的表达,为进一步研究PCNA的生理功能打下基础。
在构建Y211A、Y211D重组质粒过程中,本研究采用了突变位点周围序列重叠拼接的策略,分别构建了突变位点前段和后段的DNA序列,随后利用PCR、两端DNA序列互为模板引物进行拼接。为了保证突变目的基因产物能够有效扩增,实验前作者利用全长基因的引物,设置了梯度PCR反应,找到了63.2℃反应效率相对较高的退火温度。
293T细胞因具备理想的细胞转染效率,所以是蛋白表达和功能研究中常用到的细胞株。同一张膜上,经DAB底物显色后,相对于内参β-actin,作者发现目的蛋白有较高的表达量。文献中报道,作者利用蛋白合成抑制剂处理、结合Y211F突变体发现,Y211位点的磷酸化有助于PCNA蛋白的降解,在初步的蛋白表达中尚未看到明显的变化;再者,由于PCNA在细胞中存在DNA结合和游离两种形式,而DNA结合形式不易被分离,同内源PCNA蛋白的影响调节有可能是造成这种变化不明显的原因[12-15]。
[1] Stenner M,Demgensky A,Molls C,et al.Prognostic value of proliferating cell nuclear antigen in parotid gland cancer[J].Eur Arch Otorhinolaryngol,2012,269(4):1225-1232.
[2] Acharya N,Klassen R,Johnson RE,et al.PCNA binding domains in all three subunits of yeast DNA polymeraseδ modulate its function in DNA replication[J].Proc Natl Acad Sci USA,2011,8(44):17927-17932.
[3] Strzalka W,Ziemienowicz A.Proliferating cell nuclear antigen(PCNA):a key factor in DNA replication and cell cycle regulation[J].Ann Bot,2011,107(7):1127-1140.
[4] Wang SC,Nakajimal Y,Yu YL,et al.Tyrosine phosphorylation controls PCNA function through protein stability[J].Nature Cell Biology,2006,8(12):1359-1368.
[5] Zhao H,Lo YH,Ma L,et al.Targeting tyrosine phosphorylation of PCNA inhibits prostate cancer growth[J].Mol Cancer Ther,2011,10(1):29-36.
[6] Wang SC,Hung MC.Nuclear translocation of the epidermal growth factor receptor family membrane tyrosine kinase receptors[J].Clin Cancer Res,2009,15(21):6484-6489.
[7] Naryzhny SN.Proliferating cell nuclear antigen:aproteomics view[J].Cell Mol Life Sci,2008,65(23):3789-3808.
[8] Chen L,Feany MB.Alpha-synuclein phosphorylation controls neurotoxicity and inclusion formation in a Drosophila model of Parkinson disease[J].Nat Neurosci,2005,8(5):657-663.
[9] 田平芳,曲凯,谭天伟.链球菌生物合成透明质酸的分子机理与基因工程菌构建进展[J].中国生物工程杂志,2008,28(4):98-102.
[10]邵圣文,于建国,武文斌,等.丙型肝炎病毒F蛋白磷酸化位点突变与细胞内分布[J].微生物与感染,2007,2(2):87-89.
[11]徐熠熠,蓝建平,朱园园,等.TRFl219位磷酸化在细胞周期调控中的作用研究[J].浙江大学学报:医学版,2007,36(4):5-8.
[12]Moldovan GL,Pfander B,Jentsch S.PCNA,the maestro of the replication fork[J].Cell,2007,129(4):665-679.
[13]Chen J,Ai Y,Wang J,et al.Chemically ubiquitylated PCNA as a probe for eukaryotic translesion DNA synthesis[J].Nature Chemical Biology,2010,6(4):270-272.
[14]Achary N,Yoon JH,Gal H.Roles of PCNA-binding and ubiquitin-binding domains in human DNA polymeraseηin translesion DNA synthesis[J].PNAS,2008,105(46):17724-17729.
[15]Mayanagia K,Kiyonaric S,Saitod M,et al.Mechanism of replication machinery assembly as revealed by the DNA ligase-PCNA-DNA complex architecture [J].PNAS,2009,106(12):4647-4652.
Construction and identification of eukaryotic expression vector for mutant PCNA*
Liu Xiaohui,Dan Songsong,Qin Huanhuan,Gao Xuejuan△,Liu Langxia
(Institutes of Life and Health Engineering,Ji′nan University,Guangzhou,Guangdong510632,China)
Objective To construct and express FLAG-PCNA gene mutant in 293Tcells.Methods Mutant FLAG-PCNA cDNA was amplified by PCR site-directed mutagenesis with FLAG-PCNA gene as template,and inserted into the eukaryotic expression vector pCMV-N-FLAG.The recombinant vector was then transfected into human embryonic kidney(HEK)293Tcells.The cells were harvested after 48hto identify the expression of plasmids by western blot.Results Sequences of recombinant plasmid were correct,and the mutants of PCNA were obtained.Conclusion Eukaryotic plasmids of mutant PCNA were obtained,and the expression of mutant PCNA protein was identified,which lay a foundation for further research of PCNA protein.
PCNA;mutant;eukaryotic expression
10.3969/j.issn.1671-8348.2012.12.019
A
1671-8348(2012)12-1194-03
国家973重点基础研究发展计划资助项目(2011CB910701);国家自然科学基金青年科学基金资助项目(31000628);暨南大学引进优秀人才科研启动基金资助项目(50624001);广东省高等学校高层次人才资助项目(50524006)。△
,E-mail:tgaoxj@jnu.edu.cn。
2011-12-12
2012-01-09)
