离体SH-SY5Y细胞内酸化对早老素-1表达的影响*
2012-09-27高芳峭方伯言
高芳峭,方伯言
(1.辽宁医学院研究生学院,辽宁锦州 121001;2.辽宁医学院附属第一医院神经内科,辽宁锦州 121001)
阿尔茨海默病(alzheimer′s disease,AD)是一种以进行性记忆力减退、认知功能障碍为特征的中枢神经系统退行性变性疾病。主要病理改变是在大脑中于记忆和认知相关区域出现β淀粉样蛋白(amyloid proteinβ,Aβ)聚合产生的纤维沉积形成老年斑并引起神经受损等一系列相关的病理改变[1]。Aβ是由淀粉样前体蛋白(amyloid precursor protein,APP)分别通过β-分泌酶和γ-分泌酶作用后生成[2]。过去对β-分泌酶研究的比较清楚,但对γ-分泌酶的结构与特性却一直不甚清楚。近年来一些研究提示早老素-1(Presenilin 1,PS1)是γ-分泌酶水解APP所必须的,起到重要的催化作用,甚至可以说PS1就是未知的γ-分泌酶[3-5]。AD中神经细胞死亡是由细胞凋亡介导的,由于各种物理和化学刺激诱导的细胞凋亡都出现细胞内酸化,推断AD的神经细胞凋亡的同时也伴有细胞内酸化。有研究表明这些酶在酸性条件下具有较高的活性,但相关的研究和证据还比较少。酸碱调节基因-胞膜离子交换蛋白Na+-H+交换泵(Na+-H+exchanger,NHE)基因在维持细胞内环境中发挥重要作用[7],因此作者应用pAd-miR-NHE1腺病毒颗粒感染SH-SY5Y细胞,抑制细胞表面酸碱调节基因NHE1的表达[8],使细胞内pH值降低,另外降低细胞培养基pH值,同样降低细胞内pH值,观察分析PS1在pH值降低的细胞内的表达,进一步了解细胞内pH值对PS1功能和活性的影响,探讨AD的发病机制。
1 材料与方法
1.1 细胞培养与miRNA腺病毒转染SH-SY5Y细胞 人神经母细胞瘤SH-SY5Y细胞(中国医科大学赠),采用10%的FBS的高糖DMEM培养基(GIBCO),在37℃、5%CO2培养箱内进行培养。对腺病毒pAd-miR-NHE1和pAd-miR-NC转染细胞进行鉴定后[8],分别转染细胞,为NHE1基因抑制组(NHE1组)和阴性对照组(NC组)。将用正常培养基常规培养的SH-SY5Y细胞按106细胞密度接种于培养瓶中,当达到80%~90%融合时按MOI值为160进行转染(细胞的感染率在90%左右为最佳 MOI值),将准备好的腺病毒与无血清无抗体的培养基按一定比例混合(取50μL腺病毒和2 950μL无血清无抗生素的培养基),混匀,放置37℃、5%CO2培养箱内吸附1h后,PBS洗涤后改用2%血清双抗培养基于37℃、5%CO2培养箱内培养24~48h后收集细胞。
1.2 酸化细胞外环境,选出最适细胞生长的酸性培养基 降低细胞培养基pH值,以pH值6.8为基准,依次降低0.5形成5个梯度pH值的培养基,从接种开始每12小时计数1次,至72h,共6个时间点。细胞系以平均1×104个细胞密度接种于在24孔细胞板上,各梯度每个时间点重复3个孔;接种后12h开始用0.25%胰蛋白酶消化每个梯度的第1组,制成1 mL细胞悬液,进行计数,取3个孔的平均值,至72h结束,通过光镜观察细胞生长,根据测得的数值,绘制生长曲线,进行培养细胞的生长曲线分析,确定最适细胞生长的酸性培养基。
1.3 细胞内pH值测定 用缓冲液求标准曲线,制作高钾缓冲液,将高钾缓冲液分装6只试管中,每只5mL,分别将pH值调至不同的值,分别为4.8、5.3、5.8、6.3、6.8、7.3,6只试管中分别加入Nigericine和BCECF,浓度分别为30μmol/L和0.25μmol/L,取正常SH-SY5Y细胞胰酶消化,制成单细胞悬液,PBS洗2次,分别加入相同的细胞与上述试管中,37℃孵育12min,应用荧光分光光度计记录490nm/440nm荧光强度比值(FIR),求出pH值的标准曲线。将各组细胞胰酶消化,1 000r/min离心5min,弃上清液,生理盐水洗1次,BCECF/AM/DMSO浓度为2mg/mL加入培养基中,37℃孵育细胞12min,用荧光分光光度计记录490nm/440nm荧光强度比值,根据标准曲线求出细胞内pH值。
1.4 ELISA法定量分析细胞内的PS1 各条件下的细胞系以2×106个细胞密度接种于培养瓶中,分别培养48h,贴壁细胞用冷PBS洗2次,用预冷的RIPA裂解液50mmol/L,刮下细胞,冰上裂解30min,将裂解产物以14 000r/min离心5min收集上清液,裂解液中PS1的含量用ELISA试剂盒(RD)测量,所有操作按试剂盒说明书进行,每组样品做3个复孔。
1.5 Western Blotting 取各条件下稳定表达PS1的贴壁细胞用冷PBS洗1次,加入预冷的RIPA裂解液,刮下细胞,在冰上裂解30min,将裂解物离心收集上清液。蛋白20μg/孔上样于10%SDS-PAGE,每组样品重复两个孔,电泳分离后,转至PVDF膜上,分别与一抗兔抗PS1单克隆抗体(Bioworld Technology,USA)(1∶800),兔抗β-actin单克隆抗体(碧云天公司)(1∶500)孵育4℃过夜。二抗用辣根过氧化物酶HRP标记的羊抗兔Ig(碧云天公司)(1∶500)孵育1h,加入适量的BCIP/NBT(碧云天公司)染色液显色。
2 结 果
2.1 选出适合细胞生长的酸性培养基 当pH值为6.3时SH-SY5Y细胞很快贴壁,接种后24h内培养细胞的增殖速度不甚活跃,大约36h开始,倒置显微镜下可以观察到贴壁细胞增殖迅速,48~72h这些细胞增殖进一步扩大,铺满瓶底,镜下细胞呈多角形。当pH值为6.8或5.8时,情况类似,仅增值速度稍慢,于72h后细胞数约为前者的50%。当pH值为5.3时,细胞却贴壁不牢,部分悬浮,12h观察细胞数减为接种时的一半,以后细胞数量不增加或稍增加后随即停止,形态极不规则。当pH值为4.8时,12h观察镜下细胞成为圆球形悬浮细胞,飘荡在培养液中,大部分细胞死亡。通过观察,适合细胞生长的酸性培养基pH值为6.3。
2.2 细胞内pH值降低的SH-SY5Y细胞模型建立 根据荧光分光光度计测得的缓冲液490nm/440nm荧光强度比值,计算出pH值标准曲线的直线回归方程为Y=0.464 1 X+4.088 7(r=0.94),再根据各组细胞的490nm/440nm荧光强度比值在回归方程上计算出对应的细胞内pH值(表1)。正常对照组细胞内pH值为7.27±0.02,而NHE1组和酸化培养基组细胞内pH值分别为6.62±0.02和6.99±0.02,差异有统计学意义。NHE1组和酸化培养基组细胞内pH值明显降低,说明模型成功建立,正常对照组和NC组细胞相比细胞pH值无明显差别。

表1 各组细胞内pH值情况
2.3 PS1含量测定 根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程为Y=0.001 X+0.419(r=0.87),再根据样品的OD值在回归方程上计算出对应的样品浓度(表2)。从结果中可以看出,细胞内PS1的含量受细胞内pH值影响:正常对照组和NC组胞浆内PS1含量表达较低,NHE1组和酸化培养基组细胞内PS1含量均较正常对照组和NC组明显增多,但NHE1组与酸化培养基组细胞内PS1含量变化无明显差异(P>0.05),正常对照组与NC组细胞内PS1含量变化无明显差异(P>0.05)。此结果表明,PS1含量与细胞内pH值呈依赖关系,SH-SY5Y细胞内pH值降低可使胞浆内PS1生成量增加。

表2 ELISA法检测各组细胞内PS1蛋白浓度值
2.4 PS1的表达 利用抗PS1单克隆抗体进行Western Blotting检测各组细胞内PS1的表达,可识别相对分子质量大约为60×103的PS1。在所检测的4组中,PS1都可显现(图1),前两组的条带很模糊,可能由于蛋白含量较少的缘故,后两组条带清晰显现。后两组细胞内PS1表达量与前两组细胞比较统计学分析有显著差异,正常细胞组和NC组PS1表达量无明显差异(P>0.05),NHE1组与酸化培养基组细胞内PS1表达量无明显差异(P>0.05),结果显示与ELISA结果相一致。见表3。

图1 PS1的Western Blotting检测
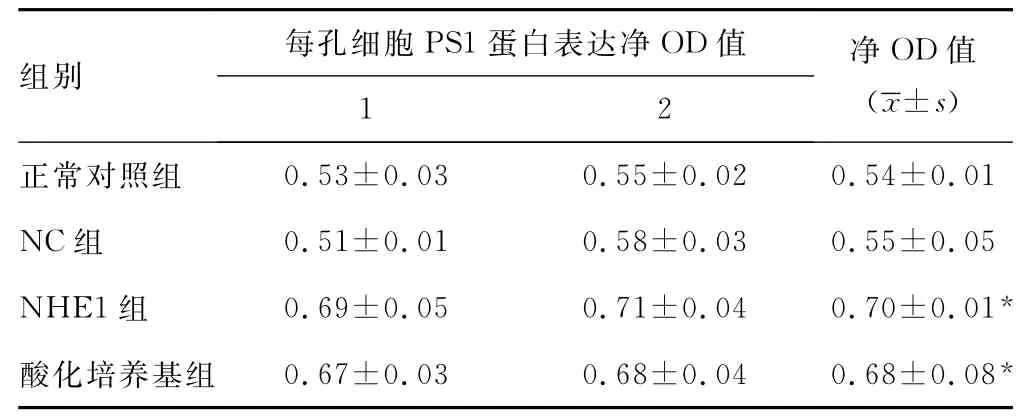
表3 Western Bloig检测各组细胞PS1蛋白表达净OD值
3 讨 论
随着人口老龄化,老年期痴呆越来越引起人们的关注。现在虽然认识到AD的发病机制是由于患者体内产生过多Aβ并在大脑中形成纤维沉积所致,但对Aβ如何过多产生的机制还并不清楚。β-分泌酶和γ-分泌酶的活性异常可能是导致Aβ增多的原因。细胞凋亡被认为与AD中神经元细胞退化过程中几个阶段有关,所以有些研究者认为AD中神经元细胞死亡是由细胞凋亡介导的。细胞内酸化作为细胞凋亡的一个重要特征已被实验所证实,这些实验结果表明,应用各种外源性的物理和化学刺激诱导各种不同的细胞凋亡的同时都伴有出现细胞浆的酸化。也就是说AD的神经细胞呈细胞内酸化状态。
细胞内pH值是反映内环境稳定性的一项指标,它在调节细胞新陈代谢中起重要作用。体内众多的酶类同样受到最基本的化学调节—pH值的调节,pH值直接影响到酶的活性、表达及构象。这使作者产生一个设想,细胞内pH值的变化可能对APP裂解—γ-分泌酶的功能产生影响,即细胞内pH值降低使γ-分泌酶裂解APP生成Aβ的活性增高。
γ-分泌酶是一个包含早老素在内的蛋白复合体,这是Aβ产生所必须的一个酶。PS包括PS1和PS2,PS1广泛分布于人的脑和外周组织,PS2则主要表达于人的心肌、骨骼肌等外周组织,对AD的作用不大[9-10]。因此,在本实验中选择的指标只包括了PS1,而不包括对AD作用不大的PS2。现在有越来越多的研究显示PS1可能就是预期的γ-分泌酶,体内实验发现[11],敲除编码PS1基因的小鼠γ-分泌酶的活性降低80%,Aβ含量大大降低,PS1和PS2基因双敲除的小鼠,其γ-分泌酶活性完全被抑制,这些均表明PS1是γ-分泌酶水解APP所必须的,因此PS1是γ-分泌酶的主要组成部分,起到重要的催化作用,是γ-分泌酶活性基团。本研究通过建立细胞内酸化的SH-SY5Y细胞模型,探讨γ分泌酶主要成分PS1在胞浆pH值降低的细胞中的表达及其活性是否增高,进而分析细胞内pH值变化与γ-分泌酶活性的关系。
结果显示细胞内pH值降低对PS1的表达及活性有一定影响作用。本实验结果表明,与正常SH-SY5Y细胞相比,NHE1受抑制的细胞和用酸性培养基培养的细胞的胞浆内PS1含量及蛋白表达均显著增高,而NHE1未被抑制的NC组细胞的胞浆内PS1含量及蛋白表达则无显著变化,与预期的二者之间变化关系是一致的。
从本研究看,细胞内pH值降低的细胞胞浆内PS1浓度及蛋白表达是增加的,说明PS1的活性在酸化细胞中是明显升高的,据此推测,细胞内pH值降低使γ-分泌酶的活性升高,在AD患者脑内γ-分泌酶的活性也是如此。因为γ-分泌酶活性升高在AD发生中具有关键性的作用,所以作者认为γ-分泌酶含量和蛋白水平的升高可能是高龄人群易发AD的一个关键性的生物学因素。
综上所述,本实验结果进一步支持了AD中γ-分泌酶的活性异常是导致Aβ增多的原因之一。
[1] Clark CM,Karlawish JH.Alzheiner disease current concepts and emerging diagnostic and therapeutic strategies[J].Ann Intem Med,2003,138(5):400-410.
[2] Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353-356.
[3] Herreman A,Serneels L,Annaert W,et al.Total inactivation of gamma-secretase activity in presenilin-deficient embryonic stem cells[J].Nat Cell Biol,2000,2(7):461-462.
[4] Esler WP,Kinberly WT,Ostaszewi BL,et al.Transitionstate analogue inhibitors of gamma-secretase bind directly to presenilin-1[J].Nat Cell Biol,2002,2(7):428-434.
[5] 梁平,潘阳杏,赵雪梅,等.早老素1基因在转染CHO细胞中的表达及其与γ-分泌酶的关系[J].中华病理学杂志,2005,34(5):297-301.
[6] Li YM,Xu M,Lai MT,et al.Photoactivated gammasecretase inhibitors directed to the active site covalently label presenilin 1[J].Nature,2000,405(6787):689-694.
[7] 李华,严虹,潘金顺.金雀异黄素抑制氧化钴诱导的人视网膜色素上皮细胞低氧诱导因子1α表达的研究[J].医学研究生学报,2004,17(11):973-979.
[8] 黄美风,方伯言.人NHE-1基因miRNA干扰载体构建、鉴定及干扰效应评价[J].中国现代医学杂志,2010,20(18):2721-2724.
[9] Cacabelos R,Fernandez-Novoa L,Lombardi V,et al.Molecular genetics of Alzheimer′s disease and aging[J].Methods Find EXP Clin Pharmacol,2005,27(Suppl A):1-573.
[10]Panegyres PK,Toufexis K.Presenilin immunoreactivity in Alzheimer′s disease[J].Eur J Neurol,2005,12(9):700-706.
[11]Herreman A,Serneels L,Annaert W,et al.Total inactivation of gamma-secretase activity in presenilin-deficient embryonic stem cells[J].Nat Cell Biol,2000,2(7):461-462.
