枣核总黄酮的微波辅助提取工艺优化
2012-10-28张吉祥欧来良
张吉祥,欧来良
(1.廊坊师范学院化学与材料科学学院,河北 廊坊 065000;2.南开大学 生物活性材料教育部重点实验室,天津 300071)
枣核总黄酮的微波辅助提取工艺优化
张吉祥1,欧来良2
(1.廊坊师范学院化学与材料科学学院,河北 廊坊 065000;2.南开大学 生物活性材料教育部重点实验室,天津 300071)
目的:采用正交试验法,优选枣核中总黄酮的微波辅助提取工艺。方法:以芦丁为对照品,采用分光光度法进行测定,以枣核黄酮提取率作为考查指标,对影响黄酮提取工艺的因素进行研究。通过单因素试验研究微波功率、提取时间、提取温度、料液比和提取溶剂乙醇体积分数对提取效果的影响。然后,利用正交试验法优化最佳提取工艺条件。结果:对枣核黄酮提取的影响程度大小顺序为料液比>提取温度>提取时间>乙醇体积分数>微波功率,正交试验结果表明最佳提取工艺参数为料液比1:60(g/mL)、提取温度60℃、乙醇体积分数50%、提取时间20min、微波功率500W。在最佳工艺条件下,枣核黄酮粗品的提取产率为10.14%,粗品中黄酮含量为7.00%。结论:采用正交试验-微波提取工艺,能显著提高枣核黄酮的提取效率,具有较好的提取效果。
正交试验法;微波;提取;枣核;总黄酮
红枣,又名中华大枣、小枣,是鼠李科枣属植物枣(Zizyphus jujuba Mill)的果实[1]。红枣果肉营养丰富且含大量生物活性成分,如大枣皂甙Ⅰ、Ⅱ、Ⅲ(ziziphus saponin Ⅰ、Ⅱ、Ⅲ)、酸枣仁皂甙B(jujuboside B)、光千金藤碱(stepharine)、葡萄糖、果糖、蔗糖、环磷腺苷(cAMP)、环磷乌苷(cGMP)等,具有独特的营养和药用价值[2-5]。目前,除对枣肉中有效成分进行研究外,以往作为废料丢弃的枣核中有效成分的研究也成为人们关注的课题[6-9]。研究表明,红枣枣核含黄酮类有效成分,具有预防心脑血管疾病、防癌抗癌之功效[9-10]。目前,天然产物中有效成分的传统提取方法有醇渗漉法、浸渍法、索氏抽提法和加热回流法。但这些提取方法存在提取时间长、溶剂用量大、提取率低等问题。近年来,现代提取技术微波辅助提取法在环境、生化、食品及天然产物等领域得到了广泛的应用。微波提取具有设备简单、操作时间短、热效率高等优点,已广泛用于天然产物中挥发油、苷类多糖、生物碱等成分的提取[11-14]。经查阅,采用微波辅助法对红枣枣核中黄酮类有效成分进行提取的报道甚少[15]。本实验以红枣核为试验材料,采用正交试验法,利用微波辅助提取法对红枣核中的总黄酮进行提取研究,旨在获得最佳提取工艺,为红枣核的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
芦丁标准品 中国食品药品检定研究院;红枣枣核样品 河北沧州金丝小枣枣核 河北献县海英枣业有限公司;乙醇(分析纯)、氢氧化钠(分析纯) 天津市北方天医化学试剂厂;三氯化铝(分析纯) 天津市虹迪化工有限公司;亚硝酸钠(分析纯) 天津市化学试剂一厂。
1.2 仪器与设备
XH100B电子微波催化合成/萃取仪 北京祥鹄科技发展有限公司;UV-2550型紫外-可见分光光度计 日本岛津公司;FA1604N电子天平 上海精密科学仪器有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;中草药粉碎机 天津市泰斯特仪器有限公司;ZK-82B型真空干燥箱 上海实验仪器总厂;溶剂过滤器 天津津腾实验设备有限公司。
1.3 方法
1.3.1 标准曲线的绘制
以芦丁为对照品,配制系列标准溶液,在波长507nm处测定吸光度,以吸光度对质量浓度做标准曲线[16]。芦丁对照品溶液在一定质量浓度范围内与吸光度呈良好线性关系,线性回归方程为A=0.01925+13.82c,线性相关系数为r=0.9999,标准曲线的线性范围为0.0032~0.048mg/mL。
1.3.2 提取工艺与提取效果衡量指标
枣核 → 洗净烘干 → 粉碎过200目筛 → 加入提取剂 →微波提取 → 0.45μm微孔滤膜过滤得澄清透明液体 → 减压浓缩回收提取剂 → 真空干燥 → 得枣核黄酮提取物粗品 → 计算粗品提取产率 → 测定粗品中黄酮含量。
取一定体积经微孔滤膜过滤后的溶液,按1.3.1节步骤测定波长507nm处吸光度,计算溶液质量浓度,转化为以枣核原料为基准的黄酮提取率,作为提取效果的衡量指标。
1.3.3 单因素试验
1.3.3.1 料液比的选择
准确称取6份粉碎的枣核样品各1.0000g置于250mL圆底烧瓶中,分别加入体积分数为50%的乙醇溶液20. 00、30.00、40.00、50.00、60.00、70.00mL作为溶剂,设定微波功率400W,微波辐射温度40℃,提取时间20min,进行微波提取。浸提液经减压抽滤,取一定体积溶液按1.3.1节操作步骤测定,计算黄酮提取率作为提取指标。
1.3.3.2 乙醇体积分数的选择
准确称取6份粉碎的枣核样品各1.0000g置于250mL圆底烧瓶中,分别加入40.00mL乙醇溶液作为溶剂,控制乙醇体积分数为20%、30%、40%、50%、60%、70%,设定微波功率400W,微波辐射温度40℃,提取时间20min,进行微波提取。浸提液经减压抽滤,取一定体积溶液并按1.3.1节操作步骤测定,计算黄酮提取率作为提取指标。
1.3.3.3 提取时间的选择
准确称取6份粉碎的枣核样品各1.0000g置于250mL圆底烧瓶中,加入40.00mL 50%的乙醇溶液作为溶剂,设定微波功率400W,微波辐射温度40℃,分别控制提取时间10、15、20、25、30、35min进行微波提取。浸提液经减压抽滤,取一定体积溶液并按1.3.1节操作步骤测定,计算黄酮提取率作为提取指标。
1.3.3.4 微波功率的选择
准确称取6份粉碎的枣核样品各1.0000g置于250mL圆底烧瓶中,加入40.00mL 50%的乙醇溶液作为溶剂,设定微波功率分别为200、300、400、500、600、700W,微波辐射温度40℃,微波提取20min,浸提液经减压抽滤,取一定体积溶液并按1.3.1节操作步骤测定,计算黄酮提取率作为提取指标。
1.3.3.5 提取温度的选择
准确称取6份粉碎的枣核样品各1.0000g置于250mL圆底烧瓶中,加入40.00mL 50%的乙醇溶液作为溶剂,设定微波辐射温度分别为30、40、50、60、70、80℃,微波辐射温度400W,微波提取20min,浸提液经减压抽滤,取一定体积溶液并按1.3.1操作步骤测定,计算黄酮提取率作为提取指标。
1.3.4 枣核总黄酮的微波辅助提取工艺正交优化试验
在单因素试验的基础上,利用正交试验法以料液比、乙醇体积分数、微波功率、提取时间和微波辐射温度作为5个考察因素,选取4个水平进行试验。采用L16(45)正交表进行正交试验设计,确定微波提取的最佳工艺条件。
1.4 枣核黄酮粗品提取产率的计算
将浸提液减压浓缩回收溶剂,将产品真空干燥得枣核黄酮粗品,计算粗品的提取产率。

式中:ω为枣核黄酮粗品提取产率/%;X为枣核黄酮提取物粗品质量/g;m为枣核质量/g。
1.5 枣核黄酮粗品中黄酮含量的计算
准确称取一定质量的黄酮粗品,溶解并定容至25mL容量瓶中,取一定体积溶液并按1.3.1节方法测定吸光度,将吸光度换算成质量浓度,计算枣核粗品中黄酮含量。
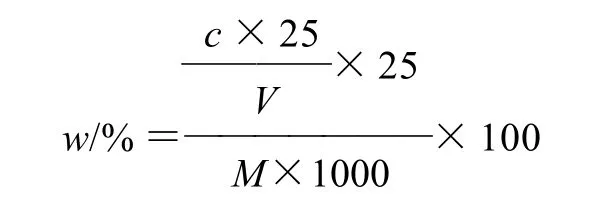
式中:w为枣核粗品中黄酮含量/%;c为溶液中黄酮质量浓度/(mg/mL);V为所取溶液体积/mL;M为枣核粗品质量/g。
2 结果与分析
2.1 枣核总黄酮的微波辅助提取工艺单因素试验
2.1.1 料液比的选择
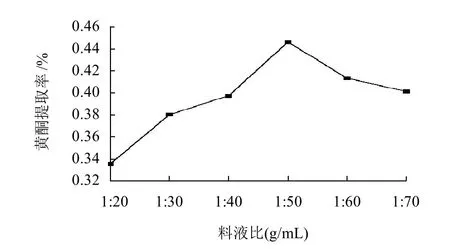
图1 料液比对枣核黄酮提取率的影响Fig.1 Effect of solid-to-solvent ratio on extraction efficiency of total flavonoids
由图1可知,随着溶剂量的增加,黄酮提取率呈现先升高后降低的趋势。当料液比在1:20~1:50时,提取率随着溶剂量的增大而升高,这是因为提取率的高低与黄酮向溶剂中扩散有关,料液比小,两相界面间的浓度差小,不利于黄酮的扩散。当料液比在1:50~1:70时,提取率反而降低,这可能是由于已浸出的黄酮对未浸出的黄酮的协同浸提作用的影响,料液比大,黄酮质量浓度下降,不利于协同浸提,因而总黄酮提取率反而降低。因此,选定1:30、1:40、1:50、1:60作为正交试验的4个水平。
2.1.2 乙醇体积分数的选择

图2 乙醇体积分数对枣核黄酮提取率的影响Fig.2 Effect of ethanol concentration on extraction efficiency of total flavonoids
由图2可知,随着乙醇体积分数的增大,枣核中总黄酮的提取率先增大后减小。这是因为乙醇对黄酮的溶解度比水大,乙醇对细胞的破坏作用比水强,在微波作用下表现得更加明显。乙醇体积分数在30%~60%之间时,枣核黄酮提取率较高。由此可以看出,乙醇体积分数不宜过高和过低,且乙醇体积分数过高会增加生产成本。因此,选定30%、40%、50%、60%作为正交试验的4个水平。
2.1.3 提取时间的选择

图3 提取时间对枣核黄酮提取率的影响Fig.3 Effect of extraction time on extraction efficiency of total flavonoids
由图3可知,随着微波作用时间的延长,枣核总黄酮的提取率迅速增大。这是因为微波穿透能力强,微波辐射能导致植物细胞内的极性物质,尤其是水分子吸收微波能,产生大量的热,使细胞内温度迅速上升,液态水汽化产生的压力将细胞膜和细胞壁冲破,使胞外溶剂进入细胞内,溶解并释放出胞内物质。但是,随着提取时间的延长,部分黄酮受热变质,黄酮提取率反而降低。因此,选定15、20、25、30min作为正交试验的4个水平。
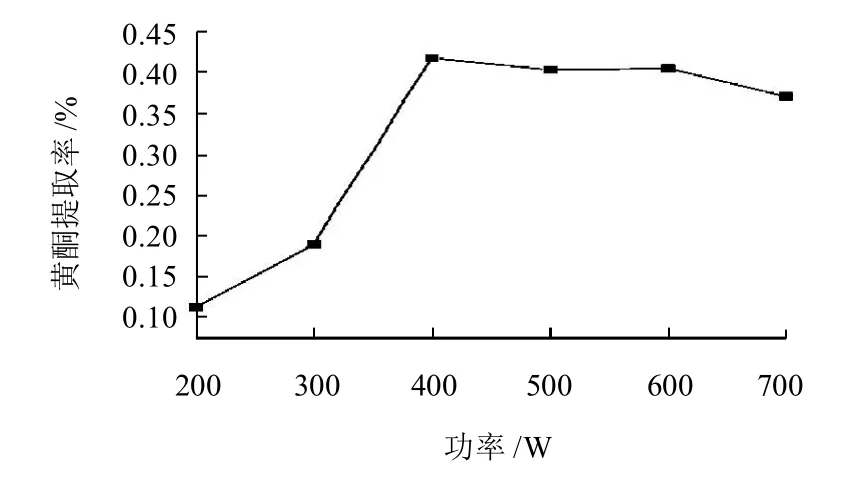
图4 微波功率对枣核黄酮提取率的影响Fig.4 Effect of microwave power on extraction efficiency of total flavonoids
2.1.4 微波功率的选择由图4可知,枣核黄酮的提取率随微波功率的增加而逐渐提高,这是因为随着微波功率的增加,加热速率增大,分子运动速度加快,黄酮类物质的提取率增大。但微波功率大于400W后,枣核总黄酮的提取率随微波功率的增加有所降低。原因可能是:一方面强热效应破坏了溶液中已有的枣核提取物中的黄酮成分;另一方面高温使蛋白质凝固,黄酮成分不易破壁溶出。因此,选定300、400、500、600W作为正交试验的4个水平。
2.1.5 提取温度的选择

图5 提取温度对枣核中黄酮提取率的影响Fig.5 Effect of extraction temperature on extraction efficiency of total flavonoids
由图5可知,随着微波辐射温度的上升,枣核中黄酮的提取率呈先升降的趋势。分析原因是:从较低温度升至60℃,热效率升高,分子运动加快,利于黄酮的破壁溶出;随着温度的继续升高,一方面已经溶出得黄酮随着热效应加强而变质,另一方面,高温逐渐使部分蛋白凝固不利于黄酮溶出。据此,选定50、60、70、80℃作为正交试验的4个水平。
2.2 枣核总黄酮的微波辅助提取工艺正交试验
根据单因素试验的结果,选取影响枣核总黄酮提取效果各因素中有意义的水平做正交试验,对结果进行极差分析,以确定最佳的提取条件。采用L16(45)正交表以提取时间(A)、微波功率(B)、料液比(C)、乙醇体积分数(D)和提取温度(E)作为5个考察因素,选取4个水平进行正交试验,因素及水平见表1,正交试验设计及结果见表2。

表1 枣核总黄酮的微波辅助提取工艺优化L16(45)正交试验因素水平表Table 1 Factors and levels used in orthogonal array design

表2 枣核总黄酮的微波辅助提取工艺优化L16(45)正交试验设计及结果Table 2 Orthogonal array design and corresponding experimental results
由表2数据极差分析可知,RC>RE>RA>RD>RB,各因素对枣核中总黄酮的提取率的影响程度依次为料液比>提取温度>提取时间>乙醇体积分数>微波功率,料液比对提取的影响最为显著,在试验设计的范围内,优化得到微提取枣核黄酮的最佳条件为A2B3C4D3E2,即提取时间20min、微波功率500W、料液比1:60、乙醇体积分数50%、提取温度60℃。枣核黄酮提取率预测值为0.657%以上。
2.3 最佳工艺条件验证实验
按A2B3C4D3E2条件进行3次平行试验,实测枣核黄酮提取率平均值为0.71%,此工艺条件下枣核黄酮提取率高于表2中任一组试验结果,故A2B3C4D3E2为最优实验条件。
2.4 枣核黄酮提取物粗品的制备
取3份枣核样品各10.0000g,采用上述最佳提取条件进行提取,得黄酮提取液,再按照1.3.2提取工艺,将该溶液进行浓缩精制,得到枣核黄酮粗品,称量计算得平均质量为1.0142g,计算得到黄酮粗品提取产率为10.14%,该枣核黄酮粗品中黄酮含量为7.00%,约为枣核样品中黄酮含量的10倍。
3 结 论
3.1 本实验采用正交试验法优选枣核黄酮的最佳提取工艺条件为料液比1:60、提取温度60℃、提取时间20min、乙醇体积分数50%、微波功率500W,得到枣核黄酮粗品的提取产率为10.14%,粗品中黄酮含量为7.00%。
3.2 实验采用微波提取方法,可以极大地缩短提取时间,且能达到较高的提取效率。因此,微波提取法是一种较为理想的提取方法,具有省时、高效、节能的优点。
[1] 国家药典委员会. 中华人民共和国药典[M]. 2005版. 北京: 化学工业出版社, 2005: 16.
[2] 刘润平. 红枣的营养价值及其保健作用[J]. 中国食物与营养, 2009 (12): 50-52.
[3] 王军, 张宝善, 陈锦屏. 红枣营养成分及其功能的研究[J]. 食品研究与开发, 2003, 24(2): 68-72.
[4] 李丽华, 陈锦屏. 和田玉枣总皂甙的提取工艺研究[J]. 食品科学, 2008, 29(11): 261-264.
[5] 苗利军, 刘孟军, 彭红丽, 等. 枣果中总黄酮含量分析[J]. 安徽农业科学, 2008, 36(22): 9460-9461.
[6] 张春兰, 张锐利, 熊素英, 等. 超声波辅助提取红枣核中总黄酮的研究[J]. 安徽农业科学, 2010, 38(12): 6503-6505.
[7] 郝会芳, 王艳辉, 苗笑阳, 等. 枣核中多酚物质提取条件的初步研究[J]. 华北农学报, 2007, 22(增刊1): 48-52.
[8] 许牡丹, 张瑞花, 王瑾锋. 枣核中总皂苷提取工艺的研究[J]. 食品科技, 2011, 36(1): 181-183.
[9] 张志国. 冬枣核类黄酮的提取工艺研究及其生物功能初探[D]. 西安:陕西师范大学, 2006.
[10] 张娜, 杨保求, 王倩, 等. 枣核黄酮类物质的抗氧化性研究[J]. 安徽农业科学, 2010, 35(8): 20037-20039.
[11] 卢彦芳, 张福成, 安静, 等. 微波辅助萃取应用研究进展[J]. 分析科学学报, 2011, 27(2): 246-252.
[12] 马文燕. 天然来源有效成分的微波辅助及离子液体微波辅助萃取技术应用研究[D]. 杭州: 浙江大学, 2010.
[13] 崔晓芳, 李伟阳, 魏婷婷, 等. 微波辅助提取油茶果壳木质素工艺优化[J]. 食品科学, 2011, 32(8): 98-102.
[14] 朱远平. 金柚皮总黄酮的微波辅助提取工艺研究[J]. 食品科学, 2009, 30(12): 73-77.
[15] 杨自嵘, 李平菊, 许莹堂, 等. 融冻微波破壁法提取枣核中黄酮类化合物及纯化研究[J]. 甘肃科技, 2006, 22(4): 112-114.
[16] 张进棠, 姚本林, 刘伏煌, 等. 银杏叶提取物中总黄酮的紫外分光光度测定[J]. 武汉化工学院学报, 1998, 20(1): 26-28.
更 正
本刊2012年14期第321~325页刊载的第一作者为徐安书的论文——《茎瘤芥叶胡萝卜混合汁复合乳酸菌发酵饮料的研制》补充基金项目“涪陵榨菜产业发展关键技术集成应用与创新服务体系建设项目(10)”。特此更正!
Optimization of Microwave-assisted Extraction of Total Flavonoids from Chinese Date Seeds
ZHANG Ji-xiang1,OU Lai-li,ang2
(1. Faculty of Chemistry and Material Science, Langfang Teachers College, Langfang 065000, China;
2. Key Laboratory of Bioactive Materials, Ministry of Education, Nankai University, Tianjin 300071, China)
Objective: Orthogonal array design was used to optimize the microwave-assisted extraction of total flavonoids from Chinese date seeds. Methods: Total flavonoids were spectrometrically determined using rutin as a reference compound. The effects of microwave power, extraction time, temperature, solid-to-solvent ratio and ethanol concentration on the extraction yield of total flavonoids were investigated by one-factor-at-a-time experiments. Subsequently, these extraction parameters were optimized by orthogonal array design. Results: Five extraction parameters were ranked in descending order of their effect on the extraction of total flavonoids as follows: solid-to-solvent ratio>extraction temperature>extraction time>ethanol concentration>microwave power. Their optimal levels were 1:60 (g/mL), 60 ℃, 20 min, 50% and 500 W, respectively. Under these conditions, the extraction yield of crude total flavonoids was 10.14%, and the total flavonoid content of the extract obtained was 7.00%. Conclusion: The extraction efficiency of total flavonoids from Chinese date seeds is remarkably increased by microwave extraction and orthogonal array optimization.
orthogonal array design;microwave extraction;Chinese date seeds;total flavonoids
S511
A
1002-6630(2012)16-0045-05
2011-07-06
河北省教育厅青年基金项目(2010156)
张吉祥(1973—),男,副教授,博士,研究方向为天然产物中有效成分的提取与分离。E-mail:zhangjixiang1973@163.com
