异甘露聚糖酶生产菌的诱变育种及固态发酵条件的优化
2012-10-27穆昭艳汪立平张大兵李安雪
穆昭艳,汪立平,*,张大兵,李安雪,汪 欣
(1.上海海洋大学食品学院,上海 201306;2.上海交通大学生命科学技术学院,上海 200240)
异甘露聚糖酶生产菌的诱变育种及固态发酵条件的优化
穆昭艳1,汪立平1,*,张大兵2,李安雪1,汪 欣1
(1.上海海洋大学食品学院,上海 201306;2.上海交通大学生命科学技术学院,上海 200240)
为了提高异甘露聚糖酶活性,对实验室保藏的一株分泌异甘露聚糖酶的枯草芽孢杆菌K-6(Bacillus subtilisK-6)进行紫外诱变育种,并优化一株正突变株的固态发酵条件。出发菌株枯草芽孢杆菌K-6的酶活力为206.0U/mL,经紫外线诱变处理后,挑选在培养基上透明水解圈较大的菌株进一步复筛,获得枯草芽孢杆菌K-6-9高产突变株,酶活力为349.3U/mL,高于出发菌株69.6%。连续5代发酵,K-6-9的酶活力范围为343.0~350.3U/mL,表明该突变菌株产酶性能稳定。以K-6-9为菌种,采用单因素试验和正交试验进行最佳固态发酵产酶条件的优化,结果表明:该突变株的固态发酵适宜发酵条件为:发酵时间72h、接种量3%、初始pH 7.5、装料量25g/250mL;培养基组成为:酵母细胞壁添加量8%、料液比1:1.2、麸皮添加量40%,此优化条件下固态发酵K-6-9菌株产酶酶活力最高达601.6U/mL。
异甘露聚糖酶;诱变育种;固态发酵
甘露聚糖酶是一种内切水解酶[1],作用底物主要是甘露聚糖,其主要水解产物为单糖、二糖、三糖、四糖等低聚糖[2]。根据其作用底物不同,甘露聚糖酶可分为β-甘露聚糖酶和异甘露聚糖酶[3],其中,β-甘露聚糖酶的作用底物为魔芋粉、槐豆胶等植物多糖,通过β-1,4-D-甘露吡喃糖苷键连接而成的直链或支链聚合糖;异甘露聚糖酶的作用底物为主要存在于酵母等微生物的细胞壁中的异甘露聚糖,异甘露聚糖以α-1,6-D-甘露糖为骨架链,其中大部分甚至全部的残基具有α-1,2-或-1,3-连接的含有2~5个甘露糖残基的侧链。经异甘露聚糖酶水解得到的甘露寡糖经研究发现对动物的生长发育具有一系列积极作用。如促进动物生长、提高动物的饲料转化效率[4-6];促进消化,改善动物肠道微生物生态环境及健康状况[7];促进动物肠道有益菌的生长[8];提高机体免疫活性和抑制肿瘤生长[9];吸附真菌毒素,减少抗生素等化学药物的使用是生产绿色动物食品的添加剂[10]。
啤酒废酵母是啤酒生产中最主要的副产物,我国大多数厂家主要处理啤酒废酵母的方式是将其直接干燥后作为饲料,其经济效益甚微[11]。因此利用微生物技术将啤酒废酵母中的甘露聚糖开发出附加值高、技术含量高、有足够竞争性的甘露寡糖新产品,可为废弃的啤酒酵母再利用提供了新思路,并提高了经济效益和社会效益。本研究将以实验室保藏的分泌异甘露聚糖酶的一株枯草芽孢杆菌K-6为出发菌株,通过紫外诱变育种进行菌种改良,并对诱变改良后的最优菌株的产酶固态发酵培养基进行优化,从而高效制备异甘露聚糖酶,为啤酒废酵母中甘露聚糖的充分利用提供理论基础和部分技术参数。
1 材料与方法
1.1 菌株与试剂
产异甘露聚糖酶的枯草芽孢杆菌K-6(Bacillus subtilisK-6)菌株,由上海海洋大学食品学院食品科学与生物技术研究室筛选和保藏。
琼脂粉、酵母浸膏、蛋白胨、氯化钠、磷酸氢二钠、柠檬酸 国药集团化学试剂有限公司;槐豆胶美国Sigma公司;酵母细胞壁 本实验室自制[12];麸皮市售。
1.2 仪器与设备
PHX-DHS-X型隔水式电热恒温培养箱 上海跃进医疗器械厂;YXQLD31-400型立式消毒锅 上海江南容器厂;电热鼓风干燥箱 重庆银河试验仪器有限公司;洁净工作台SW-CJ-1F 上海博迅实业有限公司;UV-2000分光光度计 上海安亭科学仪器厂;CR21G冷冻离心机 日本日立公司。
1.3 方法
1.3.1 培养基配制
基础培养基:酵母细胞壁3g、蛋白胨10g、NaCl 5g、水1000mL、琼脂15g;活化培养基:酵母细胞壁3g、蛋白胨10g、NaCl 5g、水1000mL、琼脂15g;发酵培养基:酵母细胞壁8g、蛋白胨10g、NaCl 5g、水1000mL;初始固态发酵培养基:水50%、麸皮40%、酵母细胞壁8%、NaCl 0.5%,初始接种量2%。
1.3.2 出发菌株筛选
用基础培养基对产异甘露聚糖酶的菌株进行分离纯化,将纯化后的单个菌落点种到培养基上,37℃发酵24h后进行产酶筛选,选取产酶活性较高且稳定的菌株作为诱变育种的出发菌株。
1.3.3 菌悬液制备
将确定的出发菌株进行液体发酵,至对数生长期后取菌液进行离心,用无菌生理盐水调整到浓度为108CFU/mL的细胞悬液备用。
1.3.4 致死曲线的绘制
每组取6mL菌悬液,放入直径为9cm的平皿中,在黑暗中用15W紫外灯距离30cm在磁力搅拌器下分别照射0(对照组)、30、45、60、90、120、180s,将诱变后的菌液采用稀释涂布法[13]涂布于平板上,稀释梯度为10-1~10-7,取各剂量的 10-1、10-3、10-5、10-74 个梯度的细胞悬液0.1mL涂布于基础培养基平板,每个梯度涂2个,涂布后立即用黑牛皮纸包扎好,倒置37℃避光发酵24h。以未诱变菌液发酵后的菌落数为基准计算不同诱变时间的致死率,以照射时间为横坐标,致死率为纵坐标绘制杀菌曲线。

式中:n1为对照组的菌落总数/(CFU/mL);n2为诱变处理后的菌落总数/(CFU/mL)。
1.3.5 紫外线诱变及筛选
选取致死率在80%~90%的紫外线照射时间作为最适处理剂量处理出发菌株。挑取突变菌株点种到基础培养基上,利用碘液进行初筛,通过比较原始菌株的水解圈直径与菌落直径的比值(H/C),筛选出产酶能力强的正突变菌株,选择H/C相对较大的15株菌株利用DNS法进一步复筛。紫外诱变后所有操作在红灯下进行,紫外线诱变每一次都是以此次诱变的前次诱变筛选出的酶活力增幅最大的菌株作为出发菌株,重复前面诱变及筛选的步骤。连续诱变11次。
1.3.6 遗传稳定性的测定
将筛选出的突变菌株连续转接5代,分别测定各代菌株酶活力的大小,以测定其遗传稳定性。
1.3.7 粗酶液的制备
取培养好的固体产酶培养基10g加入蒸馏水100mL,搅拌均匀后40℃保温1h后过滤,取滤液3000r/min离心10min,取上清液即为粗酶液[14]。
1.3.8 异甘露聚糖酶活力的测定
采用DNS法测定酶活力[2],用0.1mol/L柠檬酸和0.2mol/L磷酸氢二钠缓冲液配制成pH值为6.5的以酵母细胞壁为底物的溶液,酵母细胞壁的质量浓度为0.5g/L。因为很难制备得到纯的酵母甘露聚糖,且酵母甘露聚糖在酵母细胞壁中是以糖蛋白的混合物形式存在,所以直接使用酵母细胞壁代替酵母甘露聚糖作为底物。取底物缓冲液0.9mL预热至60℃,添加0.1mL的粗酶液,60℃反应10min,加入1mL DNS试剂,然后在沸水浴中显色5min,取出冷却后用蒸馏水定容至10mL,摇匀,于540nm波长处测定OD值。异甘露聚糖酶活力的定义为:底物每分钟释放出相当于1μmolD-甘露糖的还原糖所需的酶量为1个酶活力单位(U)。
1.3.9 种子液的制备
将菌株接种到10mL活化培养基的试管中37℃发酵24h后,按照10%的接种量接种到发酵培养基发酵,37℃、200r/min振荡发酵24h,得到的菌液即为种子液。
1.3.10 固态发酵培养基的优化
在原固态发酵培养基的基础上,选择酵母细胞壁添加量和氮源及氮源添加量2个因素进行了单因素梯度试验,对固态发酵培养基进行初步优化。
1.3.11 固态发酵条件的优化
在原固态发酵条件下对发酵时间、接种量、p H值、料液比、装料量5个因素进行单因素试验,对固态发酵条件进行初步优化。通过固态发酵培养基和发酵条件的优化试验结果进行分析后,采用以五因素四水平的正交试验来优化发酵培养基的配比和发酵条件。
2 结果与分析
2.1 最适诱变剂量的选择

图1 紫外诱变时间对枯草芽孢杆菌致死率的影响Fig.1 Effect of UV irradiation time on the death rate of Bacillus subtilis K-6
由图1可知,紫外线诱变时间与产异甘露聚糖酶的枯草芽孢杆菌菌株的致死率之间存在明显的剂量效应关系。随着紫外线诱变时间的延长,存活率逐渐降低。诱变诱变时间较长时致死率越高,一般致死率在90%以上时,其单位存活细胞中的正突变菌株较少,负突变菌株较多。但当致死率为80%~90%时,单位存活的细胞中正突变菌株较多[15]。当诱变时间为90s时其致死率为82.3%,因此选择诱变时间为90s作为诱变剂量。
2.2 诱变菌株的初筛与复筛
通过初筛选择H/C相对较大的15株菌株通过DNS法进一步复筛,以异甘露聚糖酶出发菌株编号为K-6-0为对照,测定发酵液的异甘露聚糖酶活力。突变菌株4号酶活力最高为264.5U/mL,比出发菌株的酶活提高了28.4%,所以选择4号突变菌株为第2次紫外诱变的出发菌株,以后的每一次诱变如前述步骤,经11次紫外诱变后得到一株酶活力最高的突变菌株9号,其酶活力为349.3U/mL,高于出发菌株69.6%,将其命名为枯草芽孢杆菌K-6-9。
2.3 遗传稳定性
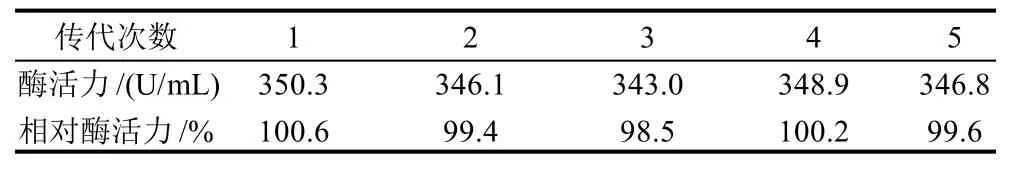
表1 突变菌株稳定性的研究Table 1 Genetic stability of strain K-6-9
对紫外诱变得到的异甘露聚糖酶活力最高的K-6-9突变株进行了遗传稳定性研究,将K-6-9突变株连续5代发酵,每传一代均接种到发酵培养基中发酵48h后测定酶活力。由表1可知,产异甘露聚糖酶菌株K-6-9突变株连续5代发酵后,酶活力范围为343.0~350.3U/mL,具有较好的遗传稳定性。
2.4 突变株K-6-9固态培养基和发酵条件的优化
2.4.1 自制酵母细胞壁添加量对产酶的影响
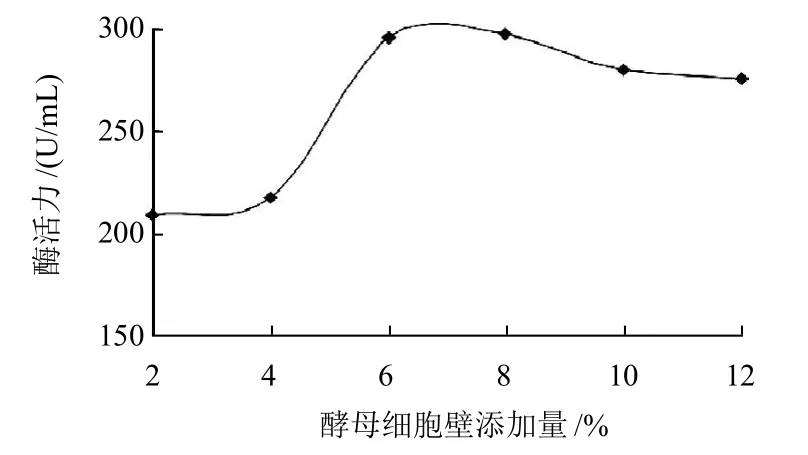
图2 酵母细胞壁添加量对产酶的影响Fig.2 Effect of yeast wall amount on the production of isomannanase
异甘露聚糖酶是一种诱导酶,研究表明酵母细胞壁中含有大量的异甘露聚糖,对异甘露聚糖酶具有较强的诱导作用。选用麸皮作为碳源,在固态发酵培养基上加入2%、4%、6%、8%、10%、12%不同质量分数的自制酵母细胞壁,以2%的接种量将种子液接入固态发酵培养基中混匀,37℃发酵72h后测定酶活力,结果如图2所示。加入8%自制酵母细胞壁量时酶活力最高。酵母细胞壁对产酶有诱导作用,还作为碳源为菌株的生长提供能量,所以并不是碳源浓度越高对菌株的生长越有利,培养基中的碳源浓度过高也会导致细胞脱水而使代谢产物降低[16]。
2.4.2 氮源对产酶的影响
选择6种氮源,其添加量占固态发酵培养基的1%,以不添加氮源的为对照组。酵母细胞壁添加量8%,培养基其余成分不变,以2%的接种量将种子液接入到固态发酵培养基中,混匀后置37℃培养箱中发酵72h后测定酶活力,结果如图3所示。利用SPSS软件对数据进行方差分析得知6种氮源对产酶量均有显著差异(P<0.05),从而选取添加后其酶活力最高的氯化铵做后续实验。

图3 氮源对产酶的影响Fig.3 Effect of inorganic nitrogen sources on the production of isomannanase
2.4.3 装料量对产酶的影响
氯化铵添加量5%、接种量2%,其余同初始固态发酵培养基。将15、20、25、30g固态培养基分别装入250mL三角瓶中,37℃静置发酵72h,固态发酵过程中,由于单位体积的固态培养基的堆积和高菌体浓度会促使微生物代谢产生了大量的热量无法及时传递,而导致固态培养基中温度的上升,需考虑调节装料量使其尽量达到菌体的最佳生长状况及最佳的产酶效果。

图4 装料量对产酶的影响Fig.4 Effect of medium loading amount on the production of isomannanase
由图4可知,在装料量为25g/250mL时枯草芽孢杆菌酶活力最高,随着装料量的增加其酶活力迅速下降,说明固态培养基过多堆积使温度上升,不适宜菌体的生长及酶的产生。
2.4.4 料液比对产酶的影响
培养基中水分含量对菌体的生长有很大的影响。培养基中的料水比应适中,水分太高会使麸皮成团,影响培养基的透气性与散热性,水分太低会影响培养基中营养物质的溶解和传递[17],也不能满足菌体生长对水分的需求。固态发酵培养基装料量25g/250mL、酵母细胞壁添加量8%、接种量2%,改变料液比分别为1:0.6、1:0.8、1:1.0、1:1.2、1:1.4、1:1.6,混匀后置37℃培养箱中发酵72h后测定酶活力,结果如图5所示,料液比为1:1.0时酶活力最高,对产酶最有利。
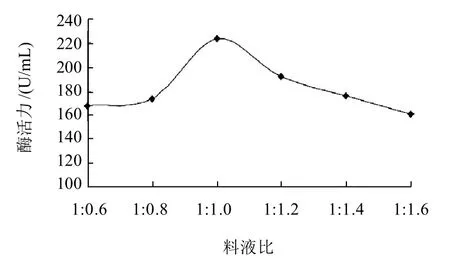
图5 料液比对产酶的影响Fig.5 Effect of material-to-liquid ratio on the production of isomannanase
2.4.5 接种量对产酶的影响
固态发酵培养基的料液比为1:1,其他组成及发酵条件不变,分别以1%、2%、3%、4%、5%的接种量将液态种子液接入到固态发酵培养基中,混匀后37℃发酵72h后测定酶活力,结果如图6所示,当接种量为3%时酶活力最高。因为接种量过低会导致菌体生长缓慢,发酵周期延长;而过高则影响菌体生长过快,造成温度升高过快从而影响酶的产生。

图6 接种量对产酶的影响Fig.6 Effect of inoculum amount on the production of isomannanase
2.4.6 初始pH值对产酶的影响
将固态发酵培养基分别用1mol/L的HCl和NaOH调至pH值为5.0、5.5、6.0、6.5、7.0、7.5、8.0,高压灭菌后,以3%接种量将种子液接入到固态发酵培养基中,混匀后置37℃培养箱中发酵72h后测定酶活力,结果如图7所示。当pH7.0时酶活力最高,因此在pH7.0时最适宜菌体的生长及酶的产生。

图7 pH值对产酶的影响Fig.7 Effect of pH on the production of isomannanase
2.4.7 发酵温度和时间对产酶的影响
温度不仅会影响菌体的生长、繁殖和新陈代谢,也会影响酶的产生及活性。菌体在生长繁殖期的对数期时其代谢活动最旺盛,最利于酶的产生,因此要考虑发酵时间,使其达到最佳的产酶时间。在32、34、36、38℃条件下,分别用优化后的培养基组分和发酵条件进行发酵,发酵24、36、48、60、72、84、96、108h分别取样,测定其酶活力,结果如图8所示。在36℃发酵其酶活力最高,说明温度偏低会使酶活力受到抑制[16],细胞的新陈代谢活动减弱。随着发酵时间的增加其产酶量也随之增加,当发酵至72h后随着时间的增加产酶量有缓慢降低的趋势,有可能是因为发酵时间较长培养基中的营养物质完全消耗,菌体可以利用产生的酶可以作为碳源维持自身的需要,所以后期随着时间的增加产酶量减少。因此选择72h作为最佳发酵时间。

图8 发酵温度和时间对产酶的影响Fig.8 Effect of fermentation temperature and time on production of isomannanase
2.4.8 正交试验结果
在单因素试验的基础上,确定了装料量为25g/250mL,无机氮源选取了氯化铵,剩余的5个因素设计按表2,以异甘露聚糖酶活力为指标,进行表2所示的L16(45)正交试验。

表2 L16(45)正交试验分析结果Table 2 L16(45) orthogonal array design arrangement and corresponding experimental results
由表2可知,正交试验16组中得出的最优工艺组合为第12组。在此条件下,菌株产生的酶活力可达576.4U/mL。根据正交试验结果极差分析得到发酵时间对菌株的产酶能力影响最大,5个因素对菌株产酶能力影响强度大小为:A>C>D>E>B,即发酵时间>pH值>酵母细胞壁添加量>料液比>接种量。菌株产酶的最优组合条件是:A3B3C3D2E3,即发酵时间为72h、接种量为3%、pH值为7.5、酵母细胞壁添加量8%、料液比为1:1.2。由于最优组合并未出现在16组试验中,所以需要进行验证实验。
经实验验证最优组合A3B3C3D2E3获得的酶活力为601.6U/mL,高于正交试验中出现的最高值576.4U/mL,所以选择A3B3C3D2E3为最终发酵工艺条件。
3 结 论
产异甘露聚糖酶菌株在紫外线照射90s时致死率为82.3%,因此选择诱变时间为90s作为诱变剂量。经11次紫外诱变后通过初筛和复筛得到一株异甘露聚糖酶突变菌株K-6-9酶活最高为349.3U/mL,高于出发菌株69.6%。
经单因素试验和正交试验优化异甘露聚糖酶突变菌株K-6-9的固态发酵工艺条件,得出产酶的最适宜发酵条件为:pH7.5、装液量25g/250mL、料液比为1:1.2、接种量为3%、发酵72h后测酶活力为601.6U/mL。
现文献只有关于对β-甘露聚糖酶诱变育种及其固态发酵的报道[18],异甘露聚糖酶的诱变育种及固态发酵条件的研究未见详细报道。本研究固态发酵具有成本低廉、工艺简单、操作粗放、能耗低、零污染等优点,具有较好的工业化生产潜力。
[1] SCHOMBUG D, SALZMANN M. Eyzyme hand book[M]. Springer Verlag Berlin Heideberg, 1991: 1-5.
[2] AKINO T, NAKAMURA N, HORIKOSH K. Production ofβmannosidase andβ-mannanase by an alkalophilicBacillussp. [J]. Appl Microbio Biotechnol, 1987, 26(4): 323-327.
[3] 张闻, 汪立平, 汪之和, 等. 甘露聚糖酶产生菌F1-5的鉴定及发酵条件的研究[J]. 食品科学, 2009, 30(21): 288-293.
[4] 李自金, 邱波, 童运彬. 啤酒酵母取代鱼粉在草鱼上的应用[J]. 饲料工业, 2009, 30(20): 25-26.
[5] WALDROUP A L, SKINNER J T, HIERHOLZER R E, et al. An evaluation of fructooligosaccharide in diets for broiler chickens and effects on salmonellae contamination of carcasses[J]. Poultry Sci, 1993, 72: 643-650.
[6] SHAFEY T M, AL MUFAREJ S, SHALABY M J, et al. The effect of feeding mannan-oligsaccharides(Bio-MOS) on the performance of meat chickens under two different vaccination programs[J]. Asian Aust J Anim Sci, 2001, 14(4): 559-563.
[7] 潘俊福, 徐春厚.β-甘露聚糖酶的营养免疫功能及其在动物生产中的应用[J]. 湖南饲料, 2007(4): 19-21.
[8] 张力华, 黄代勇, 王卫华. 甘露低聚糖对小鼠肠道菌群的调节作用[J]. 中国中西医结合消化杂志, 2006, 14(6): 380-381.
[9] 徐军发, 侯敢, 黄迪南, 等. 酵母多糖对小鼠腹腔巨噬细胞产生一氧化氮和白细胞介素-1的影响[J]. 中国生化药物杂志, 2002, 23(2): 67-68.
[10] 赵芳芳, 张日俊. 酵母细胞壁生理功能及其应用[J]. 中国饲料, 2003(17): 17-18.
[11] 徐慧, 刘建军, 赵祥颖. 浅谈啤酒废酵母的综合利用[J]. 酿酒, 2008,35(1): 47-49.
[12] 马相杰, 汪立平, 冷向军, 等.β-甘露聚糖酶水解酵母细胞壁水解条件的研究[J]. 食品科技, 2009, 34(2): 7-10.
[13] 诸葛健, 王正祥. 工业微生物实验技术手册[M]. 北京: 中国轻工业出版社, 1994.
[14] 杨先芹, 孙丹, 杨文博, 等. 地衣芽孢杆菌NK-27菌株的产酶条件和粗酶性质的研究[J]. 南开大学学报, 2002, 35(2): 117-120.
[15] 常旭虹, 赵广才, 张雯, 等. 作物残茬对农田土壤风蚀的影响[J]. 水土保持学报, 2005, 19(1): 28-31.
[16] 杨清香, 曹军卫. 嗜碱芽孢杆菌NTT33产碱性β-甘露聚糖酶发酵条件的研究及高产菌株选育[J]. 氨基酸和生物资源, 1998, 20(4): 14-18.
[17] 陈士成, 曲音波, 高培基. 芽孢杆菌A-30产碱性β-1,4-聚糖酶固体发酵研究[J]. 微生物学通报, 2000, 27(3): 188-191.
[18] 朱劼, 邬敏辰. 酸性β-甘露聚糖酶的固态发酵和一般特性[J]. 生物技术, 2003, 13(2): 30-32.
Optimization of Mutation Breeding and Solid-State Fermentation Conditions for Isomannanase-Producing Strain
MU Zhao-yan1,WANG Li-ping1,*,ZHANG Da-bing2,LI An-xue1,WANG Xin1
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;2. School of Life and Technology, Shanghai Jiao Tong University, Shanghai 200240, China)
In order to improve the activity of isomannanase,Bacillus subtilisK-6, a strain capable of secreting isomannanase,was subjected to mutation breeding through UV induction. A positive mutant strain was obtained and fermentation conditions for the production of isomannanase by it were optimized by one-factor-at-a-time and orthogonal array design methods. The isomannanase activity of the original strain was 206.0 U/mL, while that of the high-yield mutant strain K-6-9 was 349.3 U/mL,showing a 69.6% increase compared withBacillus subtilisK-6. The isomannanase activity of the fifth generation of K-6-9 varied from 343.0~350.3 U/mL, indicating good genetic stability. The optimal fermentation conditions for isomannanase production by K-6-9 were found as 72 h of fermentation time, 3% of inoculum size, initial pH 7.5, and 25 g/250 mL of medium filling percentage.The optimal fermentation medium was composed of 40% wheat bran, 8% yeast wall and material-to-liquid ratio 1:1.2.The maximum activity of K-6-9 strain reached up to 601.6 U/mL under the optimal fermentation conditions.
isomannanase;UV mutation;solid-state fermentation
TS201.3
A
1002-6630(2012)15-0220-06
2011-06-29
上海市教育委员会重点学科建设项目(J50704);上海市教育委员会重点创新项目(07ZZ137)
穆昭艳(1986—),女,硕士,研究方向为食品微生物。E-mail:muzhaoyan0501@126.com
*通信作者:汪立平(1968—),女,副教授,博士,研究方向为功能性寡糖、酿酒科学与技术及大豆精深加工。E-mail:lpwang@shou.edu.cn
