丰年虫水溶性蛋白的分离纯化及体外抗氧化性研究
2012-10-27张建新李文学
聂 路,张建新*,李文学,刘 胐
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
丰年虫水溶性蛋白的分离纯化及体外抗氧化性研究
聂 路,张建新*,李文学,刘 胐
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
目的:对丰年虫水溶性蛋白进行分离纯化,获得体外抗氧化活性最好的水溶性蛋白组分,并测定其分子质量。方法:丰年虫水溶性粗蛋白经硫酸铵沉淀、透析、DEAE-Sepharose FF离子交换层析和Sephadex G-100凝胶层析分离纯化,对纯化后的蛋白质进行体外抗氧化活性的研究,利用SDS-PAGE电泳测定蛋白质分子质量。结果:丰年虫水溶性蛋白经DEAE-Sepharose FF离子交换层析,梯度洗脱得到4个洗脱峰(峰1~4),峰2的体外抗氧化活性最强。峰2经Sephadex G-100凝胶层析分离纯化得到3个洗脱峰(峰2-1~2-3),峰2-1的体外抗氧化活性最强。利用SDS-PAGE对峰2-1进行鉴定,得到单一蛋白条带,纯度较高,蛋白分子质量为82.47kD。体外抗氧化活性比较,峰2-1远远强于水溶性粗蛋白。结论:蛋白组分峰2-1体外抗氧化活性最强,为单一蛋白组分,其分子质量为82.47kD。
丰年虫;水溶性蛋白;分离纯化;抗氧化活性
丰年虫(Eubranchipus vernalis),又名丰年虾、咸水丰年虾,是无甲目(Anostraca)甲壳动物。研究表明,丰年虫富含蛋白质等营养物质,根据Saito法,对其蛋白质进行分类提取,发现水溶性蛋白的体外抗氧化活性最强[1]。本研究通过硫酸铵沉淀、透析、D E A ESepharose FF离子交换层析和Sephadex G-100凝胶层析分离纯化丰年虫水溶性蛋白,测定其羟自由基(·OH),超氧阴离子自由基(O2-·)和DPPH自由基清除率,研究丰年虫水溶性蛋白的体外抗氧化活性,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对所纯化的蛋白进行鉴定,为对丰年虫蛋白质全方位多用途开发提供科学依据。
1 材料与方法
1.1 材料与试剂
丰年虫,由陕西丰源生物科技有限公司提供。
DEAE-Sepharose FF纤维素、Sephadex G-100 西安沃尔森有限责任公司;石油醚、三羟甲基氨基甲烷(tris)、浓盐酸、硫酸亚铁、双氧水、水杨酸、磷酸氢二钾、磷酸二氢钾、邻苯三酚、1,1-二苯基-2-三硝基苯肼(DPPH)、铁氰化钾、三氯乙酸、三氯化铁、硫酸铵、聚乙二醇6000、考马斯亮蓝R250等均为分析纯;SDS、丙烯酰胺、N,N-甲叉双丙烯酰胺、四甲基乙二胺均为电泳级。
1.2 仪器与设备
FA2004分析天平 北京赛多利斯仪器系统有限公司;DF-101S恒温磁力搅拌器 郑州长城科工贸有限公司;KDC-40低速离心机 科大创新股份有限公司中佳分公司;ZDJ-4A型自动电位滴定仪 上海精密科学仪器有限公司;UV-2550紫外分光光度计 日本岛津公司;PM180R高速冷冻离心机、SIM-FD5505P真空冷冻干燥机 德国西门子公司;自KDY-9830动凯氏定氮仪Ketuo公司;层析柱(玻璃柱1.60cm×100cm、1.60cm×50cm) 自制;SBS-100数控记滴自动部份收集器、HL-2B数显恒流泵 上海沪西分析仪器厂有限公司;电泳槽(8.2cm×8.5cm) 北京市六一仪器厂;EPS-300型电泳仪上海民仪电子有限公司。
1.3 方法
1.3.1 丰年虫脱脂粉的制备
丰年虫经60℃烘干至恒质量,研钵冰浴2h,研磨过80目筛,用石油醚对丰年虫进行索氏提取脱脂,脱脂粉在室温下风干12h,置于4℃冰箱保存备用。
1.3.2 丰年虫水溶性蛋白质的提取
根据Saito法[2],提取丰年虫水溶性蛋白,取5g丰年虫脱脂粉,加入10倍体积的0.02mol/L Tris-HCl缓冲液(pH7.4),40℃搅拌提取120min,3500r/min离心20min,收集上清液。测定上清液中水溶性蛋白含量。蛋白质含量测定采用凯氏定氮法,参照GB 5009.5-2010《食品中蛋白质的测定》[3]。

在上清液中加入硫酸铵固体至饱和度为70%(0℃硫酸铵70%饱和度质量浓度为472g/L),0℃放置30min,10000r/min离心10min,沉淀溶于0.02mol/L Tris-HCl缓冲液(pH7.4),在4℃条件下透析48h,冷冻干燥,所得即为水溶性蛋白[4]。
1.3.3 丰年虫水溶性蛋白的分离与纯化过程
丰年虫水溶性蛋白提取液→硫酸铵分级沉淀(70%饱和度)→透析→DEAE-Sepharose FF离子交换层析→体外抗氧化活性测定→Sephadex G-100凝胶层析→体外抗氧化活性测定→SDS-PAGE电泳
1.3.4 DEAE-Sepharose FF离子交换层析
取20mg丰年虫水溶性蛋白粗品,溶于2mL 0.02mol/L Tris-HCl缓冲液(pH7.4),3000r/min离心10min,取上清液加入DEAE-Sepharose FF离子交换柱(1.6cm×50cm),先用0.02mol/L Tris-HCl缓冲液(pH7.4)洗脱未被吸附的蛋白质,再用含0.1~0.5mol/L NaCl的0.02mol/L Tris-HCl缓冲液(pH7.4)连续洗脱被吸附的蛋白质,洗脱速率1mL/min,每5mL收集一管,每种浓度洗脱100mL,280nm波长处逐管检测,收集洗脱峰,用聚乙二醇6000反透浓缩洗脱峰,冷冻干燥[5]。
1.3.5 Sephadex G-100凝胶层析
取20mg经DEAE-Sepharose FF离子交换层析后冷冻干燥样品,溶于2mL 0.02mol/L Tris-HCl缓冲液(pH7.4),3000r/min离心10min,取上清液加入Sephadex G-100凝胶柱(1.6cm×100cm),用0.02mol/L Tris-HCl缓冲液洗脱,洗脱速率0.4mL/min,每4mL收集一管,洗脱液体积为柱体积3倍。280nm波长处逐管检测,收集洗脱峰,用聚乙二醇6000反透浓缩洗脱峰,冷冻干燥[6]。
1.3.6 SDS-PAGE电泳分析
SDS-PAGE电泳采用不连续体系进行。在蛋白质样品中加入质量分数为2%的SDS和β-巯基乙醇后,100℃水浴3min。分离胶12%,浓缩胶4%[7],电极缓冲液用Tris-甘氨酸电极缓冲液。用水-异丙酮-冰醋酸(体积比13:5:2)的0.1%考马斯亮蓝R250染色,水-乙醇-冰醋酸(体积比1 7:1:2)脱色。恒流电泳,浓缩胶电泳电流10mA,分离胶电泳电流20mA。浓缩胶电泳时间1h,分离胶电泳时间3h。采用低分子质量标准蛋白质作为对照[8],计算纯化后蛋白质分子质量,溴酚蓝为指示剂[9]。1.3.7 体外抗氧化活性测定
体外抗氧化研究主要选定·OH、O2-·和DPPH自由基。·OH清除率:参照水杨酸法[10];O2-·清除率:参照邻苯三酚自氧化法[11];DPPH自由基清除率:参照Boonmee[12]、Brand-Williams[13]等的方法。
2 结果与分析
2.1 丰年虫水溶性蛋白质提取率
由表1可知,丰年虫脱脂粉中总蛋白和水溶性蛋白含量分别占脱脂粉的60.18%和33.64%,水溶性蛋白占总蛋白的55.90%。

表1 丰年虫脱脂粉中水溶性蛋白质相对百分含量Table 1 Relative content of water-soluble protein in Eubranchipus vernalis
2.2 DEAE-Sepharose FF离子交换层析

图1 丰年虫水溶性蛋白DEAE-Sepharose FF柱洗脱图谱Fig.1 Purification profile of water-soluble protein from Eubranchipus vernalis on DEAE-sepharose fast flow anion-exchange column
由图1可知,丰年虫水溶性粗蛋白经D E A ESepharose FF离子交换层析,用0.02mol/L Tris-HCl缓冲液(pH7.4)和0.1~0.3mol/L NaCl的0.02mol/L Tris-HCl缓冲液(pH7.4)洗脱,分别得到一个洗脱峰(峰1~4),0.4mol/L NaCl-0.02mol/L Tris-HCl缓冲液(pH7.4)和0.5mol/L NaCl-0.02mol/L Tris-HCl缓冲液(pH7.4)没有得到洗脱峰[14]。峰1直接被0.02mol/L Tris-HCl缓冲液(pH7.4)洗脱下来,说明该部分蛋白质不能为离子交换剂所吸附。随着洗脱液离子强度的增大,与离子交换柱结合紧密的蛋白质也被洗脱下来,分别为峰2、峰3、峰4。分别收集这4个洗脱峰,用聚乙二醇6000浓缩,冷冻干燥备用。
2.3 DEAE-Sepharose FF离子交换层析的洗脱峰体外抗氧化活性测定
表2 DEAE-Sepharose FF离子交换层析各峰组分体外抗氧化活性结果(±s, n=3)Table 2 Antioxidant activity of each fraction obtained by DEAE-sepharose fast flow anion-exchange chromatography(± s, n=3)
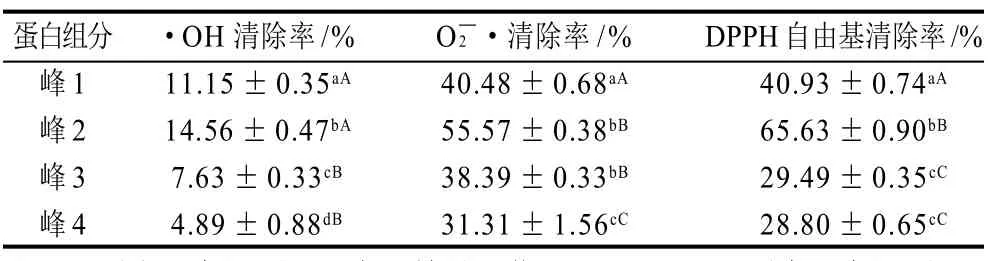
表2 DEAE-Sepharose FF离子交换层析各峰组分体外抗氧化活性结果(±s, n=3)Table 2 Antioxidant activity of each fraction obtained by DEAE-sepharose fast flow anion-exchange chromatography(± s, n=3)
注:同列小写字母不同,表示差异显著(P<0.05);同列大写字母不同,表示差异极显著(P<0.01)。下同。
蛋白组分 ·OH清除率/%O2-·清除率/%DPPH自由基清除率/%峰1 11.15±0.35aA 40.48±0.68aA 40.93±0.74aA峰2 14.56±0.47bA 55.57±0.38bB 65.63±0.90bB峰3 7.63±0.33cB 38.39±0.33bB 29.49±0.35cC峰4 4.89±0.88dB 31.31±1.56cC 28.80±0.65cC
DEAE-Sepharose FF离子交换层析获得的4个洗脱峰的冻干品,配制成0.05mg/mL蛋白质溶液,测定其体外抗氧化活性。由表2可知,·OH、O2-·和DPPH自由基清除率的测定结果大小排序均为:峰2>峰1>峰3>峰4,峰2对·OH、O2-·和DPPH自由基的清除率分别为14.56%、55.57%和65.53%。因此实验将大量收集峰2进行下一步纯化。
2.4 Sephadex G-100凝胶层析
葡聚糖凝胶分离蛋白质根据分子筛原理,蛋白质按分子质量大小从大到小洗脱下来。Sephadex G-100凝胶层析见图2。
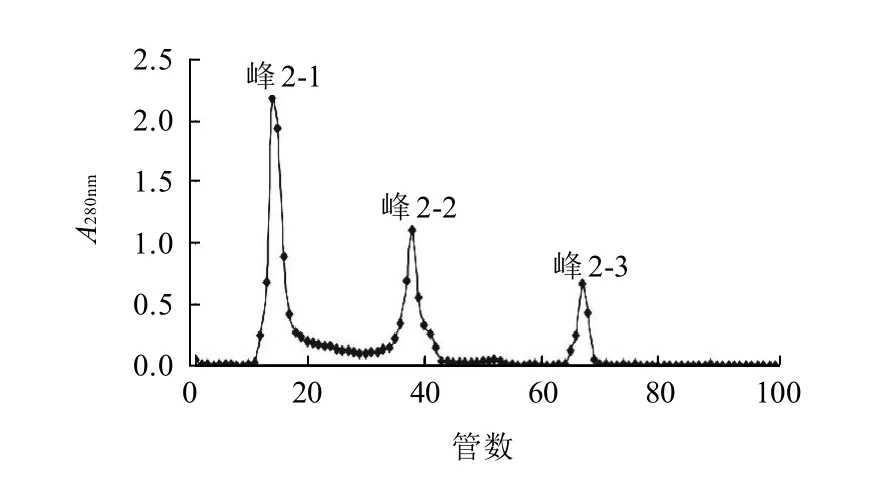
图2 Sephadex G-100分离纯化峰2的洗脱图谱Fig.2 Purification profile of Peak-2 on Sephadex G-100 gel permeation column
由图2可知,Sephadex G-100凝胶层析分离纯化峰2,出现3个蛋白峰(峰2-1、峰2-2和峰2-3),分别收集这3个洗脱峰,用聚乙二醇6000浓缩,冷冻干燥备用。2.5 Sephadex G-100凝胶层析洗脱峰体外抗氧化活性测定
Sephadex G-100凝胶层析获得的3个洗脱峰冻干品,配制成0.05mg/mL蛋白质溶液,测定其体外抗氧化活性。由表3可知,·OH清除率大小排序为:峰2-1>峰2-3>峰2-2,而O2-·和DPPH自由基清除率的结果大小排序大致为:峰2-1>峰2-2>峰2-3,峰2-1对·OH、O2-·和DPPH自由基的清除率分别为23.22%、58.35%和71.37%。因此对峰2-1采用SDS-PAGE电泳鉴定其分子质量。

表3 Sephadex G-100凝胶层析各峰组分体外抗氧化活性测定Table 3 Antioxidant activity of each sub-fraction obtained by Sephadex G-100 gel permeation chromatography
2.6 SDS-PAGE电泳结果

图3 峰2-1组分SDS-PAGE电泳图谱Fig.3 SDS-PAGE of Peak 2-1
由图3可知,经DEAE-Sepharose FF离子交换层析和Sephadex G-100凝胶层析后的蛋白质样品纯度较高,是单一条带。通过标准蛋白对照,可以得到该蛋白条带的分子质量为82.47kD。
2.7 丰年虫水溶性粗蛋白与峰2-1体外抗氧化活性比较
2.7.1 ·OH清除率比较
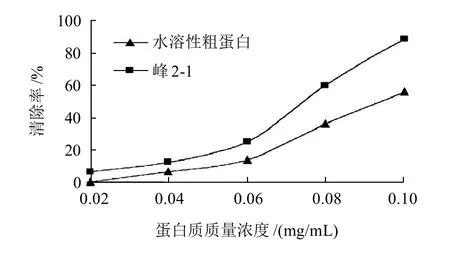
图4 ·OH清除率测定结果Fig.4 Scavenging activity of Peak 2-1 and crude protein against hydroxyl free radicals
由图4可知,丰年虫水溶性粗蛋白和峰2-1对·OH都有抑制作用,且随着蛋白质质量浓度的增加而增强。比较水溶性粗蛋白和峰2-1,发现在不同蛋白质质量浓度下,峰2-1的·OH清除率都要高于水溶性粗蛋白。抗氧化机理可能是蛋白质提供的氢和·OH结合,形成稳定的自由基并阻止了自由基链式反应。另外一种可能就是蛋白质能够和自由基链式反应中必需的离子结合,从而阻止反应进行[15]。
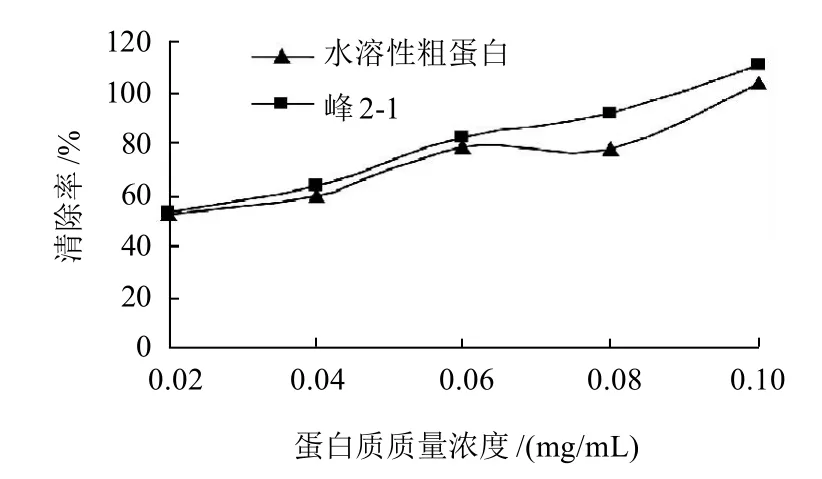
图5 ·清除率测定结果Fig. 5 Scavenging activity of Peak 2-1 and crude protein against superoxide anion free radicals
2.7.3 DPPH自由基清除率比较

图6 DPPH自由基清除率测定结果Fig.6 Scavenging activity of Peak 2-1 and crude protein against DPPH free radicals
由图6可知,丰年虫水溶性粗蛋白和峰2-1对DPPH自由基清除率随蛋白质质量浓度的增大而增强。比较它们的DPPH自由基清除率,发现峰2-1要远远大于水溶性粗蛋白。
3 结 论
研究结果表明,丰年虫水溶性粗蛋白经DEAESepharose FF离子交换层析分离纯化得到4个洗脱峰(峰1~4),体外抗氧化实验表明,峰2的体外抗氧化活性最好。峰2经Sephadex G-100凝胶层析分离纯化得到3个洗脱峰(峰2-1、峰2-2、峰2-3),体外抗氧化实验表明,峰2-1的体外抗氧化活性最好。用SDS-PAGE电泳鉴定峰2-1,发现是单一蛋白组分,分子质量为82.47kD。对丰年虫水溶性粗蛋白和峰2-1进行体外抗氧化实验,比较它们的抗氧化活性,发现·OH、O2-·和DPPH自由基清除率,峰2-1都远远强于水溶性粗蛋白。
[1] 聂路, 张建新, 彭鑫华, 等. 丰年虫蛋白质分类提取及抗氧化性研究[J]. 食品科学, 2011, 32(24): 26-30.
[2] 冯明珠, 何聪芬, 赵华, 等. 燕麦麸蛋白质Osboren分类级SDS-PAGE电泳分析[J]. 食品工业科技, 2007(1): 77-79.
[3] 中华人民共和国卫生部. GB5009.5—2010食品中蛋白质的测定[S].北京: 中国标准出版社, 2010.
[4] 李爽, 王静, 张颖. 蜂王幼虫蛋白质提取工艺研究[J]. 食品工业科技,2006(1): 128-129.
[5] 郭晓娜, 姚惠源. 苦荞麦抗肿瘤蛋白的分离纯化及结构分析[J]. 食品科学, 2007, 28(7): 462-465.
[6] 冯敏杰, 周惠明, 钱海峰. 鹅血中转铁蛋白质的分离纯化及其性质[J]. 无锡轻工大学学报, 2004, 23(1): 94-98.
[7] 苏薇, 杨洁, 沈晓丽, 等. 驴乳中蛋白质组分的分离纯化与鉴定[J].食品科学, 2010, 31(23): 44-48.
[8] 周毅峰, 唐巧玉, 周大寨, 等. 富锌水溶性莼菜蛋白ZnP6B- G75- WPⅡ的分离纯化与组成分析[J]. 食品科学, 2009, 30(17): 88-90.
[9] 魏文志, 夏文水, 吴玉娟. 小球藻蛋白质的分离、纯化及抗氧化特性[J]. 上海水产大学学报, 2007, 16(2): 135-139.
[10] 左光明, 谭斌, 秦礼康. 苦荞麸皮蛋白的提取分离及清除自由基作用研究[J]. 食品科学, 2008, 29(11): 269-273.
[11] 李顺峰, 张丽华, 付娟妮, 等. 真姬菇子实体多糖体外抗氧化特性研究[J]. 西北农业学报, 2008, 17(4): 302-305.
[12] BOONMEE A, SRISOMSAP C, KARNCHANATAT A, et al. An antioxidant protein inCurcuma comosaRoxb. Rhizomes[J]. Food Chemistry,2011, 124: 476- 480.
[13] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWTM - Food Science and Technology, 1995, 28: 25-30.
[14] 马莉, 唐健元, 李祖伦, 等. 板蓝根多糖分离纯化及其性质的研究[J].中草药, 2007, 38(8): 1143-1146.
[15] CHEN Ruizhan, LIU Zhiqiang, ZHAO Jimin, et al. Antioxidant and immunobiologial activity of water-soluble polysaccharide fraction purified fromAcanthopanax senticosu[J]. Food Chemistry, 2011, 127: 434-440.
Antioxidant Activity of Water-Soluble Protein Purified fromEubranchipus vernalis
NIE Lu,ZHANG Jian-xin*,LI Wen-xue,LIU Fei
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Objective: To isolate and purify water-soluble protein with the highest antioxidant activity fromEubranchipus vernalisand determine its molecular weight. Methods: Crude water-soluble protein fromEubranchipus vernaliswas extracted and purified by ammonium sulfate precipitation, salting out, ion-exchange column chromatography, DEAE-fast-flow Sepharose anion-exchange chromatography and Sephadex G-100 column chromatography. The antioxidant activities of different protein fractions were compared and their molecular weights were determined by SDS-PAGE. Results: The prepared crude watersoluble protein was mainly composed of 4 fractions named as Peak-1, Peak-2, Peak-3 and Peak-4 in DEAE-Sepharose fast-flow column chromatography and Peak-2 revealed higher antioxidant activity than other 3 fractions. In addition, Peak-2 was mainly composed of 3 sub-fractions including Peak 2-1, Peak 2-2 and Peak 2-3 in Sephadex G-100 gel-permeation column chromatography.Peak 2-1 exhibited higher antioxidant activity than other 2 sub-fractions. Peak 2-1 was identified by SDS-PAGE to reveal a molecular weight of 82.47 kD. The antioxidant activity of Peak 2-1 was much higher than that of the crude protein extract.Conclusion: Peak 2-1 has obtained fromEubranchipus vernalisas the most antioxidant protein with a molecular weight of 82.47 kD.
Eubranchipus vernalis;water-soluble protein;purification;antioxidant activity
TS254.4
A
1002-6630(2012)15-0122-05
2011-07-08
国家大学生创新性实验计划项目(2009A18)
聂路(1986—),男,硕士研究生,主要从事食品营养与安全研究。E-mail:liuxingynly@163.com
*通信作者:张建新(1959—),男,教授,硕士,主要从事食品营养与安全研究。E-mail:zhangjx59@foxmail.com
