菊粉酸降解动力学研究
2012-10-27罗登林陈瑞红刘建学
许 威,罗登林*,陈瑞红,刘建学
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
菊粉酸降解动力学研究
许 威,罗登林*,陈瑞红,刘建学
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
通过考察温度、溶液pH值及水分含量对菊粉酸降解的影响,探索菊粉酸水解规律。结果表明:菊粉水溶液在pH 5.0~7.0、温度低于100℃时具有良好的稳定性;但当pH值低于4.0时,菊粉出现明显的水解反应。菊粉溶液在不同温度和pH值下的酸降解动力学表明,其水解反应遵循一级反应动力学方程。利用菊粉凝胶特性考察水分含量与菊粉酸降解的关系,发现相同pH值(pH=3)条件下,水分含量越高,菊粉降解速率越快,凝胶中菊粉降解速率低于菊粉水溶液降解速率。
菊粉;酸降解;动力学
菊粉,又称菊糖,平均聚合度2~60,是一种植物性贮藏性多糖,由D-果糖通过β(1→2)糖苷键连结而成的线性直链混合多糖,末端有一个葡萄糖残基[1-3]。在我国菊芋(俗称洋姜)和欧洲菊苣中含量丰富。
菊粉主要构成单位是果糖,因此,利用菊粉取代传统淀粉来生产高纯度果糖具有生产工艺简单、成本低、果糖纯度高等明显优势。目前菊粉降解生产高果糖浆的方法主要有酸水解法和酶水解法。酸水解法主要使用硫酸、盐酸或有机酸降解菊粉,水解条件也不尽相同,一般条件为:pH1~4、温度60~100℃、水解时间由5min到几小时[4-5]。近年来,在原有的基础上又衍生出新的降解菊粉的方法,如以强酸性阳离子交换树脂作为固体酸催化水解菊粉[6],利用高压CO2-水混合体系来创造的酸性环境来水解菊粉,然后减压排除CO2即可[7]。酸水解法成本低,时间短,反应稳定和易控,但反应完后需中和和脱盐,存在一定的环境污染。菊粉酶水解采用的酶包括内切型和外切型两种,酶水解法工艺相对简单,但存在水解时间长、酶不耐高温和价格高等瓶颈性问题[8-9]。
目前,国内外对产菊粉酶菌株的选育和酶降解方面的文献报道很多,而对酸降解菊粉缺乏研究。酸降解作为一种常用的方法,具有高效、成本低廉、易于工业化生产等明显优势。本实验以盐酸为催化剂,研究不同酸度、温度及水分对菊粉降解的影响规律,为实际菊粉酸降解制备高果糖浆的工业化生产提供理论指导。
1 材料与方法
1.1 材料、试剂与仪器
菊粉(平均聚合度10,80℃条件下干燥直到恒质量)昆山拓丰有限公司。
酒石酸钾钠、3,5-二硝基水杨酸、硫酸、苯酚均为分析纯。
722分光光度计、PHS-25C数显酸度计 上海精密科学仪器有限公司;HH-S恒温水浴锅 江苏金坛市亿通有限公司。
1.2 方法
1.2.1 菊粉含量的测定
还原糖含量的测定:采用3,5-二硝基水杨酸法(DNS)[10]。移取0.2mL菊粉液于25mL刻度试管,加2mL DNS溶液,100℃水浴5min,冷却到室温,定容后于540nm波长测定吸光度,计算还原糖含量。
总糖含量的测定:采用硫酸-苯酚法[11]。取1mL菊粉液,分别加入1mL 5%的苯酚溶液和5mL的浓硫酸,100℃水浴15min,冷却到室温于490nm波长处测定吸光度,计算总糖含量。
菊粉含量测定:总糖含量减去还原糖含量即为菊粉含量[12]。
1.2.2 菊粉的热稳定性
配制0.3g/100mL的菊粉溶液,移取20mL于25mL具塞试管中。将试管置于水浴20、40、60、80、100℃中1h后,取出冷却到室温。测定菊粉液中还原糖的含量,每个水平做3个平行。
1.2.3 菊粉的酸降解性
移取20mL 0.3g/100mL菊粉液到25mL具塞试管中,用HCl溶液分别调节菊粉液pH值至1.0~7.0,然后把菊粉液置于20~100℃水浴中各1h,取出冷却至室温,用NaOH溶液调节pH值至7.0后,定容后测定还原糖含量。
1.2.4 菊粉的酸水解动力学
分别配制1g/100mL菊粉液,移取20mL于25mL具塞试管中,用酸度计将pH值准确调至2.0、3.0、4.0,分别置于50、60、70、80、90℃水浴中,每隔一定时间测定菊粉含量,分析不同酸度及温度条件下菊粉含量随时间的变化。
1.2.5 菊粉凝胶中的酸降解
以pH值为3.0的水溶液分别配制含菊粉量为40g/100mL、50g/100mL、60g/100mL菊粉凝胶,并将凝胶在室温条件下陈化30min,同时与pH 3.0 的0.5g/100mL菊粉水溶液置于50℃条件下进行酸水解,分别在不同时间取出凝胶于50℃条件下干燥,凝胶厚度不超过2mm,至恒质量后研磨配制0.5g/100mL溶液,测定其还原糖含量,并与0.5g/100mL菊粉水溶液中含量比较。
2 结果与分析
2.1 菊粉的热稳定性
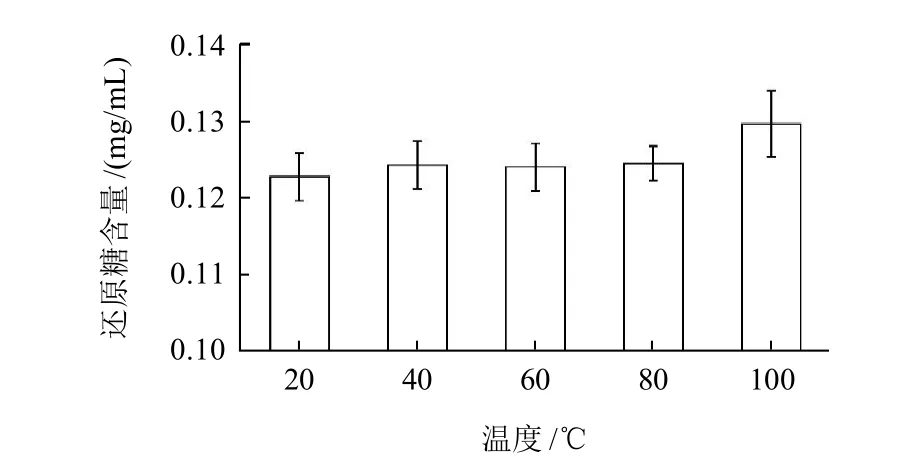
图1 不同温度条件下0.3g/100mL菊粉液中还原糖含量变化Fig.1 Change in reducing sugar concentration in 0.3g/100mL inulin solution with increasing thermal treatment temperature
由图1可知,温度对还原糖含量的变化影响不显著(P=0.2047)。温度低于80℃时,还原糖含量几乎没有变化,当上升至100℃时,还原糖含量略有上升,与20℃相比增加了5.7%。这说明菊粉具有较好的热稳定性,不会因为加工过程中高温导致其加工特性的改变。Bohm等[13]研究表明菊粉在100~195℃热处理1h后,菊粉出现明显的降解反应,如195℃条件热处理1h后,菊粉残余量仅为30%左右。
2.2 酸度对菊粉降解的影响

图2 不同pH值条件下0.3g/100mL菊粉的降解Fig.2 Degradation of 0.3 g/100 mL inulin at different pH values

图3 50℃时0.3g/100mL菊粉酸降解随时间的变化Fig.3 Degradation of 0.3 g/100 mL inulin at 50 ℃
由图2可知,酸度可诱导并加速菊粉的降解速率(P=0.01)。在pH5.0~7.0范围内,即使温度升高至100℃,菊粉基本不水解;在pH3.0~5.0范围内,只有温度高于50℃时,菊粉才发生水解,当温度超过80℃时,其水解速率明显加快;当pH值低于3.0时,即使是在室温条件下菊粉也发生水解反应,温度越高,水解速率越快(P=0.01),这与Dickerson等[14]研究结果一致。温度升高,反应速率加快归因于高温下分子运动加快,分子碰撞机会增加,反应活化能降低,反应更易发生,这与蔗糖和淀粉的水解反应相似[15-16]。由图3可知,在相同温度(50℃)条件下,pH2.0时水解反应速率与时间近似线性关系,在0.5h时达平衡;而pH 3.0时,需4h才达平衡;在pH4.0时,则反应超过27h仍未达平衡,且反应速率较低。
2.3 菊粉的酸降解动力学
不同温度及酸度条件下的动力学方程及速率常数计算结果如表1所示。1g/100mL菊粉溶液的酸水解表现为一级反应,菊粉溶液含量的对数值与时间具有良好的线性关系。在相同酸度条件下,温度越高,降解速率常数越大;当温度相同时,pH值越低,降解速率越大。菊粉水解过程中,由酸起着催化剂的作用,催化菊粉降解,生成果糖和不同聚合度的低聚果糖产物,在这过程中,水也参与了反应。表明pH值对速率常数影响显著(P=0.05)。
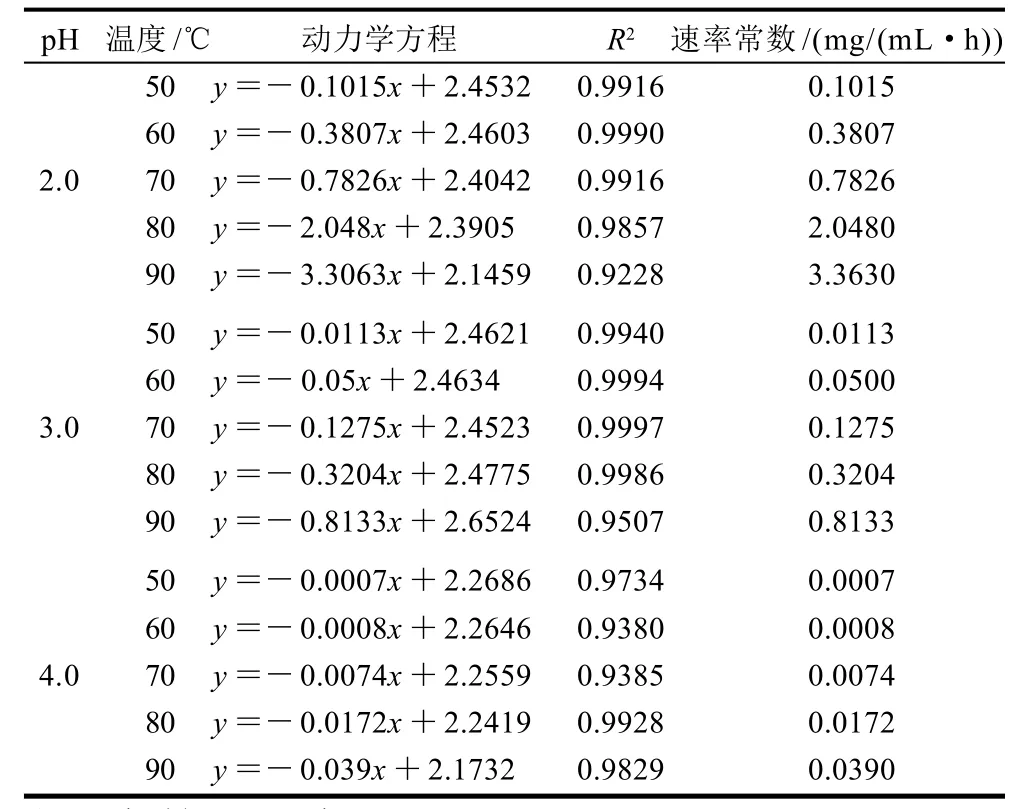
表1 1g/100mL菊粉溶液在不同温度及 pH值条件下降解动力学分析Table 1 Dynamics of 1 g/100 mL inulin degradation at different levels of temperature and pH
2.4 水分含量对菊粉酸降解的影响
由图4可知,菊粉凝胶中菊粉含量越高,水分含量就越低,菊粉水解速率也越小。水分存在的多少直接影响菊粉的水解速率和水解程度。水分含量越高,菊粉水解速率越快,水解程度也越高,但凝胶水解速度一直低于水溶液中菊粉水解速率。这可能是因为水是既是菊粉降解反应的参与者,也为其水解反应提供溶剂环境。与蔗糖等物质水解一样,只有在水溶液条件下,菊粉才能顺利降解成低聚果糖。

图4 水分含量对菊粉酸降解的影响Fig.4 Effect of water content on inulin hydrolysis
2.5 菊粉酸降解过程
综合各因素对菊粉酸降解的影响,再借鉴淀粉等酸降解及低聚糖的反应特点[17-18],可推断出菊粉酸降解反应遵循如下过程:
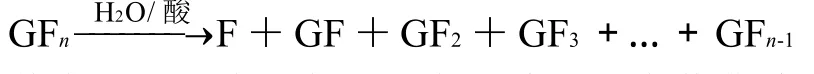
其中:GFn为菊粉;F为果糖;G为葡萄糖;GF为蔗糖;GF2为蔗果三糖;GF3为蔗果四糖。
以上反应能体现菊粉的酸降解规律,能很好地解释以上酸度、温度及水含量对菊粉降解的影响,符合一级反应动力学。
3 结 论
3.1 菊粉在pH 5.0~7.0的水溶液中非常稳定,即使温度达100℃,菊粉基本不水解;在pH 3.0~5.0范围内,只有温度高于50℃时,菊粉才发生水解;当pH<3.0时,即使是在室温条件下菊粉也能发生水解反应,温度越高,水解速率越快。

[1] RONKART S N, PAQUOT M, FOUGNIES C, et al. Effect of water uptake on amorphous inulin properties[J]. Food Hydrocolloids, 2009,23(3): 922-927.
[2] MEYER D, BAYARRI S, TARREGA A, et al. Inulin as texture modifier in dairy products[J]. Food Hydrocolloids, 2011, 25(8): 1181-1190.
[3] TARREGA A, ROCAFULL A, COSTELL E. Effect of blends of short and long-chain inulin on the rheological and sensory properties of prebiotic low-fat custards[J]. LWT-Food Science and Technology, 2010, 43(3): 556-562.
[4] CATANAA R, ELOYC M, ROCHAC J R, et al. Stability evaluation of an immobilized enzyme system for inulin hydrolysis[J]. Food Chemistry,2007, 101(1): 206-266.
[5] PEKIC B, SLAVICA B, LEPOJEVIC Z, et al. Effect of pH on the acid hydrolysis ofJerusalem artichokeinulin[J]. Food Chemistry, 1985, 17(3): 169-173.
[6] 赵国群, 张桂. 强酸型阳离子交换树脂作为固体酸催化水解菊粉[J].食品研究与开发, 2007, 28(9): 109-112.
[7] 罗登林, 袁海丽, 曾小宇, 等. 高压CO2-水混合体系水解菊粉制备果糖工艺[J]. 农业机械学报, 2009, 40(8): 130-133.
[8] COURTIN C M, SWEENNEN K, VERJANS P, et al. Heat and pH stability of prebiotic arabinoxyooligosaccharides, xylooligosaccharides and fructooligosaccharides[J]. Food Chemistry, 2009, 112(4): 461-480.
[9] CATANA R, ELOY M, ROHCA J R, et al. Stability evaluation of an immobilized enzyme system for inulin hydrolysis[J]. Food Chemistry,2007, 101(1): 260-266.
[10] ROCHA J R, CATANA R, FERREIRA B S, et al. Design and characterization of an enzyme system for inulin hydrolysis[J]. Food Chemistry,2006, 95(1): 77-82.
[11] 郑小亮, 蔡亚平, 冯宇飞, 等. 注射用五味子多糖的含量测定[J]. 中医药学报, 2010, 38(2): 99-101.
[12] 杨振, 杨富民, 王雪燕. 菊芋中菊粉提取工艺优化研究[J]. 甘肃农业大学学报, 2009, 44(1): 147-151.
[13] BOHM A, KAISER I, TREBSTEIN A, et al. Heat-induced degradation of inulin[J]. European Food Research and Technology, 2005, 220(5):466-471.
[14] DICKERSON A G, MOOR J. Purification of inulobiose obtained by acid hydrolysis of inulin[J]. Carbohydrate Research, 1975, 39(1): 162-163.
[15] 周华锋, 侯纯明, 张丽清, 等. 蔗糖水解反应动力学研究[J]. 辽宁化工, 2005, 34(5): 200-202.
[16] 蔡晶. 高温酸法水解制备低分子量淀粉[J]. 亚太传统医药, 2010, 6(10): 42-44.
[17] GIBSON G R, RASTALL R A. 益生元开发与应用[M]. 北京: 化学工业出版社, 2008: 27-46.
[18] 郑碧微, 阴艳华, 李海玲, 等. 稻草纤维低聚糖的超声波辅助水解及分级凝析分析[J]. 生物质化学工程, 2011, 45(1): 33-36.
Kinetic Studies on Acid Catalyzed Hydrolysis of Inulin
XU Wei,LUO Deng-lin*,CHEN Rui-hong,LIU Jian-xue
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
The effects of temperature, pH and water content on inulin hydrolysis were studied to understand the acid catalyzed hydrolysis process of inulin for industrial production of high-fructose syrup. The results showed that inulin solution had a good thermal stability at a pH value in the range of 5.0-7.0 and a temperature below 100 ℃, while inulin degradation started to occur when the pH was lower than 4.0. The acid catalyzed hydrolysis dynamics of inulin at different levels of temperature and pH showed that the reaction followed the first-order kinetics well. The relation between inulin gel degradation induced by acid and water content was also investigated. At the same pH, the higher water content, the faster inulin hydrolysis, and the degradation rate of inulin was lower in gel than in aqueous solution.
inulin;acid hydrolysis;dynamics
TS245.4
A
1002-6630(2012)15-0095-04
2011-07-16
河南省教育厅自然科学研究计划项目(2008B550002)
许威(1985—),男,硕士研究生,研究方向为农产品加工。E-mail:toxuwei1986@163.com
*通信作者:罗登林(1976—),男,副教授,博士,研究方向为超声技术与农产品深加工。E-mail:luodenglin@sohu.com
