葛仙米藻胆蛋白的体外消化特性
2012-10-27汪兴平潘思轶
程 超,李 伟,汪兴平,*,潘思轶
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
葛仙米藻胆蛋白的体外消化特性
程 超1,2,李 伟1,汪兴平1,*,潘思轶2
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
研究葛仙米藻胆蛋白在体外模拟胃液和肠液的消化产物性质,重点测定不同消化时间产物的可溶性蛋白质、游离氨基含量变化及其抗氧化作用,并利用HPLC法测定消化产物分子质量变化情况。结果表明:在胃液和肠液消化作用下蛋白质含量均呈现下降趋势,而游离氨基含量呈现上升趋势,消化产物较初始产物对ABTS+·和脂质过氧化具有更强的抑制作用,但对·OH的清除能力却有所下降;偏相关分析结果表明,与葛仙米藻胆蛋白消化产物的抗氧化作用紧密相关的是消化产物中的分子质量为6ku和0.2ku的肽类。
葛仙米;藻胆蛋白;模拟胃肠液;抗氧化;高效液相色谱
藻胆蛋白酶解可提高其生理功能,如在最适胃蛋白酶和胰蛋白酶酶解条件下,螺旋藻藻胆蛋白酶解产物对ACE的抑制率分别为82.16%和93.54%[1];用碱性蛋白酶和木瓜蛋白酶处理也可得到高活性的ACE抑制肽,且体内活性强于体外[2]。螺旋藻粉粗提液经两种不同酶解方法酶解,都能有效提高螺旋藻干藻粉抗氧化、降血压活性[3]。藻蓝蛋白经胰蛋白酶酶解时,随酶解时间延长酶解液清除自由基能力逐渐增强[4]。利用碱性蛋白酶酶解螺旋藻蛋白,发现307~1450D范围的螺旋藻小分子肽为水解物中抗氧化能力最强的成分[5]。胰蛋白酶酶解藻蓝蛋白得到的肽抗氧化活性是藻蓝蛋白的5倍,且能有效保护质粒DNA免受2,2-偶氮二(甲基丙基咪)二盐酸盐(AAPH)攻击[6]。藻蓝蛋白和其胰蛋白酶酶解产物对人宫颈癌HeLa细胞株的体外生长抑制作用有明显的剂量效应,酶解时间为l、2h的酶解产物的抗肿瘤活性明显高于藻蓝蛋白[7]。藻蓝蛋白酶解物的抗肿瘤活性明显高于相同浓度下的藻蓝蛋白,不同酶解条件下的酶解产物对不同肿瘤细胞的抑制作用不同,且差异显著,这说明酶解产物分子质量及其结构对其抗癌功能的发挥具有重要作用[8]。王雪青等[9]选择不同的酶解条件制备得到了不同抗癌活性的活性肽。
以上资料表明藻胆蛋白酶解后抗氧化、抗癌活性会增强,同时也会派生出其他的生理功能,但以上研究主要集中在螺旋藻这类藻胆蛋白,对葛仙米藻胆蛋白消化未见报道;同时以上研究主要采用蛋白酶对其进行酶解,而日常生活对此类原料的摄取主要是通过口腔摄入,藻胆蛋白经体内的肠胃消化后的产物作用如何值得探讨。因此本实验建立体外胃、肠液模拟体系,研究葛仙米藻胆蛋白消化产物的成分含量和抗氧化特性,以期初步明确藻胆蛋白在体内发挥作用的成分。
1 材料与方法
1.1 材料与试剂
葛仙米藻胆蛋白:准确称取30g脱脂干葛仙米粉用适量蒸馏水复溶,于-20℃反复冻融3次,用pH7.3磷酸氢二钾-氢氧化钠缓冲液在4℃条件下浸提,10000r/min离心15min,20%硫酸铵沉淀去除杂蛋白,继续用60%硫酸铵沉淀,沉淀透析后冷冻干燥得产品。
胃蛋白酶(3000U/mg)、胰蛋白酶(250U/mg)、D-脱氧核糖 美国Amresco公司;抗坏血酸 科瑞生化试剂公司;考马斯亮蓝试剂盒 南京建成生物工程研究所;赖氨酸 上海政翔化学试剂研究所;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS) 上海化学工业发展有限公司;邻苯二甲醛(OPA)、三氯乙酸、硫酸亚铁、双氧水、三氯化铁、乙二胺四乙酸二钠、三羟基氨基甲烷、硫酸铵、盐酸(均为分析纯) 国药集团化学试剂有限公司;硫代巴比妥酸 天津市凯通化学试剂有限公司。
1.2 仪器与设备
Avanti J-301高速冷冻离心机 美国Beckman-Coulter公司;ALPHA1-4真空冷冻干燥机 德国Chris公司;UV1900PC紫外双光束-可见分光光度计 上海亚研电子科技有限公司;高效液相色谱仪(Waters 2998 Photodiode Array Detector;Waters e2995 Separations medule) 美国Waters公司。
1.3 方法
1.3.1 体外胃液和肠液的模拟[10]
2×人工胃液:1000mL溶液中含有NaCl 4.0g、胃蛋白酶6.4g、14mL浓盐酸。pH 值约为1.2,胃蛋白酶的活力为3000~3500U/mg。
2×人工肠液:将13.6g KH2PO4溶于250mL 双蒸水,振荡,完全溶解后加190mL 0.2mol/L NaOH 和400mL的双蒸水。加胰蛋白酶20.0g, 混匀,用0.2mol/L NaOH调pH值到7.5±0.1,双蒸水定容于1000mL。胰蛋白酶的活力为4U/mg。
1.3.2 蛋白质在人工胃液中的消化程度
取11个50mL三角瓶,每瓶加10mL 2×人工胃液,37℃保温10min。然后在各瓶中分别加入10mL 20mg/mL葛仙米藻胆蛋白溶液,37℃消化,按时间梯度0、1、5、10、15、30、60、90、120、150、180min准确计时,用0.168mol/L Na2CO3调整pH值为7~8终止反应。冷冻干燥得不同模拟胃液消化的样品。
1.3.3 蛋白质在人工肠液中消化程度
取11个50mL三角瓶,每管加入10mL的2×人工肠液,37℃保温10min。在各瓶中分别加入10mL 葛仙米藻胆蛋白溶液( 37℃预热),37℃消化,按0、1、5、10、15、30、60、90、120、150、180min准确计时,90℃加热5min终止反应,冷冻干燥得不同模拟肠液消化的样品。
1.3.4 可溶性蛋白质含量测定
采用Bradford法[11]。
1.3.5 游离氨基含量测定
采用邻苯二甲醛法[12]。以赖氨酸为标准品,以赖氨酸含量(0~160μg)为横坐标(x),以A340nm为纵坐标(y)绘制标准曲线,拟合得其回归方程为y=0.0090.0039,r=0.9994。
样品中游离氨基含量测定:准确称取不同胃液和肠液消化时间的冷冻干燥样品70mg,分别溶于3mL蒸馏水中,将此样品溶液稀释4倍后,取100μL 稀释样液,加100μL蒸馏水,4mL OPA试剂,混匀后35℃反应2min,以OPA试剂加200μL蒸馏水为空白,于340nm波长处测定吸光度。
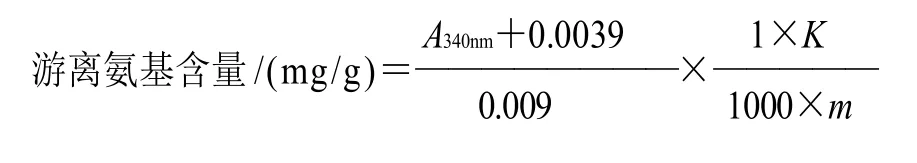
式中:m为消化产物的质量/g;K为消化产物溶液的稀释倍数。
1.3.6 消化产物的抗氧化作用
参照参考文献[13]的方法测定消化产物对ABTS+·的清除作用、消化产物对H2O2诱导的脂质过氧化的抑制作用,利用D-脱氧核糖体系测定消化产物对·OH的清除作用[14]。
1.3.7 胃液和肠液消化产物的HPLC分析
采用β-葡萄糖苷酶(129.0ku,保留时间9.897min)、牛血清白蛋白(65.91ku,保留时间10.64min)、胰蛋白酶(23.12ku,保留时间12.14min)、VB12(1.339ku,保留时间14.18min)为标准品,以标样分子质量为横坐标,保留时间为纵坐标绘制标准曲线,得回归方程y=- 0.9264lnx+14.60,r=0.9871。
HPLC柱型号:SEC-300(4.8mm×300mm)Sepax Technologies;洗脱液:0.1mol/L pH7.0 磷酸盐缓冲液;上样量:20μL,柱温:25℃;流速:0.3mL/min;检测波长:280nm[15]。
2 结果与分析
2.1 葛仙米藻胆蛋白不同消化时间蛋白质和游离氨基含量变化
表1 胃、肠液不同消化时间蛋白质和游离氨基含量的变化Table 1 Changes in protein and free amino acid contents during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids

表1 胃、肠液不同消化时间蛋白质和游离氨基含量的变化Table 1 Changes in protein and free amino acid contents during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids
注:同列肩标字母不同表示差异显著(P<0.05)。
由表1可知,在胃液和肠液中随消化时间延长可溶性蛋白含量下降,对其进行显著分析发现,胃液0、1min消化产物可溶性蛋白含量无差异,但5min开始显著下降,这说明在模拟胃液消化中蛋白质在5min时开始大量被消化,且在胃液处理90min内蛋白质消化幅度变化不大,120min时又开始明显消化。肠液消化产物在1min与0min可溶性蛋白质含量显著下降,这说明肠液初始处理就对蛋白质具有消化作用,同胃液一样在肠液处理的90min内蛋白质具有小幅下降。游离氨基的含量变化与可溶性蛋白含量相反,呈现增加趋势。
2.2 葛仙米藻胆蛋白消化产物的抗氧化特性
2.2.1 消化产物对ABTS+·的清除作用
取不同消化时间的样品70mg,加蒸馏水3mL溶解,测定消化产物对ABTS+·的清除率,结果见图1。葛仙米藻胆蛋白的胃液和肠液消化产物对ABTS+·的清除能力随着消化时间的延长而增强,但是120min肠液消化产物的ABTS+·清除能力有所下降,而150min胃液消化产物对ABTS+·的清除作用略有下降。总体上胃液消化产物对ABTS+·的清除作用强于肠液消化产物。
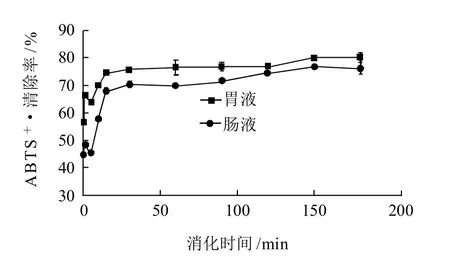
图1 消化产物对ABTS+·的清除作用Fig.1 Changes in ABTS+· radical scavenging effect during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids
2.2.2 消化产物对·OH的清除作用

图2 消化产物对·OH的抑制作用Fig.2 Changes in hydroxyl radical scavenging effect during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids
由图2可知,胃液消化产物对·OH清除作用均强于肠液的消化产物,但肠液和胃液初期消化产物对·OH清除作用均有所下降,二者在消化处理10min后对·OH抗氧化作用回升,之后一直保持上升趋势,但消化处理180min均未超过初始消化产物对·OH的清除作用。
2.2.3 消化产物对H2O2诱导的脂质过氧化的抑制作用

图3 消化产物对H2O2诱导的脂质过氧化的抑制作用Fig.3 Changes in inhibitory effect on H2O2-induced lipid peroxidation during digestion of Nostoc sphaeroides k.tingphycobiliprotein in simulated gastric or intestinal fluids
由图3可知,肠液消化产物对脂质过氧化抑制作用强于胃液,且肠液消化产物对脂质过氧化的抑制作用随时间延长而增强,至消化处理90min达最高值,之后略有小幅下降;胃液消化产物随消化时间延长对脂质过氧化抑制作用显著增加,到消化处理60min时达最高值,随后略有小幅下降,但均显著高于初始样品对脂质过氧化的抑制作用。
由表2可知,模拟胃、肠液中,所测定消化产物抗氧化指标与不同消化时间的蛋白质含量均呈负相关,即可溶性蛋白质含量越低抗氧化效果越好;但与游离氨基含量呈正相关,模拟胃液中对·OH抑制率与游离氨基含量的相关性达到了极显著水平(P<0.01)。模拟肠液中各个抗氧化指标与游离氨基含量达到了显著或极显著水平(P<0.05,P<0.01)。

表2 模拟胃肠液消化产物中蛋白质和游离氨基含量与其抗氧化特性的相关性Table 2 Partial correlation analysis between antioxidant properties and protein or free amino content for digestion products in simulated gastric fluid
2.3 葛仙米藻胆蛋白的消化产物HPLC分析
表3 模拟胃、肠液不同消化时间产物保留时间及分子质量Table 3 Retention time and molecular weight of digestion products harvested during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids

表3 模拟胃、肠液不同消化时间产物保留时间及分子质量Table 3 Retention time and molecular weight of digestion products harvested during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids
胃液消化 保留时 相对峰 分子质时间/min间/min面积/% 量/ku 1 6.970 9.984 3791 12.91 90.02 6.225 7.137 9.324 3166 5 12.90 90.68 6.293 6.901 7.302 4084 10 12.99 91.35 5.710 16.42 0.2353 0.1408 21.44 1.112 7.135 13.96 3172 12.99 74.99 5.710 15 14.38 2.213 1.274 16.44 2.501 0.1378 17.72 1.586 22.55 0.2441 6.9178 6.418 4011 7.519 2.889 2096 30 12.83 63.01 6.787 14.47 16.10 1.156 16.47 6.215 0.1334 17.73 1.348 6.956 7.746 3849 7.300 4.535 2655 60 12.87 80.51 6.500 16.52 1.726 0.1264 21.52 0.4308 6.889 13.85 4137 90 12.92 72.20 6.158 16.29 5.801 0.1620 21.32 0.9446 6.858 13.77 4278 120 12.93 73.91 6.092 16.27 4.090 0.1656 21.27 1.933 6.773 3.433 4689 150 12.99 83.97 5.710 16.49 7.113 0.1306 21.61 0.7405 6.818 11.29 4467 13.01 72.90 5.588 180 15.87 1.764 0.2550 16.24 4.531 0.1710 21.25 2.214肠液消化 保留时 相对峰 分子质时间/min间/min面积/% 量/ku 6.367 2.107 7269 6.704 5.331 5052 1 9.624 0.1920 216.1 13.23 71.49 4.407 14.34 16.27 1.330 16.41 4.616 0.1423 6.324 2.409 7614 6.766 5.247 4725 5 9.597 0.1563 222 13.18 72.20 4.651 14.28 15.38 1.419 16.36 4.611 0.1502 6.428 5.931 6806 6.871 1023 4219 10 9.685 0.3380 202.3 13.09 79.97 5.126 16.51 3.527 0.1278 6.346 4.150 7435 6.685 8.420 5157 15 9.654 0.2534 209.2 13.03 84.40 5.469 16.46 2.773 0.1349 6.348 2.513 7419 6.720 5.143 4966 30 9.676 0.08592 204.3 13.07 88.54 5.238 16.42 3.719 0.1408 6.360 2.221 7324 60 6.776 6.706 4674 12.94 87.75 6.027 16.36 3.326 0.1502 6.844 9.376 4343 90 12.98 88.68 5.772 16.45 1.944 0.1363 6.395 2.008 7052 120 6.721 7.621 4960 12.99 88.43 5.710 16.48 1.941 0.1320 6.395 2.331 7052 6.790 5.845 4604 150 12.45 34.58 10.23 12.91 50.99 6.225 15.74 3.124 0.2934 6.815 13.37 4481 180 12.86 84.85 6.570 16.38 1.774 0.1470
由表3可知,肠液消化产物的分子质量主要集中在4.407~6.570ku,这部分消化产物大约占75%~90%;胃液消化产物的分子质量主要集中在5.588~6.787ku,这部分消化产物大约占72%~92%。此外在胃液和肠液消化产物中还存在分子质量为100~200u的肽类,大约占总体消化产物的0.5%~7%。
2.4 胃液和肠液消化产物与其抗氧化作用的相关性
表4 胃液、肠液消化产物HPLC不同保留时间与抗氧化指标的相关性Table 4 Correlation analysis between antioxidant properties and retention time for digestion products harvested during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids

表4 胃液、肠液消化产物HPLC不同保留时间与抗氧化指标的相关性Table 4 Correlation analysis between antioxidant properties and retention time for digestion products harvested during digestion of Nostoc sphaeroides k.ting phycobiliprotein in simulated gastric or intestinal fluids
保留时间/min 皮尔逊相关系数脂质过氧化抑制 ·O H ABTS+·7 0.034 -0.167 -0.072胃液 12.9 0.530 0.753* 0.567 16 0.583 0.772** 0.261 22 -0.591 -0.545 -0.651*6.6 -0.228 0.013 -0.250肠液 9 -0.228 -0.228 -0.056 16 -0.939** -0.686* -0.807**13 0.835** 0.671* 0.924**
由于在胃液和肠液消化产物中具有不同分子质量的肽类,将胃液和肠液消化产物不同保留时间的相对峰面积与上述抗氧化指标进行偏相关分析,以确定这些肽对抗氧化的贡献率。由表4可知,胃液消化产物中保留时间为12.9min的消化产物(分子质量6ku左右)对·OH清除作用具有显著相关,对ABTS+·的清除作用也具有相关性;保留时间为16min的消化产物(分子质量0.2ku左右)对·OH清除作用的相关性达到了极显著水平,对脂质过氧化抑制也具有相关性;保留时间为7、22min的消化产物对抗氧化指标几乎全部具有负相关(7min消化产物对脂质过氧化抑制为正相关),这说明胃液消化产物的分子质量对其抗氧化作用具有重要影响,过大与多小均会使其抗氧化作用下降。肠液消化产物中保留时间为13min(分子质量6ku左右)的消化产物与其抗氧化指标达到了显著正相关,保留时间为6.6、9、16min的消化产物对抗氧化指标具有负相关。
3 讨 论
目前人们越来越有兴趣开发利用食物来源的生物活性肽作为保健食品,肽键断裂会导致游离氨基和羧基基团含量增加,从而增加其溶解性,水解破坏蛋白三级结构,降低蛋白质分子质量,进而改变蛋白质功能性质,但过度水解会对其功能性质产生负面作用。目前已报道[16]来源于不同蛋白质的水解产物具有抗氧化活性,但蛋白质酶解产物的分子质量对其抗氧化活性影响非常大,且与原料蛋白质有关。
在葛仙米藻胆蛋白胃液和肠液消化产物中,其可溶性蛋白质含量下降,游离氨基含量上升,所测定的几种抗氧化指标与可溶性蛋白含量呈负相关,而与游离氨基含量呈正相关。模拟肠液消化产物中分子质量约为6ku的消化产物对其抗氧化左右贡献最大,模拟胃液中除了6ku的消化产物外,分子质量约为0.2ku的消化产物对其抗氧化也具有一定的作用;不同分子质量消化产物对其抗氧化作用的贡献尚需进行分离纯化制备不同产品加以验证。本实验是在单独的模拟胃液和肠液中进行的,而动物体实际消化情况是先胃液后肠液,胃肠液共同作用于葛仙米藻胆蛋白,这部分实验目前正在深入研究。
[1] 刘立闯, 胡志和, 贾静, 等. 螺旋藻藻胆蛋白水解产物对ACE 抑制活性的研究[J]. 食品科学, 2009, 30(13): 212-217.
[2] 鲁军. 螺旋藻活性肽的纯化、鉴定及降压、护肝机制研究[D]. 北京: 北京林业大学, 2010.
[3] 张莹. 钝顶螺旋藻藻蓝蛋白的酶解及酶解产物的生物活性研究[D].济南: 山东大学, 2006.
[4] 周站平, 陈秀兰, 陈超, 等. 藻胆蛋白脱辅基蛋白对其抗氧化活性的影响[J]. 海洋科学, 2003, 27(5): 77-81.
[5] 武萌萌. 螺旋藻抗氧化多肽的制备及活性研究[D]. 北京: 北京林业大学, 2010.
[6] 蒋洁. 含碲藻胆蛋白的纯化及藻蓝蛋白酶解多肽的抗氧化活性研究[D]. 广州: 暨南大学, 2011.
[7] 范敏. 钝顶螺旋藻藻蓝蛋白及其酶解产物的抗肿瘤活性研究[D]. 呼和浩特: 内蒙古农业大学, 2008.
[8] 杨滢滢. 藻蓝蛋白的分离纯化、酶解及其抗肿瘤活性研究[D]. 天津: 天津商业大学, 2009.
[9] 王雪青, 邓伟, 杨进芳, 等. 藻蓝蛋白酶解肽的分离纯化及其细胞毒活性[J]. 食品科学, 2012, 33(1): 136-140.
[10] 李英华, 董杰, 李剑虹, 等. 外源蛋白在模拟胃肠环境中稳定性测定模型初探[J]. 卫生研究, 2004, 33(4): 433-437.
[11] 陈霞, 莫新迎, 韩丹, 等. 不同蛋白质含量的同品种大麦中热稳定蛋白质及泡沫蛋白质的变化[J]. 大连工业大学学报, 2011, 30(2): 113-116.
[12] 冯岩, 冯志彪, 王楠. 乳清蛋白水解物游离氨基浓度测定方法比较[J]. 中国乳品工业, 2010, 38(5): 46-48.
[13] 程超, 薛峰, 汪兴平, 等. 反复冻融增强葛仙米藻胆蛋白抗氧化特性研究[J]. 食品科学, 2011, 32(23): 121-124.
[14] 杜国荣. 猕猴桃、柿和苹果果实的抗氧化能力及其抗氧化活性成分的分析[D]. 杨凌: 西北农林科技大学, 2009.
[15] SONI B, TRIVEDI U, MADAMWAR D. A novel method of single step hydrophobic interaction chromatography for the purification of phycocyanin fromPhormidium fragileand its characterization for antioxidant property[J]. Bioresource Technology, 2008, 99(1): 188-194.
[16] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311.
Digestion Characteristicsin vitroof Phycobiliprotein fromNostoc sphaeroidesKu..ting
CHENG Chao1,2,LI Wei1,WANG Xing-ping1,*,PAN Si-yi2
(1. Biological Scientific and Technical College, Hubei University for Nationalities, Enshi 445000, China;2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
In this study, some properties of products produced during digestion ofNostoc sphaeroidesk. ting phycobiliprotein in simulated gastric and intestinal fluids were investigated especially such as soluble protein and free amino acid contents and antioxidant properties. Meanwhile, the change in molecular weight during digestion ofNostoc sphaeroidesk.ting phycobiliprotein was determined by HPLC. The results showed that protein content revealed a downward trend during digestion in each stimulated fluids, and consequently free amino acid content exhibited an upward trend. Digestion products had stronger ABTS radical scavenging and anti-lipid peroxidation activities but weaker hydroxyl radical scavenging activity inD-deoxyribose system thanNostoc sphaeroideskting phycobiliprotein. The results of partial correlation analysis demonstrated that 6 ku and 0.2 ku peptides were closely related to the antioxidant effect of digestion products ofNostoc sphaeroidesk. ting phycobiliprotein.
Nostoc sphaeroidesKting;phycobiliprotein;simulated gastric and intestinal fluids;antioxidant activity;HPLC
TS201.1
A
1002-6630(2012)15-0006-05
2012-04-12
国家自然科学基金项目(31260365);湖北民族学院团队项目(MY2008T004;MYT2007004)
程超(1976—),女,副教授,博士研究生,研究方向为食品化学。E-mail:chengchaolw@126.com
*通信作者:汪兴平(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:hbmywxp@163.com
