基于β-葡萄糖苷酶活力的蜂蜜真伪鉴别
2012-10-27张金连张翠平郑火青易松强胡福良
张金连,张翠平,郑火青,易松强,胡福良
(浙江大学动物科学学院,浙江 杭州 310058)
基于β-葡萄糖苷酶活力的蜂蜜真伪鉴别
张金连,张翠平,郑火青,易松强,胡福良
(浙江大学动物科学学院,浙江 杭州 310058)
提出以β-葡萄糖苷酶活力为指标的蜂蜜真伪鉴别新方法,采用分光光度法分析不同来源蜂蜜中的β-葡萄糖苷酶活力,研究不同储存条件下蜂蜜中β-葡萄糖苷酶活力的变化规律,探讨掺入不同比例大米高果糖浆的蜂蜜中以β-葡萄糖苷酶活力的变化规律。结果表明:不同来源蜂蜜中均能检测出β-葡萄糖苷酶活力,而大米高果糖浆中检测不到该酶活力;不同浓度油菜蜜分别在-18、4、25(室温)、30℃条件下储存11个月,随着储存时间的延长,蜂蜜中β-葡萄糖苷酶活力变化较小;随着油菜蜜中大米高果糖浆的掺假比例增大,β-葡萄糖苷酶活力呈线性下降。因此,β-葡萄糖苷酶活力是检测蜂蜜是否掺假的一个有效定性指标。
蜂蜜;β-葡萄糖苷酶;真伪;鉴别
蜂蜜是一种天然产品,具有较高的药用价值和保健功效[1-2],一直深受消费者青睐。蜂蜜掺杂使假现象由来已久,严重影响了蜂蜜产业的健康发展、出口创汇以及消费者的权益。近年来,蜂蜜掺假发展为掺入葡萄糖、葡萄糖浆、果葡糖浆等[3-7]物质,这些掺假的蜂蜜感官指标和部分理化指标与天然蜂蜜极为相似。用稳定性碳同位素方法虽可以解决玉米高果糖浆等来源于C4植物糖浆的掺假问题[8],但是,由于水稻与蜜源植物均为C3植物,而来源于水稻的大米高果糖浆中同位素成分与天然蜂蜜极为相似,目前用此方法较难鉴别出天然蜂蜜中是否掺入大米高果糖浆。因此,亟需建立一套行之有效的方法鉴别蜂蜜和大米高果糖浆。
蜂蜜是动植物双源性产品,蜜蜂在酿制蜂蜜时加入了多种酶类[9-12]。Low等[13]首次在蜂蜜中检测到β-葡萄糖苷酶活力;Pontoh等[14]从意大利蜜蜂的咽下腺、胃和蜜囊中分离纯化出β-葡萄糖苷酶,而且这3个组织中的β-葡萄糖苷酶是相同的。因此,他们推断β-葡萄糖苷酶是由工蜂的咽下腺产生,分泌到嘴里,通过饲喂到达蜜囊,然后从蜜囊转移到巢脾;易松强等[15]研究发现,蜂蜜中均能检测到β-葡萄糖苷酶活力,而在花蜜中检测不到该酶活力,初步证实蜂蜜中的β-葡萄糖苷酶来源于蜜蜂。
本实验采用分光光度法检测不同来源和种类蜂蜜以及市售大米高果糖浆中的β-葡萄糖苷酶活力,比较不同储存时间和温度下,蜂蜜中β-葡萄糖苷酶活力的稳定性和掺入不同比例大米高果糖浆的蜂蜜中β-葡萄糖苷酶活力的变化规律,为蜂蜜的真伪鉴别提供理论依据。
1 材料与方法
1.1 材料与仪器
5种天然蜂蜜从蜂场直接获得;12种国内产‘杂花蜜’、‘枣花蜜’、‘椴树蜜’、‘龙眼蜜’、‘荔枝蜜’、‘柑橘蜜’、‘黄芪蜜’、‘党参蜜’、‘六道木蜜’、‘龙眼蜜’和4种国外产的‘赤桉树蜜’、‘黄桉树蜜’、‘薰衣草蜜’、‘松树蜜’蜂蜜;大米糖浆 市购。
对-硝基苯基-β-D-葡萄糖苷(p-NPG) 北京凯森医药科技有限公司;其他均为分析纯。
UV2550紫外-可见分光光度计 日本岛津公司。
1.2 方法
1.2.1β-葡萄糖苷酶活力的测定
[13],采用p-NPG法进行β-葡萄糖苷酶活力测定。称取1.00g蜂蜜样本,用柠檬酸-磷酸氢二钠缓冲液(pH5.0)定容至10mL容量瓶作为粗酶液。吸取1.0mL粗酶液和1.0mL 30mmol/L对硝基苯基β-D-葡萄糖苷(p-NPG)于试管中,混匀后置于37℃水浴中加热1.5h。在水浴中加热后的反应混合液中立即加入5.0mL 1mol/L Na2CO3溶液终止反应,冷却至室温后,在波长400nm处测定吸光度。另外,取1.0mL粗酶液和1.0mL 30mmol/Lp-NPG于试管中,立即置于沸水浴中加热5min灭活后,加入5.0mL 1mol/L Na2CO3溶液,作为空白对照。
每分钟催化形成1μmol对硝基苯酚所需要的酶量为一个酶活力单位(U)。蜂蜜中β-葡萄糖苷酶活力为每克蜂蜜具有的酶活力单位数。
1.2.2 样品处理
将新鲜的不同波美度(37、39、41°Be)的油菜蜜分装在若干个洁净的瓶子中,密封后分别置于-18、4、25(室温)、30℃冷柜或培养箱中储存,然后每月按照上述方法测定样品的β-葡萄糖苷酶活力。
将新鲜的不同波美度(37、39、41°Be)的油菜蜜中分别掺入10%、20%、30%、40%、50%的大米高果糖浆,然后按照上述方法测定样品的β-葡萄糖苷酶活力。
2 结果与分析
2.1 不同种类蜂蜜中β-葡萄糖苷酶活力
由表1可见,从蜂场取得的5种天然蜂蜜中均检测到β-葡萄糖苷酶活力,其酶活力范围为14.78~33.91mU/g。不同植物来源蜂蜜的β-葡萄糖苷酶活力变化较大,最高的红豆草蜜是最低的洋槐蜜酶活力的2倍多。

表1 天然蜂蜜中β-葡萄糖苷酶活力测定结果Table 1 β-glucosidase activity in natural honey samples

表2 国内市售蜂蜜中β-葡萄糖苷酶活力测定结果Table 2 β-glucosidase activity in commercial honey samples in China
由表2可见,不同种类的国内市售天然蜂蜜中均检测到β-葡萄糖苷酶活力。酶活力高低依植物来源不同差异大,范围为7.70~40.77mU/g。β-葡萄糖苷酶活力最高的枣花蜜酶活力为最低的2号杂花蜜的5倍多。
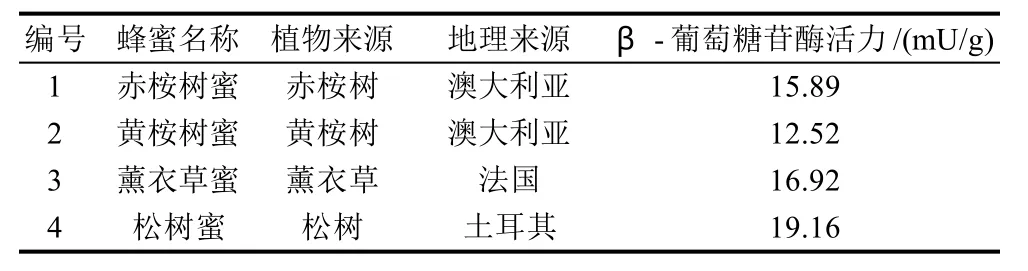
表3 国外市售蜂蜜中β-葡萄糖苷酶活力测定结果Table 3 β-glucosidase activity in commercial honey samples outside of China
由表3可知,不同植物来源、不同地理来源的国外市售天然蜂蜜均检测到β-葡萄糖苷酶活力,酶活力范围为12.52~19.16mU/g。不同来源的天然蜂蜜中亦均可检测到β-葡萄糖苷酶活力,但该酶活力依植物来源不同变化很大。
2.2 不同储存条件对蜂蜜中β-葡萄糖苷酶活力的影响
随储存温度、时间不同,37°Be油菜蜜中β-葡萄糖苷酶活力变化趋势不同。由图1A可知,在低温(-18℃)条件下,随着时间的延长,油菜蜂蜜中β-葡萄糖苷酶活力无显著变化。当储存温度为4℃时,随着时间的延长,油菜蜂蜜中β-葡萄糖苷酶活力呈线性下降,其线性曲线方程为y=-0.1161x+7.8844(R2=0.9206),损失率为13.75%。当储存在室温和30℃时,37°Be油菜蜂蜜的β-葡萄糖苷酶活力随着时间的延长先增大后减小,在5个月时达到极大值,储存至11个月时酶活力损失率分别为12.03%和9.67%。这表明,37°Be油菜蜂蜜在不同温度下储存11个月,其酶活力变化较小,说明蜂蜜中的β-葡萄糖苷酶较稳定。

图1 不同储存条件对37(A)、39°Be(B)和41°Be(C)油菜蜂蜜中β-葡萄糖苷酶活力的影响Fig.1 Effect of storage condition on β-glucosidase activity in rape honey with different Baume degrees
由图1B可知,39°Be油菜蜜在不同温度下储存不同时间,其β-葡萄糖苷酶活力的变化与37°Be的油菜蜜相似:在-18℃条件下,39°Be油菜蜜随储存时间延长,酶活力差异不显著;在4℃条件下储存11个月,其酶活力损失率为17.95%;在室温和30℃条件下储存,损失率分别为10.81%和11.14%。
由图1C可知,与37、39°Be油菜蜜不同,41°Be油菜蜜除在-18℃条件下储存不同时间,其酶活力变化不显著外,随着储存温度(4℃、室温、30℃)的升高、储存时间的延长,样品中β-葡萄糖苷酶活力逐渐下降,且趋势相同,储存至11个月时酶活力损失率分别为35.69%、39.40%和39.67%。
从图1可见,油菜蜜中β-葡萄糖苷酶活力随油菜蜜成熟度的升高,其酶活力增加;不同成熟度的油菜蜜在-18℃条件下储存不同时间β-葡萄糖苷酶活力均没有显著变化;在4℃储存时,均呈线性下降;而在室温或30℃储存时,低成熟度油菜蜜(37、39°Be)随时间延长,其β-葡萄糖苷酶活力均呈现先上升后下降的趋势,而41°Be的油菜蜜呈线性下降。
2.3 不同来源的大米高果糖浆中β-葡萄糖苷酶活力

表4 大米糖浆中的β-葡萄糖苷酶活力Table 4 β-glucosidase activity in high-fructose rice syrup
由表4可知,采用分光光度法检测大米高果糖浆的β-葡萄糖苷酶活力,其吸光度均小于0.02mU/g对应吸光度,而分光光度计的准确测量范围为 0.100~0.900,因此,可认为大米高果糖浆中未检测到β-葡萄糖苷酶活力。
2.4 掺入不同比例大米高果糖浆的蜂蜜中β-葡萄糖苷酶活力
随着蜂蜜中掺入大米高果糖浆比例增大,37、39、41°Be的油菜蜜中β-葡萄糖苷酶活力均逐渐下降(图2),其线性方程分别为:y=-14.737x+15.563(R2=0.9563);y=-28.868x+27.48(R2=0.9952);y=-21.557x+21.787(R2=0.9931)。结果表明,油菜蜜的真实性与所测得的酶活力呈正比:酶活力越高,含天然蜂蜜越多;酶活力越低,含天然蜂蜜越少。
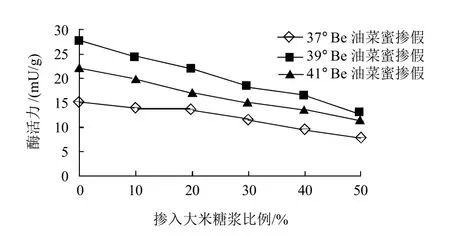
图2 不同波美度油菜蜜中掺入不同比例大米高果糖浆后的β-葡萄糖苷酶活力Fig.2 Effect of adulteration proportion of rice syrup onβ-glucosidase activity in rape honey with various Baume degrees
3 讨 论
本研究在未经过加工的天然蜂蜜和所有加工过市售天然蜂蜜中均检测到β-葡萄糖苷酶活力,而在大米高果糖浆中均未检测到该酶活力。β-葡萄糖苷酶广泛存在于自然界中,可来源于植物、微生物,也可来源于动物[16-18]。有研究表明,蜂蜜中β-葡萄糖苷酶来源于蜜蜂[15],而且Sanchez等[19]也在57种未经加工的新鲜蜂蜜中检测到β-葡萄糖苷酶活力。这说明,β-葡萄糖苷酶活力是鉴别天然蜂蜜和大米高果糖浆的有效指标。但是,不同来源的天然蜂蜜其酶活力变化较大,而且β-葡萄糖苷酶是蜂蜜中含有而大米高果糖浆中不含有的,因此,以β-葡萄糖苷酶活力为指标可定性区分天然蜂蜜与大米高果糖浆,而对天然蜂蜜中是否掺入大米高果糖浆则无能为力。因此,还需要扩大样本量,根据蜂蜜的来源界定各种蜂蜜的β-葡萄糖苷酶活力范围值,为蜂蜜掺假鉴别提供基础。
在贮存温度30℃、室温条件下,37、39°Be蜂蜜酶活力先增大后减少,且在5个月时达到最大值,而4℃条件下的各波美度蜂蜜的酶活力呈现降低现象。Sanchez等[19]研究也发现,蜂蜜中酶活力先增大后减小,且在6个月时,达到最大值(上升11.2%),这与本实验的研究结果基本一致。究其原因,可能是由于蜂蜜中存在部分的酵母菌等微生物[20],酵母菌本身能产生β-葡萄糖苷酶[21-23],在低浓度蜂蜜的温度环境下适宜繁殖,因此酶活力会有一个上升的过程,但随着储存时间的增加,酵母菌的繁殖受到抑制或死亡,导致酶活力也逐渐下降。而高波美度(41°Be)的蜂蜜足以抑制酵母菌的繁殖活动,因此,随储存时间的延长酶活力逐渐下降。
不同来源的β-葡萄糖苷酶,其酶学性质(蛋白质分子质量、结构及组成)存在一定的差异。例如,罗水忠等[24]研究表明绿豆中含有两种β-葡萄糖苷酶同功酶,两种同功酶分别被纯化了3.02倍和7.24倍,分子质量分别为92.4kD和140.0kD,其中一种为双亚基蛋白酶;Michlmayr等[25]从短乳杆菌中分离出的β-葡萄糖苷酶是一种同源四聚体,该分子质量为330kD。因此若在蜂蜜中人为加入β-葡萄糖苷酶,则可以从该酶的生物化学特性等角度进行鉴别,但这方面还有待进一步研究。
参考文献:
[1] 黄坚. 蜂蜜的药用价值[J]. 养蜂科技, 1994(5): 22.
[2] 曹炜, 尉亚辉. 蜂产品保健原理与加工技术[M]. 北京: 化学工业出版社, 2002: 198-204.
[3] COTTE J F, LHERITIER J, CASABIANCA H, et al. Application of carbohydrate analysis to verify honey authenticit[J]. Journal of Chromatography A, 2003: 145-155.
[4] CORDELLA C, MILITAO J, CLEMENT M C, et al. Detection and quantification of honey adulteration via direct incorporation of sugar syrups or bee-feeding: preliminary study using high-performance anion exchange chromatography with pulsed amperometric detection (HPAECPAD) and chemometrics[J]. Analytica Chimica Acta, 2005, 531(2): 239-248.
[5] RUOFF K, BOGDANOV S. Authenticity of honey and other bee products[J]. Apiacta, 2004, 38: 317-327.
[6] RUIZ A I, SORIA A C, MARTENEZ I, et al. A new methodology based on GC-MS to detect honey adulteration with commercial syrups[J].Journal of Agricultural and Food Chemistry, 2007, 55(8): 7264-7269.
[7] RUIZ A I, RODREGUEZ S, SANZ M L, et al. Detection of adulterations of honey with high fructose syrups from inulin by GC analysis[J].Journal of Food Composition and Analysis, 2010, 23(3): 273-276.
[8] 胡福良. 碳稳定同位素比值分析法(SIRA)在蜂蜜质量鉴别中的应用[J]. 中国养蜂, 2000, 51(6): 21-22.
[9] 徐景耀. 蜂蜜[M]. 北京: 中国农业科学技术出版社, 1995.
[10] 袁泽良, 冯峰. 蜂产品加工技术与保健[M]. 北京: 科学技术文献出版社, 2001.
[11] ODDO L P, BALDI E, ACCORTI M. Diastatic activity in some monofloral honeys[J]. Apidologie, 1990, 21(1): 17-24.
[12] ODDO L P, BALDI E, PIAZZA M G, et al. Characterization of monofloral honeys[J]. Apidologie, 1995, 26(4): 453-465.
[13] LOW N H, VONG K V, SPORNS P. A new enzyme,β-glucosidase, in honey[J]. Journal of Apicultural Research, 1986, 25(3): 178-181.
[14] PONTOH J, LOW N H. Purification and characterization ofβ-glucosidase from honey bees (Apis mellifera)[J]. Insect Biochemistry and Molecular Biology, 2002, 32(6): 679-690.
[15] 易松强, 郑火青, 张翠平, 等. 蜂蜜中β-葡萄糖苷酶活性测定及来源分析[J]. 食品科学, 2010, 31(19): 241-244.
[16] ESEN A.β-Glucosidase: overview[C]// ESEN A.β-Glucosidase biochemistry and molecular biology, ACS symposium series 533.Washington, DC: American Chemical Society, 1993: 1-14.
[17] DAENEN L, SAISON D, STERCKX F, et al. Screening and evaluation of the glucoside hydrolase activity in Saccharomyces and Brettanomyces brewing yeasts[J]. Journal of Applied Microbiology, 2008, 104(2): 478-488.
[18] JOO A R, MOON H J, JEYA M, et al. Production and characterization ofβ-1,4-glucosidase from a strain ofPenicillium pinophilum[J]. Process Biochemistry, 2010, 45(6): 851-858.
[19] SANCHEZ M D, HUIDOBRO J F, MATO I, et al. Change ofβglucosidase activity during the storage of honey[J]. Deutsche Lebensmittel-Rundschau, 2002, 98(5): 170-176.
[20] 黄文诚. 蜂蜜的卫生要求和技术措施[J]. 蜜蜂杂志, 2000(6): 6-7.
[21] 潘利华, 罗建平.β-葡萄糖苷酶的研究及应用进展[J]. 食品科学,2006, 27(12): 803-807.
[22] 李平, 宛晓春, 陶文沂, 等. 微生物发酵生产β-葡萄糖苷酶[J]. 安徽农业大学学报, 2000, 27(2): 196-198.
[23] RICCARDO N B, GIOVANNI S, ROSA P, et al. Selection, characterization and comparison ofβ-glucosidase from mould and yeasts employable for enological application[J]. Enzyme and Microbial Technology,2004, 35(1): 58-66.
[24] 罗水忠, 潘利华, 罗建平. 绿豆β-葡萄糖苷酶的分离纯化与性质研究[J]. 粮油加工, 2008(4): 92-95.
Discrimination between Authentic and Fake Honey Based onβ-Glucosidase Activity
ZHANG Jin-lian,ZHANG Cui-ping,ZHENG Huo-qing,YI Song-qiang,HU Fu-liang
(College of Animal Sciences, Zhejiang University, Hangzhou 310058, China)
A new method usingβ-glucosidase activity was proposed to detect honey adulteration. The activities ofβ-glucosidase in honey from different plants, different storage conditions, and different proportions of high-fructose rice syrup were determined. The results showed thatβ-glucosidase activity was detectable in honey samples from different plants; however,noβ-glucosidase activity was detected in honey adulterated with high-fructose rice syrup.β-glucosidase activity in rape honey showed little change during 11 months of storage at -18 ℃, 4 ℃, room temperature or 30 ℃. With increasing high-fructose rice syrup adulteration,β-glucosidase activity revealed a linear decline. In conclusion,β-glucosidase activity can be considered as an effective indicator for the identification of honey adulteration.
honey;β-glucosidase;adulteration;identification
TS201.25
A
1002-6630(2012)16-0150-04
2011-07-13
国家现代农业(蜂产业)技术体系专项(CARS-45)
张金连(1986—),女,硕士研究生,研究方向为蜜蜂科学。E-mail:jinlianzhang@126.com
*通信作者:胡福良(1964—),男,教授,博士,研究方向为蜜蜂科学。E-mail:flhu@zju.edu.cn
