响应面法优化菊花脑黄酮提取工艺
2012-10-27刘晶晶赵泓筠韩曜平王雪锋戴阳军
刘晶晶,赵泓筠,韩曜平,王雪锋,戴阳军
(常熟理工学院生物与食品工程系,江苏 常熟 215500)
响应面法优化菊花脑黄酮提取工艺
刘晶晶,赵泓筠,韩曜平,王雪锋,戴阳军
(常熟理工学院生物与食品工程系,江苏 常熟 215500)
采用Box-Behnken试验和响应面分析法研究菊花脑黄酮的提取工艺。结果表明,菊花脑黄酮的最佳提取工艺条件为乙醇体积分数78%、提取时间89min、水浴温度68℃、液料比41:1(mL/g),黄酮提取得率2.88mg/g。
菊花脑;黄酮;响应面法;提取
菊花脑(Chrysanthemum nankingense),菊科菊属,多年生宿根性草本植物,为南京八野菜之一。嫩茎叶食用,营养丰富,风味独特,具有浓郁的菊香味,食之清爽可口,色、香、味具佳。菊花脑可炒食、作汤或作火锅料,具有清热解毒、平肝明日、调中开胃、降血压等功效[1]。菊花脑含黄酮类、菊甙、腺嘌呤、胆碱、VB1、VC、低聚糖、茶多酚、天然抗氧化物质、膳食纤维和多种风味物质(如叶绿素、花黄素、香精)及多种挥发油;还含有丰富的无机盐,如Na、Ca、M g、Z n、C u、F e、M n、P 等[2]。
周丽娜等[3]对菊花脑茎叶甲醇提取物进行特征测定,观测到黄酮类化合物的特征吸收峰带;并用高效液相色谱法分析测定菊花脑干品中总黄酮含量为0.203%,而菊花脑中黄酮类化合物提取工艺的优化未见报道。本实验以菊花脑为原料,用乙醇来提取黄酮,采用响应面分析法优化其菊花脑黄酮的提取工艺,为菊花脑黄酮提取的产业化提供理论依据和技术支持。
1 材料与方法
1.1 材料、试剂与设备
菊花脑 中澳合资亚宝食品有限公司;芦丁标准品 国药集团化学试剂有限公司;乙醇、NaNO2、Al(NO3)3、NaOH(均为分析纯)。
FA2004型电子天平 上海越平科学仪器有限公司;HH-4型数显恒温水浴锅 国华电器有限公司;pHS-2F型pH计 上海精科仪器有限公司;DFT-200型高速中药粉碎机 温岭市林大机械有限公司;722s型可见分光光度计 上海棱光技术有限公司。
1.2 方法
1.2.1 芦丁标准曲线的绘制[4-6]
精密称取芦丁标品10.00mg,用体积分数95%乙醇溶液溶解定容至100mL,摇匀,即得到0.1mg/mL的芦丁标准溶液。准确移取芦丁标准溶液0、0.5、1.0、2.0、3.0、4.0、4.5mL于7只10mL带刻度的试管中,各加30%乙醇溶液定容至5mL,加5% NaNO2溶液0.3mL,摇匀,放置6min;加10% Al(NO3)3溶液0.3mL,混匀放置6min,加4% NaOH溶液2mL摇匀,最后加30%乙醇溶液定容到10mL,混匀放置20min后在510nm波长处测吸光度。以吸光度(A)为纵坐标,芦丁质量浓度(C)为横坐标,绘制芦丁标准曲线。由标准曲线可见芦丁溶液在0.005~0.045mg/mL范围内有很好的线性关系(R2=0.9995),吸光度(A)与芦丁质量浓度(C)之间的回归方程式为:A=6.4673C+0.0047
1.2.2 菊花脑黄酮提取与得率测定
取优质干燥的菊花脑,粉碎过筛,准确称取1.00g,加入乙醇在不同条件下回流提取,提取液减压抽滤后,将滤液定容到一定体积。精确移取1mL滤液,按照
1.2.1节方法测定黄酮含量。计算黄酮提取得率。

式中:C为试样的测定质量浓度/(mg/mL);V为滤液体积/mL;m为试样质量/g。
1.2.3 单因素试验[7-10]
在固定提取条件pH7、乙醇体积分数75%、浸提时间1h、浸提温度60℃、料液比1:40条件下,分别以pH值(5、6、7、8、9)、乙醇体积分数(30%、45%、60%、75%、90%)、液料比(20:1、30:1、40:1、50:1、60:1(mL/g))、浸提时间(30、60、90、120、150、180min)、浸提温度(40、50、60、70、80℃)五个因素进行单因素试验,测定其对黄酮提取得率的影响。
1.2.4 菊花脑黄酮提取工艺优化响应面试验[11-15]
根据单因素试验结果,采用Design-Expert 7.1.6软件中的Box-Behnken试验设计原理设计响应面试验,选取乙醇体积分数、提取时间、提取温度和液料比4个因素作为试验因素,以黄酮提取得率为响应值设计试验,试验因素及水平见表1。

表1 菊花脑黄酮提取工艺优化响应面试验因素与水平Table 1 Coded values and corresponding actual values of the optimization variables used in response surface analysis
2 结果与分析
2.1 pH值对菊花脑黄酮提取得率的影响

图1 pH值对菊花脑黄酮提取得率的影响Fig.1 Effect of pH on extraction rate of flavonoids from Chrysanthemum nankingense
由图1可知,随着pH值的增大,黄酮的提取得率先升高后降低,当pH7时,菊花脑黄酮的提取得率最高,为2.95mg/g,可以看出菊花脑中黄酮提取适宜在中性的环境中进行,选择pH7较合适。
2.2 乙醇体积分数对菊花脑黄酮提取得率的影响

图2 乙醇体积分数对菊花脑黄酮提取得率的影响Fig.2 Effect of ethanol concentration on extraction rate of flavonoids from Chrysanthemum nankingense
由图2可知,菊花脑中黄酮的提取得率随着乙醇体积分数的增大而增大。当乙醇体积分数达75%时,黄酮提取得率最高,继续增大黄酮的提取得率反而下降,这是由于不同体积分数的乙醇极性不同,黄酮具有较高的极性,根据相似相溶原理,乙醇体积分数为75%时对菊花脑黄酮的溶解能力最强,所以选择体积分数75%比较合适。
2.3 料液比对菊花脑黄酮提取得率的影响

图3 液料比对菊花脑黄酮提取得率的影响Fig.3 Effect of material-to-liquid ratio on extraction rate of flavonoids from Chrysanthemum nankingense
由图3可以看出,随着提取溶剂体积的增大,提取得率也随之增大。这是因为随着提取溶剂体积的增大,菊花脑粉末与提取溶剂接触面的浓度差增大,黄酮就越容易渗透出来;当提取溶剂体积增大到一定值后,由于菊花脑中黄酮的含量有限,提取得率的增加趋于平缓。而且,溶剂的用量增加,导致提取成本的增加,因此,确定液料比40:1。
2.4 提取时间对菊花脑黄酮提取得率的影响
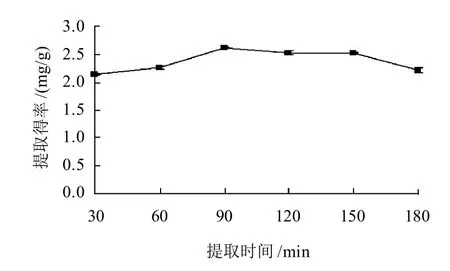
图4 提取时间对菊花脑黄酮提取得率的影响Fig.4 Effect of extraction time on extraction rate of flavonoids from Chrysanthemum nankingense
由图4可以看出,在水浴加热提取的前90min,提取时间越长,黄酮提取得率越高。但提取时间超过90min后,提取得率随着提取时间的延长反而降低,这可能是由于提取时间过长,导致菊花脑中某些黄酮被破坏。因此水浴加热提取的时间选择在90min较好。
2.5 提取温度对菊花脑黄酮提取得率的影响

图5 提取温度对菊花脑黄酮提取得率的影响Fig.5 Effect of extraction temperature on extraction rate of flavonoids from Chrysanthemum nankingense
由图5可以看出,在水浴加热条件下,水浴温度低于70℃时,菊花脑中黄酮的提取得率随着提取温度的升高而增加,温度继续升高,黄酮的提取得率反而降低,这可能是因为提取温度的升高破坏了菊花脑中某些黄酮,使提取得率降低,所以选择水浴提取温度70℃较为合适。
2.6 响应面法提取菊花脑黄酮的试验结果
根据Box-Behnken试验设计原理,选取乙醇体积分数、提取时间、提取温度、液料比4因素进行组合中心组合试验,试验结果见表2。

表2 响应面法提取菊花脑黄酮试验结果Table 2 Experimental design and corresponding results for response surface analysis
采用Design Expert 7.1.6软件对试验结果进行回归分析,拟合后得到乙醇体积分数X1、提取时间X2、提取温度X3和液料比X4的二次多项式回归模型为:
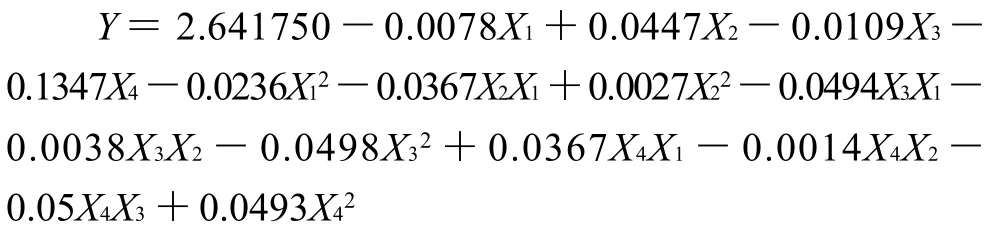

表3 回归系数显著性检验表Table 3 Significance analysis of each regression coefficient of the fitted regression model
以黄酮提取量为响应值时,模型P=0.0467<0.0500,表明该二次方程模型显著,即可以使用该数学模型推测试验结果。并对回归方程作显著性检验,结果见表3。
由表3可知,在一次项中,各因素对黄酮提取得率的影响由大到小依次为提取温度>乙醇体积分数>液料比>提取时间,其中提取温度的影响极显著(P<0.01),乙醇体积分数的影响显著(P<0.05)。在交互项中,提取温度和乙醇体积分数、提取温度和提取时间影响达到显著水平(P<0.05)。因素间交互作用显著的响应面图见图6。由图6可知,响应面开口向下,随着每个因素的增大,响应值增大,当响应值增大到极值后,随着因素的增大,响应值逐渐减小。该模型有稳定点,且稳定点是最大值。从其等高线图可以直观地看出,等高线为椭圆形,证明提取温度和乙醇体积分数,提取温度和提取时间这两组的两个因素的交互作用显著。
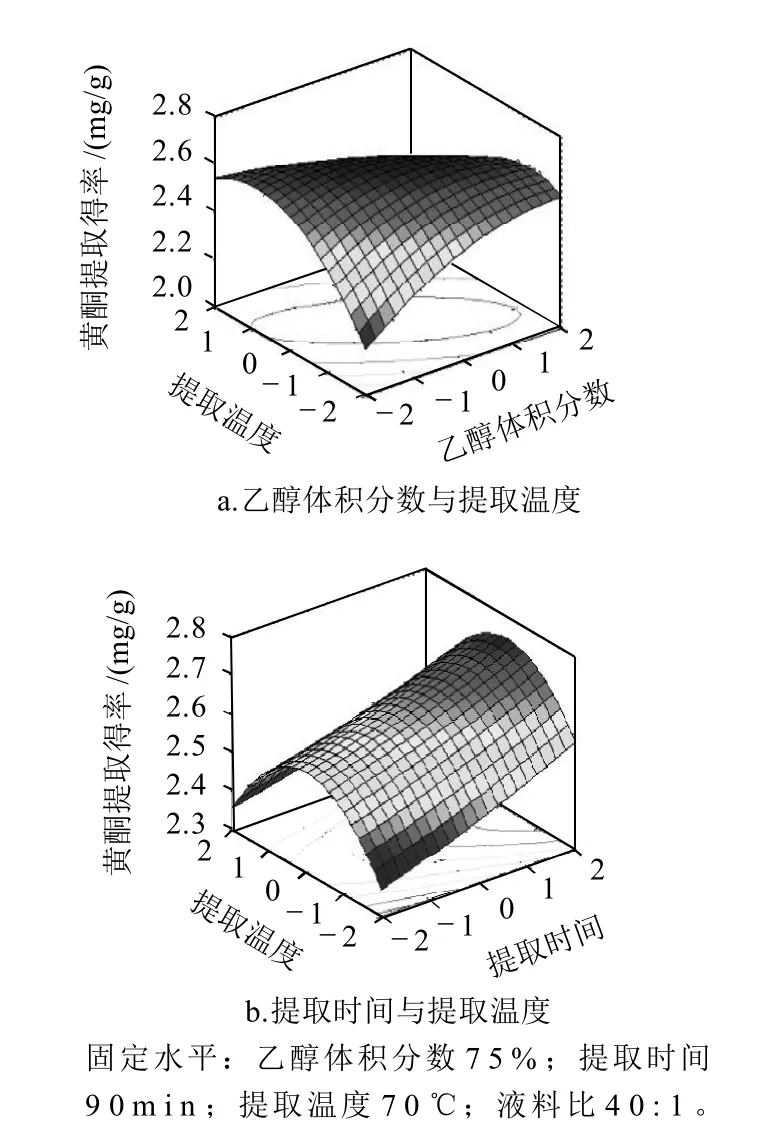
图6 各因素交互作用对黄酮得率影响的响应面图Fig.6 Response surface plots for the interactive effects of extraction parameters on extraction rate of flavonoids from Chrysanthemum nankingense
通过Design-Expert 7.1.6软件得到的最佳提取工艺条件为乙醇体积分数78.20%、提取时间88.83min、提取温度67.63℃、液料比41.05:1(mL/g),预测响应值为2.61mg/g。
采用上述最优提取条件进行验证实验,同时考虑到实际操作的便利,将菊花脑黄酮提取最佳工艺条件修正为乙醇体积分数78%、提取时间89min、水浴温度68℃、液料比41:1(mL/g),实际测得的黄酮提取得率2.88mg/g。与周丽娜等[3]的研究结果菊花脑茎叶干品中总黄酮含量为0.203%有一定差异,这与菊花脑的来源、不同气候及采摘期有一定的关系。
3 结 论
菊花脑黄酮最佳提取条件为乙醇体积分数78%、提取时间89min、水浴温度68℃、液料比41:1(mL/g),实际测得的黄酮提取得率2.88mg/g,比理论预测值高0.27mg/g。因此,采用RSA法优化得到的菊花脑黄酮提取条件参数准确、可靠,具有实用价值。
[1] 汤庚国, 李湘萍. 江苏野菜资源的利用与开发[J]. 植物资源与环境,1995, 4(3): 35-36.
[2] 肖玫, 刘彪, 李林. 马齿苋、菊花脑的矿物质元素测定及其开发应用[J]. 粮油加工, 2001(6): 32-33.
[3] 周丽娜, 翁德宝. 菊花脑多糖及黄酮类化合物分离提取的研究[J]. 江苏教育学院学报: 自然科学版, 2005, 22(3): 12-15.
[4] 姜秀娟, 唐金成, 白红进, 等. 可见分光光度法测定刺山柑花蕾中总黄酮含量[J]. 食品科学, 2010, 31(18): 59-63.
[5] 魏永生, 王永宁, 石玉平, 等. 分光光度法测定总黄酮含量的实验条件研究[J]. 青海大学学报: 自然科学版, 2003, 21(3): 61-63.
[6] 尉芹, 王冬梅, 马希汉, 等. 杜仲叶总黄酮的测定[J]. 西北农林科技大学学报, 2001, 29(5): 119-123.
[7] LEE Meihua, LIN Chuanchuan. Comparison of techniques for extraction of isoflavones from the root ofRadix Pereira: Ultrasonic and pressurized solvent extractions[J]. Food Chem, 2007, 105(1): 223-228.
[8] WANG Yanling, XI Guangsheng, ZHENG Yongchun, et al. Microwaveassisted extraction of flavonoids from Chinese herbRadix Puerariae(Ge Gen)[J]. Journal of Medicinal Plants Research, 2010, 4(4): 304-308.
[9] 岳秀梅. 淡竹叶中总黄酮的提取与含量测定[J]. 世界中西医结合杂志, 2009, 4(3): 177-178.
[10] 卫静莉, 高松平, 董梅, 等. 柿叶提取黄酮类化合物方法及鉴定[J].林业科技开发, 2007, 21(3): 47-49.
[11] 赵翾, 李红良, 张惠妹. 响应面法优化火麻仁黄酮提取工艺[J]. 食品科学, 2011, 32(2): 127-132.
[12] 张国文, 胡明明, 何力, 等. 响应面分析法优化微波提取夏枯草中黄酮化合物的工艺研究[J]. 南昌大学学报: 工科版, 2010, 32(4): 385-389.
[13] 于浩, 阮美娟, 赵龙, 等. 响应面法优化荷叶黄酮超声提取条件的研究[J]. 食品研究与开发, 2010, 31(1): 55-60.
[14] 吴华勇, 黄赣辉, 顾振宇, 等. 响应曲面法优化竹叶总黄酮的提取工艺研究[J]. 食品科学, 2008, 29(11): 196-200.
[15] LIM J Y, YOON H S, KIM K Y. Optimum conditions for the enzymatic hydrolysis of citron waste juice using response surface methodology(RSM)[J]. Food Science and Biotechnology, 2010, 19(5): 1135-1142.
Optimization of Extraction Process for Flavonoids fromChrysanthemum nankingenseby Response Surface Methodology
LIU Jing-jing,ZHAO Hong-jun,HAN Yao-ping,WANG Xue-feng,DAI Yang-jun
(Department of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Box-Behnken experimental design and response surface analysis were used to optimize the extraction of flavonoids fromChrysanthemum nankingense. The results showed that the optimal process conditions for the extraction of flavonoids fromChrysanthemum nankingensewere 78% ethanol solution as the solvent at a material-to-liquid ratio of 1:41, extraction time of 89 min, and extraction temperature of 68℃. Under these conditions, the yield of flavonoids was 2.88 mg/g.
Chrysanthemum nankingense;flavonoids;response surface methodology;extraction
Q946.83
A
1002-6630(2012)16-0068-04
2011-06-09
刘晶晶(1978—),女,副教授,硕士,研究方向为食品加工和天然产物活性物质的开发与利用。E-mail:ljj@cslg.edu.cn
