CS-PVA-NH4Cl共混固态聚合物电解质膜的制备与性能
2012-10-27闫康平
杨 丞,闫康平
(四川大学化学工程学院,四川 成都 610065)
0 引 言
固态聚合物电解质(SPE)作为近年来广受关注的新型电解质,可广泛应用在燃料电池、电化学传感器、超级电容器等领域,而作为薄膜电池等一类新型微型能源装置的关键组成部分,其诸如电导率,电化学稳定窗口等性能的优劣直接决定了电池性能的好坏。SPE膜过去主要采用PEO[1]作为基体进行掺杂改性。
聚乙烯醇(polyvinyl alcohol,PVA)具有良好的成膜性质,生物相容性,可降解性,已被广泛运用于生物医学领域;在电化学方面,聚乙烯醇作为成膜材料为掺杂的导电剂提供场所,也得到了很好的效果[2]。陈忠元等使用Nb2O5掺杂PVA得到的SPE室温电导率在10-3S·cm-1数量级[3]。壳聚糖(chitosan,CS,1,4-二氨基-2-脱氧-β-D-葡萄糖)由于其具有的成膜性能,无毒无害,丰富的来源等特性,已经在纺织、化妆品等领域得到了广泛应用,而作为SPE膜基体,单纯的壳聚糖膜电导率在10-5S·cm-1,且较脆、力学性能欠佳,还无法作为电解质实际运用[4]。文献[5]中对其进行了广泛的电导率改性工作,A K Arof等向壳聚糖主体中添加油酸作为增塑剂,并添加LiOAc作为添加盐类,在含有质量分数40%LiOAc与10%OA最高电导率达到了10-5S·cm-1数量级[5],Ying Wan等将壳聚糖作为基础结构矩阵并在其中溶解KOH提供导电离子,得到室温下含5.5~8.5wt.%KOH 电导率为10-6S·cm-1的干燥薄膜[6]。制备方法上,聚乙烯醇(PVA)具有良好的成膜性能,成膜后具有良好的机械性能,并能与壳聚糖很好的互溶,与壳聚糖进行共混,避免了使用有毒的戊二醛对PVA进行交联,且可以用工艺简单的溶液浇铸法进行SPE膜制备,CS-PVA体系SPE膜由于其两种基体材料的良好性能得到了越来越多的关注,对其添加无机盐类进行改性后能大大提高膜电导率和稳定性[7]。
对导电机理的解释方面,SPE膜的导电性能高度依赖于其内部含水量[8]。R H Y Subbaw等使用弱电解质理论解释添加NaClO4于1 g/100 ml壳聚糖-乙酸溶液中,室温下缓慢干燥得到含有NaClO4的乙酰基壳聚糖薄膜,认为在酸性水溶液中,壳聚糖的氨基被质子化,使得壳聚糖表现出一种阳离子聚合物的性质,掺杂的盐类阳离子被吸附在壳聚糖的氮、氧原子之上[9]。由于胺官能团上氮氧原子与其中盐类的共同存在,导致壳聚糖SPE膜的导电机理十分复杂,目前公认的主要解释来自Rice与Roth对其SPE膜提出的离子传导模型[10]。
笔者将作为传统工业电解液的NH4Cl使用到SPE膜中进行掺杂改性,使用溶液浇铸法制备得到CS-PVA-NH4Cl体系SPE膜,并利用Zview软件对得到的交流阻抗进行拟合,使用Hebb-Wagner直流极化法测量离子迁移率[11],循环伏安测得该膜电化学稳定窗口,以期能够得到性能优良,能够在电池等电化学器件中实际使用的固态聚合物电解质膜。
1 实 验
1.1 聚合物电解质膜的制备
分别将3.6 g壳聚糖(AR,分子量1.0×105~3.0×105,成都科龙)常温下溶于100 ml 1%冰乙酸溶液,2.4 g聚乙烯醇(AR,聚合度DP=1799±50,成都科龙)95℃下溶于100 ml去离子水中,二者充分搅拌混匀后分别按比例加入NH4Cl,得到的均匀粘稠液体倒入有机玻璃模具中,室温下静置脱泡,恒温干燥箱内50℃下干燥得到CS-PVA-NH4Cl电解质膜,按其中NH4Cl质量分数0、10%、20%、30%、40%、50%、60%分别编号为0#、1#、2#、3#、4#、5#、6#,同一编号下浇铸4个样本进行测试后计算平均值。
1.2 性能测试
1.2.1 溶胀度计算
将完全干燥后薄膜称重再用去离子水充分浸泡,用滤纸吸干表面水分,溶胀度R由式(1)计算:
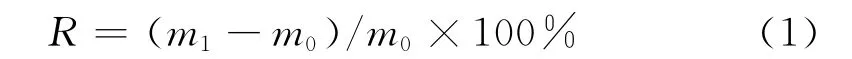
式中,m1为充分吸水后膜重;m0为干燥状态下膜重。
1.2.2 电导率δ的测定
将充分吸水后的固态电解质膜剪为圆片,用滤纸吸去薄膜表面水分,夹在两片直径2.4 cm的高压石墨电极之间构成 C/CS-PVA-NH4Cl/C电极体系,连接到普林斯顿273 A电化学工作站上进行测试,测试频率范围105Hz~10 Hz,正弦波扰动振幅5 mV。电导率δ采用式(2)进行计算:

式中,Rb为电极体系电阻,在本文采用的电极体系中即可认为是固态电解质膜本体电阻,由Zview软件进行拟合得到;A为电解质膜有效工作面积;l为固态电解质膜厚度。
1.2.3 离子迁移数(tion)的测定
在上述电极体系两边施加稳定直流电压,测试通过体系的电流逐渐降低并趋于稳定,得出电流-时间曲线,并按式(3)计算[12]:
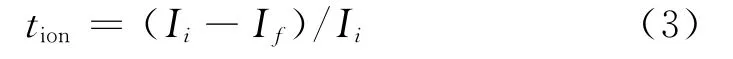
式中,Ii为初始总电流,是离子电流与电子电流之和;If为最终稳定电流,仅为电子电流。
1.2.4 电化学稳定窗口测试
将上述电极体系连接到普林斯顿273 A电化学工作站,扫描速度1 mV/s,扫描范围-2.0V~2.0V,进行循环伏安测试,得到稳定电化学窗口电压。
2 结果与讨论
2.1 外观与溶胀度
干燥后的薄膜外观呈均匀半透明的淡黄色,伴随NH4Cl添加量增加,颜色逐渐变为白色,具有一定的韧性,使用游标卡尺测量厚度平均值为0.15 mm。溶胀度R根据式(1)计算,各个试样溶胀度结果如表1。

表1 不同NH4Cl掺杂量聚合物电解质膜溶胀度
在文献中确定的壳聚糖与聚乙烯醇最佳配比为3:2基础上添加NH4Cl后,各个试样溶胀度均为10倍左右,主要是由于壳聚糖及聚乙烯醇都具有良好的吸湿率,膜内部大量的自由水给离子迁移提供了场所和通道。
2.2 交流阻抗谱拟合
本实验中采用 C/CS-PVA-NH4Cl/C电极体系,利用离子阻塞型石墨电极进行交流阻抗测试,图1为样品交流阻抗谱,对于理想的电解质膜谱图应为垂直于实轴的一条直线,即只有体系电阻R1存在,但由于电极表面粗糙、电解质共混无法形成完全均一体系等因素影响,在高频区会出现半弧,半弧在模拟电路中使用CPE元件(Constant Phase Element、常相元素)代表,是容抗与感抗的共同作用,Z 满足式(4)[13]:

此时的Z在n值降低时,阻抗谱高频半弧会被压扁。n=1时为理想电容,n=0时为理想电阻,可见所制备的聚合物电解质膜伴随电导率的升高,圆弧半径逐渐减小,n值逐渐增大,电解质表现出更多的电容性质。当电阻小到圆弧最高点频率超过仪器测定频率范围时,在阻抗复平面图上,除了低频区的直线,高频区的圆弧很短或直接消失,在40%NH4Cl掺杂时电导率达到最高,在复平面图上只能观测到一条直线。在低频区通过电解质膜的电流可以近似认为是直流电,由于直流电的作用,膜内部开始有扩散发生,伴随扩散过程导致电极表面出现厚而致密的钝化膜时,膜内扩散阻抗用Warburg阻抗W1表示,由于W1的存在,曲线发生上翘,在低频部分表现为一条45°倾斜向上的斜线,离子的迁移过程受到极大的抑制,并使得半圆弧右端无法与实轴相交。但这不影响电导率的测定和后续的拟合。
文献中往往采用直线外推的方法求得与实轴的交点即体系电阻Rb,本文使用Zview交流阻抗拟合软件进行拟合计算,图2为交流阻抗谱等效电路。
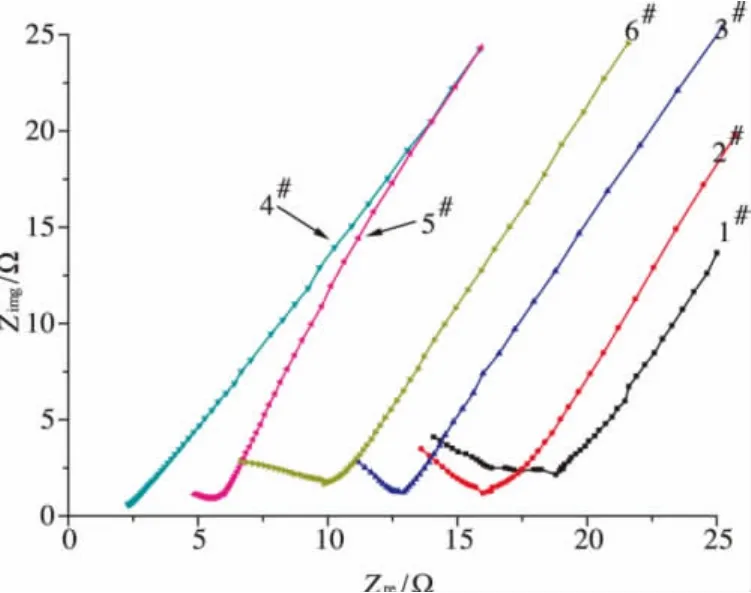
图1 不同NH4CI掺杂固体聚合物电解质膜交流阻抗谱
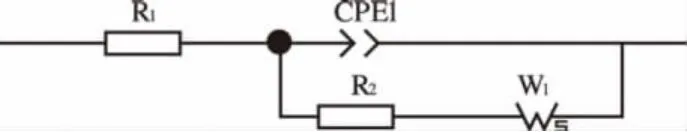
图2 交流阻抗谱等效电路
由于固态聚合物电解质膜同时受电化学和浓差极化混合控制,交流信号通过电极时,除了浓差极化外还将出现电化学极化,这时电极反应过程在高频部分为双电层的容抗弧,而在低频部分,扩散控制将超过电化学控制,出现Warburg阻抗,其拟合后阻抗图谱如图3所示。该等效电路理想状态下在阻抗复平面图上的曲线为高频区的一段圆弧和低频区的一条直线。在通常测定电池电阻时,由于电导较小,在阻抗复平面图上可以看到完整的高频区圆弧,而半圆弧左端点与实轴交点即代表电池电极体系的体系电阻R1,右端点与实轴交点代表电极体系的体系电阻R1与极化电阻R2之和。

图3 交流阻抗谱拟合图谱
从拟合结果表2可以看出,NH4Cl的添加带来了在膜内部可以自由迁移的导电离子,伴随体系阻抗R1及极化电阻R2的降低,薄膜阻抗在不断降低。CPE元件的两个参数CPE-T及CPE-P中CPE-P的相位角参数变化在各个样中均超过了0.5,即在式(4)中n>0.5,可以认为样品在低频区表现出更多的电容性质。Warburg阻抗W1受含水膜内部微观结构导致离子扩散过程的不稳定,且导电过程由离子导电主导,无法忽略W1或设置为Fixed进行拟合的影响,三个参数变化缺乏规律,只能看出W1-R数值上0#比其他样品至少大104倍,可认为主要是受掺杂的影响。
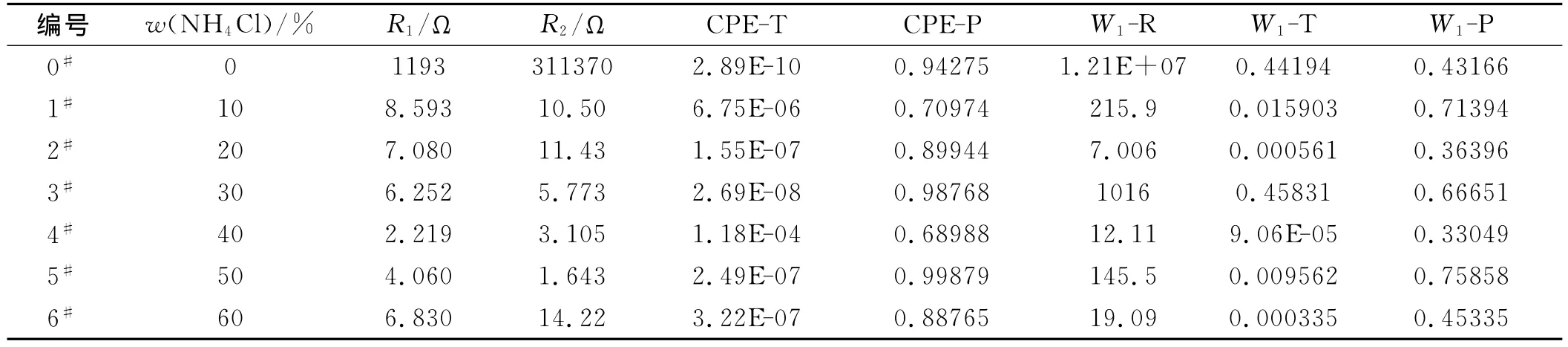
表2 不同NH4Cl掺杂量聚合物电解质膜拟合结果
2.3 NH4Cl含量对电导率的影响
由扩散主导的固体电解质薄膜电导率还可表示为式(5)

式中,n,e,μ分别为电荷载体的数量、电荷数与迁移能力[14],在掺杂同一种无机盐类的情况下e为常数,σ取决于载体数量n、迁移能力μ。而迁移能力μ也受掺杂物自由离子浓度影响。如图4可见,随着NH4Cl掺杂浓度的增加,即n的增加,薄膜电导率逐渐提高,在40%掺杂量时得到了1.4×10-3S·cm-1的电导率。伴随NH4Cl掺杂浓度的进一步增加,离子无法完全自由电离,且自由离子数量n受限于壳聚糖主体的吸收能力,离子在其中呈现一种“拥挤”的状态,而实际上参与电荷载运与迁移的自由离子数量反而减少,导致迁移能力μ降低,最终导致电导率的降低。
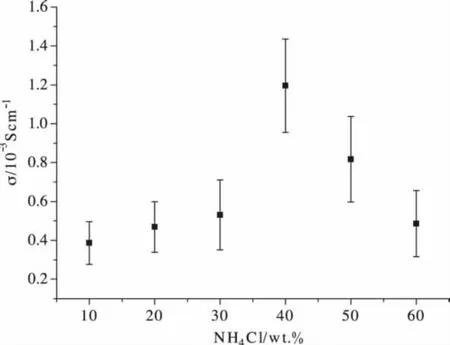
图4 不同NH4Cl掺杂固体聚合物电解质膜电导率
2.4 NH4Cl含量对离子迁移数的影响
在向本文使用的C/CS-PVA-NH4Cl/C体系施加一恒定直流电压后,最初离子和电子都共同参与导电,随后自由离子在高压石墨离子阻塞电极处迅速耗尽,电流只剩下电子传递部分,过程逐渐达到稳态,由图5可知,40%NH4Cl掺杂下薄膜为初始总电流Ii=1.46×10-5A,最终稳定电流If=0.10×10-5A,由式(3)得40%NH4Cl掺杂离子迁移率tion=0.93。而未掺杂的0#样基本没有离子迁移现象发生,且其I-T曲线波动很大。
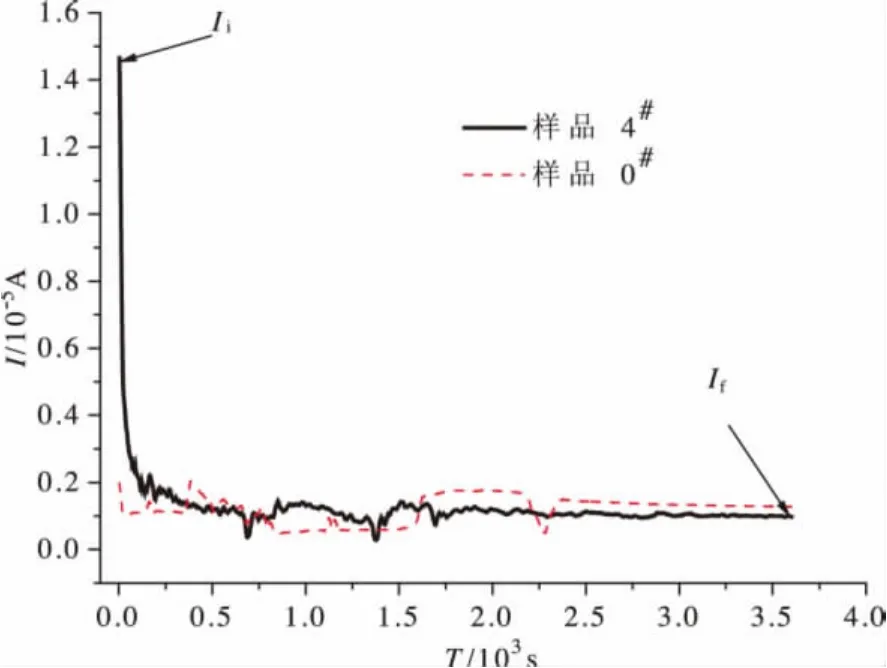
图5 固体聚合物电解质膜电流-时间曲线
伴随盐含量的增加,wt.40%之前,离子迁移数不断提高,可以认为溶解在电解质膜基体中的盐类提供了更多的自由离子进行迁移,而超过40%之后,大量的离子在电解质膜中重新结合,自由离子数减少,离子迁移数反而下降,得到的离子迁移数计算如表3,离子迁移数的变化规律与电导率相同,最高值出现在40%掺杂量处,也证明了导电过程由离子导电主导。
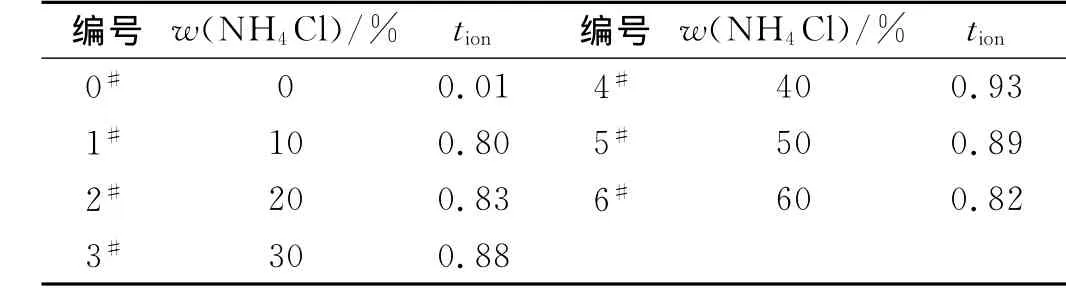
表3 不同NH4Cl掺杂量聚合物电解质离子迁移数
2.5 电化学稳定窗口
由图6可知,样品4#的极化电流出现在-1 V~1 V之间,电化学稳定窗口在2.0V左右,主要是由于CSPVA共混体系得到的膜具有良好的韧性和强度,添加NH4Cl在增强导电性的同时,对PVA有一定的增塑作用,可以推迟电解质极化的发生,拓宽电化学稳定窗口。
3 结 论
通过向CS-PVA体系中添加NH4Cl进行掺杂改性,采用溶液浇铸法制备了SPE膜,具有良好的韧性和极高的溶胀度。在NH4Cl掺杂量40%时,通过对交流阻抗谱的拟合得到了1.4×10-3S·cm-1的室温电导率。采用直流极化法测定该掺杂SPE膜导电过程由离子导电主导,在40%掺杂量时,离子电导率达到0.93的最高值,此时SPE膜室温电化学稳定窗口在2.0V左右。
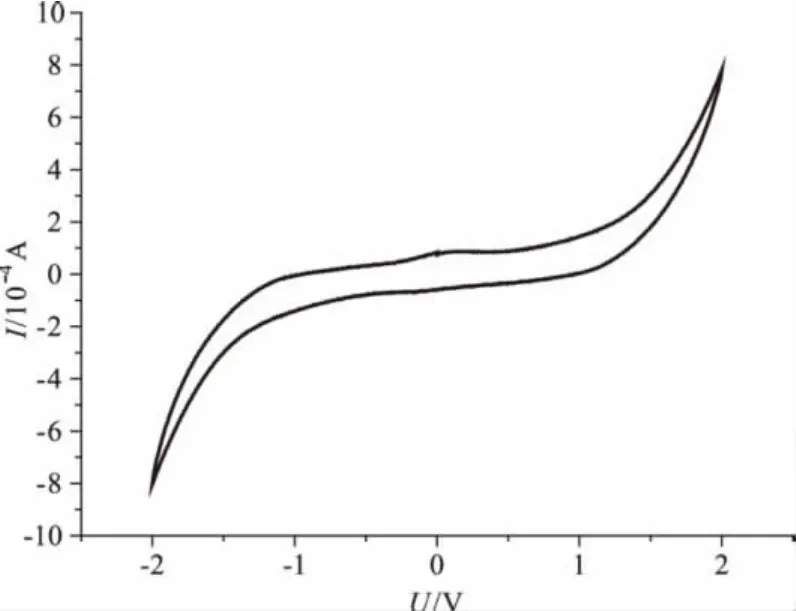
图6 样品4#的循环伏安曲线
采用共混溶液浇注法制备的CS-PVA-NH4Cl体系SPE膜,具有材料对环境友好,制备过程简便,能达到较高的电导率的特点。但是其导电过程,电化学行为复杂,由多个不可忽略的电化学极化与扩散过程交互主导,通过使用等效电路对其进行数值模拟,可以加深对离子导电模型与相关电化学行为的了解。
[1]Fenton D E,Parker J M,Wright P V,et al.Complexe of alkali metal ions with poly(ethytlene oxide)[J].Polymer,1973,14:589-591.
[2]Arunima Saxena,Arvind Kumar,et al.Preparation and characterization of N-methylene phosphonic and quaternized chitosan composite membranes for electrolyte separations[J].Journal of Colloid and Interface Scien,2006,303:484-493.
[3]Chen Zhongyuan(陈忠元),JV Yalan(居亚兰).PVA/Nb2O5复合碱性固体聚合物电解质的性能[J].Battery Bimonthly(电池),2009,39(4):200-202.
[4]Ying Wan,Katherine A M Creber,et al.Chitosan-based electrolyte composite membranes I.Preparation and Characterization[J].J.Membrane Science,2006,280:666-674.
[5]M Z A Yahya,A K Arof,et al.Effect of oleic acid plasticizer on chitosan-lithium acetate solid polymer electrolytes[J].European Polymer Journal,2003,39:897-902.
[6]Ying Wan,Katherine A M Creber,et al.Chitosan-based electrolyte composite membranes II.Mechanical properties and ionic conductivity[J].J.Membrane Science,2006,284:334-331.
[7]L S Ng,A A Mohamad,et al.Protonic battery based on a plasticized chitosan-NH4NO3 solid polymer electrolyte[J].J.Power Source,2006,163:382-384.
[8]Chun Chen Yang.Chemical composition and XRD analyses for alkaline composite PVA polymer electrolyte[J].Materials Letters,2003,58:33-38.
[9]R H Y Subbaw,A K Arof,et al.Polymer batteries with chitosan electrolyte mixed with sodium perchlorate[J].Material Science&Engineering B,1996,38:156-160.
[10]M J Rice,W L Roth.Ionic transport in super ionic conductors:a theoretical model[J].Journal of Solid State Chemistry,1972,4(2):294-310.
[11]WU Lingli(吴玲丽),WANG Shizhong(王世忠).La0.9Sr0.1Ga0.8Mg0.2AlxO3-σ(x=0~0.05)电解质电导率的研究[J].Battery Bimonthly(电池),2009,39(4):429-431.
[12]TANG Zhiyuan(唐致远),WANG Zhanliang(王占良).塑料锂离子电池用聚合物电解质性能表征[J].Polymer Materials Science and Engineering(高分子材料科学与工程),2002,18(2):33-36.
[13]CAO Chu nan(曹楚南),ZHANG Jian qing(张鉴清).电化学阻抗谱导论[M].Beijing(北京):Science Press(科学出版社),2002.
[14]Tan Winie,S Ramesh,et al.Studies on the structure and transport properties of hexanoyl chitosan-based polymer electrolytes[J].Physica B,2009,404:4308-4311.
