丙酸杆菌素高产菌株的诱变选育
2012-10-26王立梅
刘 靖,王立梅,齐 斌,*
(1.吉林农业大学食品工程学院,吉林长春130118;2.常熟理工学院生物与食品工程学院,江苏常熟215500;3.苏州市食品生物技术重点实验室,江苏常熟 215500)
丙酸杆菌素高产菌株的诱变选育
刘 靖1,王立梅2,3,齐 斌2,3,*
(1.吉林农业大学食品工程学院,吉林长春130118;2.常熟理工学院生物与食品工程学院,江苏常熟215500;3.苏州市食品生物技术重点实验室,江苏常熟 215500)
丙酸杆菌素是乳品丙酸杆菌代谢合成的一种重要的多肽或蛋白质,能抑制革兰氏阴性菌、部分革兰氏阳性菌、霉菌和酵母菌的生长。以丙酸杆菌Propionibacterium feudenreichii CS01为出发菌株,采用紫外(UV)和亚硝基胍(NTG)复合诱变的方法,获得高产突变株N11和N42,其抑菌活性达到28.63、28.83AU/mL,分别比原始出发菌株(21.14AU/mL)提高了35.4%和36.4%。
丙酸杆菌素,紫外,亚硝基胍,诱变
乳品丙酸杆菌可以代谢合成一种重要的多肽或蛋白质,称之为丙酸杆菌细菌素,它能抑制乳品中革兰氏阴性菌、部分革兰氏阳性菌、霉菌和酵母的生长,从而防止乳制品变质[1]。丙酸杆菌素在食品防腐剂方面具有很大潜力,已经引起广泛的关注[2-4],许多国外学者相继对其进行研究,我国在这方面的研究还处于起步的阶段[5-7]。由于丙酸杆菌素存在产量低、成本高、效价低、用量大、抗菌时效短等问题,因此需要对菌种进行改良以提高其经济效益。本文以费氏丙酸杆菌谢氏亚种Propionibacterium feudenreichii CS01为出发菌株,进行紫外和亚硝基胍复合诱变,探索诱变条件,并得到两株稳定高产的突变株N11和N42。
1 材料与方法
1.1 实验材料
丙酸杆菌Propionibacterium.feudenreichii CS01,金黄色葡萄球菌(Staphyloccocus aureus)ATCC25923;液体培养基(g/L) 乳酸钠20,酵母膏10,KH2PO41,MgSO40.2,Tween80 1,pH 7.0;固体培养基(g/L) 乳酸钠20,酵母膏10,KH2PO41,MgSO40.2,Tween80 1,琼脂20,pH7.0;发酵培养基(g/L) 葡萄糖20,酵母膏10,KH2PO41,MgSO40.2,Tween80 1,pH 7.0;指示菌培养基(g/L) 牛肉膏3,蛋白胨10,NaCl 5,琼脂20,pH 7.0;亚硝基胍(NTG) 在通风橱中称取1g亚硝基胍加入10m L丙酮作为助溶剂,完全溶解后取1m L亚硝基胍丙酮溶液加入9m L磷酸盐缓冲液(pH 7.4,0.02mol/L)配制成NTG浓度为10mg/m L的亚硝基胍母液,保存于棕色瓶中[8];生理盐水(0.85%) NaCl 8.5g,蒸馏水1000m L,于115℃灭菌20min。
1.2 实验方法
1.2.1 菌悬液的制备 用接种环将平板上活化好的菌株挑取一环单菌落接种到10m L液体培养基中,30℃厌氧培养2.5d,按照2%的接种量接种到装有30m L液体培养基的100m L三角瓶中,30℃厌氧培养2.5d。将培养液于8000r/min离心10min并用生理盐水洗涤两次,加入0.05mol/L Tris-HCl(pH 7.1)中,调整菌体浓度为108cfu/m L。
1.2.2 紫外(UV)诱变[8]
1.2.2.1 紫外(UV)诱变剂量的确定 将紫外灯打开预热20~30min,取10m L菌悬液于直径为9cm的无菌培养皿,液层厚度约2mm,放于磁力搅拌器上搅拌,使用254nm的紫外灯管,照射距离为20cm,照射时间分别为1、2、3、4、5m in,各取1m L菌液在红光下进行倍数稀释后涂布于固体平板上,30℃避光厌氧培养3d,采用平板菌落计数法计算致死率。
1.2.2.2 紫外与光复活交替处理诱变 将紫外灯打开预热20~30m in,取10m L菌悬液置于直径为9cm的无菌培养皿,液层厚度约2mm,放于磁力搅拌器上搅拌,使用254nm的紫外灯管,照射距离为20cm,照射时间为实验得到的最佳诱变剂量,再将UV照射后的菌悬液置于日光灯下10min,反复操作三遍后进行倍数稀释后涂布于固体平板上,30℃避光厌氧培养3d,采用平板菌落计数法计算致死率。
1.2.3 亚硝基胍(NTG)诱变 取6等份菌悬液,加入一定比例的NTG母液,使菌悬液亚硝基胍终浓度分别为0、0.2、0.4、0.6、0.8、1.0g/L,30℃振荡30m in,加入1000倍4℃无菌生理盐水稀释,终止诱变[9-10]。混合均匀后进行倍数稀释,涂布于固体培养基平板上,30℃厌氧培养3d,采用平板菌落计数法计算致死率。

1.2.4 紫外(UV)和亚硝基胍(NTG)复合诱变处理
按照上述诱变方法,进行3轮紫外(UV)光复活交替诱变,筛选出高产菌株并以其做为出发菌株进行3轮亚硝基胍(NTG)诱变。
1.2.5 正向突变株的遗传稳定性实验 采用连续传代的方法检验正突变株高产丙酸杆菌素的稳定性。将诱变后长出的菌落进行反复筛选发酵,测定丙酸杆菌素的抑菌活性。将抑菌活性高的菌株连续传代5次。
1.2.6 突变株发酵生产丙酸杆菌素 挑取一环诱变获得的菌株,接种于5m L液体培养基中,30℃培养2.5d后,接种于50m L发酵培养基中,30℃培养9d。将发酵液在4℃,2500r/m in的条件下离心10m in,取上清液并边搅拌边缓慢加入硫酸铵粉末,至硫酸铵质量分数为70%,继续搅拌均匀,放于4℃冰箱中沉淀过夜。4℃,8000r/m in的条件下离心20m in,弃上清液并将沉淀物加无菌水溶解后,4℃透析48h,每隔4h换水1次,再将透析液冷冻干燥,向冻干物中加入100m L蒸馏水,充分溶解,制成丙酸杆菌素溶液。
1.2.7 丙酸杆菌素抑菌活性(AU)的测定[11-14]采用96微孔板分光光度计(酶标仪)快速测定丙酸杆菌素的抑菌活性(AU)。
1.2.7.1 丙酸杆菌素的稀释 取2m L无菌离心管若干,采用2倍梯度稀释法,向各心管中加入750μL的发酵培养基,用移液枪移取750μL的丙酸杆菌素于第一个离心管中,充分混合均匀后移取750μL于第二个离心管中,依次类推至稀释度为2-7。
1.2.7.2 酶标板的制备与测定[15]向酶标板每孔中加入100μL指示菌液,再向各孔分别加入100μL不同稀释浓度的丙酸杆菌素,并以100μL发酵培养基做空白对照。37℃恒温培养12h,用酶标仪测定其OD600nm值。每稀释度做三组平行实验。
1.2.7.3 丙酸杆菌素抑菌活力的计算 将实验组的OD值与对照值进行比较,当实验值为对照值的一半时,将丙酸杆菌素的稀释度记为一个抑菌活性单位(AU)。
2 结果与分析
2.1 紫外(UV)诱变剂量
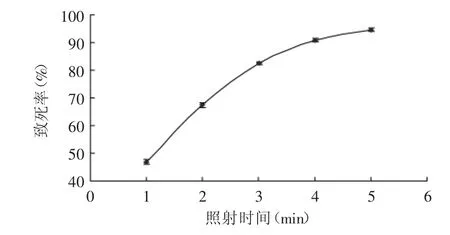
图1 紫外诱变时间对细胞致死率的影响Fig.1 Effect of UVmutagenesis time on themortality rate
采用紫外线照射对出发菌进行不同时间的诱变,照射时间与细胞致死率的关系如图1。由图可知,随着照射时间的延长,致死率逐渐提高,照射3、4、5m in致死率分别为82.51%、90.84%、94.62%。研究表明[16-17],致死率在80%~90%时正突变株较多,致死率在90%~99.9%时负突变株较多[17],故确定最佳紫外(UV)诱变剂量为照射3min。
2.2 亚硝基胍(NTG)诱变剂量

图2 亚硝基胍浓度对细胞致死率的影响Fig.2 Effect of the NTG contenton themortality rate
采用不同浓度的NTG溶液进行诱变,NTG浓度与细胞致死率的关系如图2。由图可知,随着NTG浓度的增加,致死率逐渐提高,浓度为0.8g/L和1.0g/L时致死率分别为86.52%和93.46%。致死率在80%~90%时诱变效果为最佳,故确定亚硝基胍(NTG)的诱变剂量为0.8g/L。
2.3 复合诱变[18]
以丙酸杆菌(Propionibacterium.feudenreichii CS01)为出发菌株,采用上述最佳诱变剂量,经3轮紫外诱变与光复活交替处理,通过酶标仪检测得到9株丙酸杆菌素产量较高的诱变株,编号为U1~U9。原始菌株Y与诱变菌株生产的丙酸杆菌素的抑菌活性见图3。由图3可知原始菌株经紫外诱变后抑菌活性除菌株U2都有明显提高,其中菌株U5和U9抑菌活性最高,达到26.72AU/m L和27.19AU/m L,分别比原始菌株提高了26.4%和28.6%。
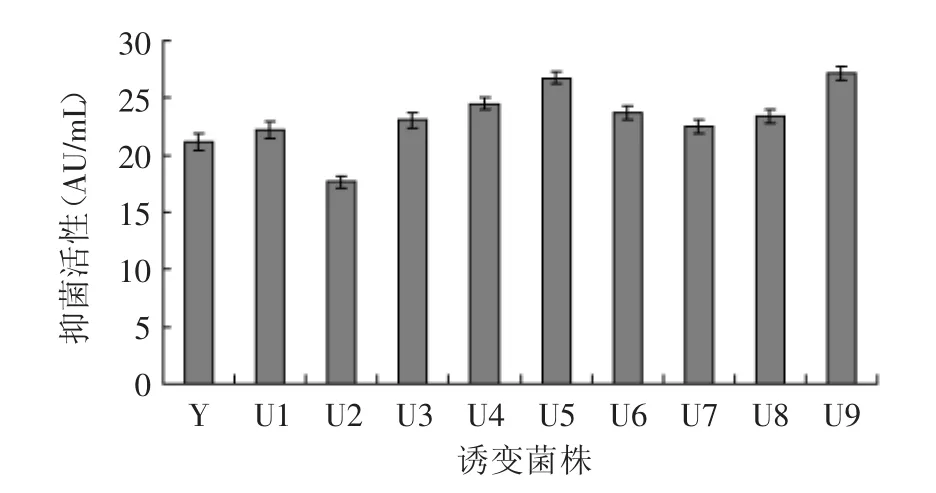
图3 紫外诱变复筛结果Fig.3 The selection ofhigh-bacteriostasisactivitymutantsby UV
以U5和U9为出发菌株进行亚硝基胍(NTG)诱变,获得15株丙酸杆菌素抑菌活性较高的突变株,见图4。由图4可知菌株U5和U9经亚硝基胍诱变后抑菌活性进一步提高,其中菌株N11、N19和N42抑菌活性最高,达到28.63、28.69、28.83AU/m L,分别比原始菌株提高了35.4%、35.7%和36.4%。
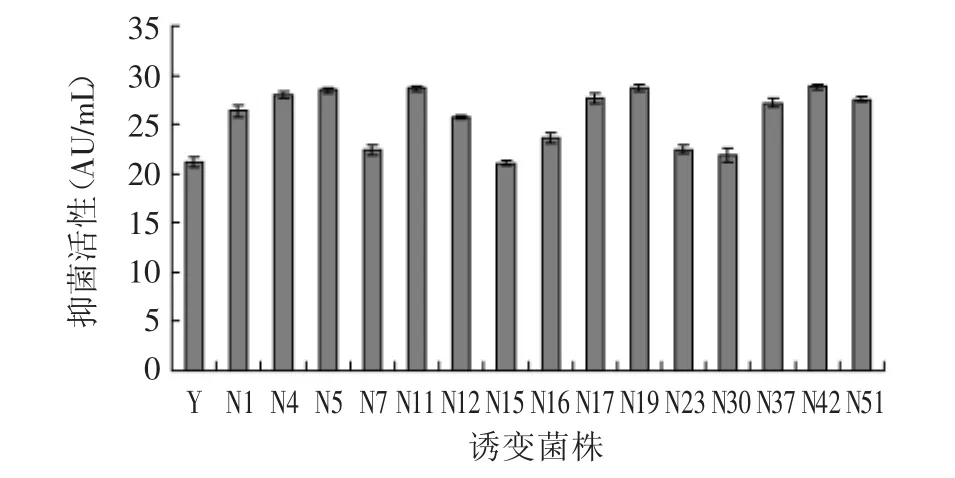
图4 亚硝基胍诱变复筛结果Fig.4 Theselectionofhigh-bacteriostasisactivitymutantsbyNTG
2.4 遗传稳定性
经紫外诱变和亚硝基胍诱变筛选获得5株抑菌活性较高的正向突变株,分别为U5、U9和N11、N19、N42。将这5株菌连续传代5次,检测每代菌株所产丙酸杆菌素的抑菌活力见表1。由表1可以看出,经过传代5次后菌株U5和N11、N42各代所产丙酸杆菌素的抑菌活性变化不大,遗传稳定性良好,菌株U9和N19产生了回复突变。这可能是由于菌株不适应生长条件而影响目标代谢产物的产量,或者外界环境因素引起基因发生自发突变,导致菌种发生退化[19]。

表1 突变菌株的遗传稳定性实验结果Table1 Theexperimental resultsofgenetic stabilityof themutants
3 结论
本文研究了紫外线与亚硝基胍复合处理对丙酸杆菌产丙酸杆菌素抑菌活性的影响,确定复合诱变的条件:紫外(UV)诱变剂量为照射3min,亚硝基胍(NTG)的诱变剂量为0.8g/L。进行3轮紫外(UV)光复活交替诱变和3轮亚硝基胍(NTG)诱变后,得到两株高产菌株N11、N42,抑菌活性达到了28.63、28.83AU/m L,分别比原始出发菌株提高了35.4%和36.4%。将5株诱变菌株U5、U9、N11、N19、N42传代5次,其中N11和N42抑菌活性较高且变化不大,说明突变株不易发生退变,遗传性稳定。
[1]Grinstead D A,Barefoot S F,Jenseniin G.A heatsrable bacteriocin produced by propionibacterium jendennii P127[J]. Applied and EnvironmentalMicrobiology,1992,58:215-220.
[2]Mori H,Sato Y,Taketomo T,et al.Isolation and structural identffication of bifidogenic growth stimulator produced by Propionibactefium freudenreichii[J].Dairy Science,1997,80:1959-1964.
[3]李平兰,江汉湖.细菌素研究概述[J].中国畜产与食品,1998,5(2):82-84.
[4]赖毅东,宁正祥.生物防腐剂—细菌素[J].广东食品工业科技,1999,18(4):54-56.
[5]仪宏,王丽丽,冯惠勇,等.丙酸积累对薛氏丙酸杆菌生长及产酸的影响[J].微生物学通报,2003,30(3):29-30.
[6]王海晶,王玉华,齐斌.响应面法优化产丙酸杆菌素菌株的培养条件[J].中国乳品工业,2011,39(2):13-16.
[7]马悦培,高红亮,常忠义,等.不同初始pH对丙酸杆菌细菌素发酵的影响[J].食品工业科技,2010,31(5):215-217.
[8]吴慧玲,李召虎.物理化学诱变选育冠菌素高产菌株[J].科技导报,2009,27(12):34-37.
[9]苏畅,陈洪,潘仙华.复合诱变选育γ-葵内酯高产菌的研究[J].食品科技,2010,35(10):20-23.
[10]诸葛健,沈微.工业微生物实验与研究技术[M].北京:科学出版社,2007:219.
[11]Helge H,Therese F,Dag A B,etal.Bacteriocins of propionic acid bacteria[J].EPD Science,2002(10):59-68.
[12]Holo H,Nilssen O,Nes I F.Lactococcin A,a new bacteriocin from lactococcus lactis subsp.cremoris:isolation and characterization of the protein and its gene[J].Journal of Bacteriology,1991,173:3879-3887.
[13]Kohji O,Yuhsuke W,Tetsuo U,et al.Catalyst development formethanol synthesisusing parallel reactors for high-throughput screening based on a 96 wellmicroplate system[J].Journal of the Japan Petroleum Institute,2003,46(5):328-334.
[14]荣绍丰,常忠义,高洪亮,等.不同丙酸杆菌代谢物对酵母菌抑菌作用的研究[J].食品工业,2009(1):1-4.
[15]陈默,王志伟,胡长鹰,等.酶标仪法快速评价香兰素的抑菌活性[J].食品与发酵工业,2009,35(5):63-66.
[16]LiY,Frank P,BentleyW E.Conditionedmedium from listeria innocua stimulates emergence from a resting state:nota response to E.Coli quorum sensing autoinducer AI-2[J].Biotechnol Prog,2006,22:387-393.
[17]蒋昵真,吕炜锋,高向东,等.用紫外诱变和离子束注入筛选辅酶Q10高产菌[J].药物生物技术,2006,13(3):207-210.
[18]朱永强,方尚玲,覃敬羽,等.短梗霉多糖菌的复合诱变筛选及培养基优化[J].食品与发酵科技,2010,46(1):47-50.
[19]张克旭,陈宁,张蓓,等.代谢控制发酵[M].北京:中国轻工业出版社,2004:56-57.
Mutation breeding of a high propionicin producing strain
LIU Jing1,WANG Li-mei2,3,QIBin2,3,*
(1.School of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,China;2.School of Biotechnology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China;3.The Key Laboratory of Food and Biotechnology,Changshu 215500,China)
Propionicin is a kind of polypep tides or p roteins p roduced by dairy p ropionibacteria.They can restrain G-bacteria,some G+,fungiand yeast.Propionibacterium feudenreichii CS01 strain was used as original strain. Two mutants N11 and N42 were ob tained after being treated w ith ultraviolet(UV)and nitrosoguanid ine(NTG). The antim ic robialactivity of N11 and N42 high amount strains were 28.63AU/m L and 28.83AU/m L respectively,35.4%and 36.4%more than the originalstrain(21.14AU/m L).
p rop ionicin;UV;NTG;mutagenesis
TS252.1
A
1002-0306(2012)09-0187-03
2011-07-14 *通讯联系人
刘靖(1983-),女,研究生,研究方向:食品生物技术。
江苏省“六大人才高峰”项目。
