烷基咪唑离子液体定量分析方法的探讨
2012-10-25林燕玲
林燕玲
烷基咪唑离子液体定量分析方法的探讨
林燕玲
(厦门医学高等专科学校,福建,厦门 361000)
不同链长烷基的咪唑离子液体与茜素红反应前后荧光强度的变化不同。茜素红作为受体,咪唑类离子液体作给电子体,应用荧光猝灭法测定反应前后荧光强度的变化。分别做不同链长烷基离子液体的荧光光谱,定量地分析样品中离子液体的含量。
荧光猝灭;离子液体;咪唑;茜素红
以季铵盐离子、季鏻盐离子、咪唑盐离子和吡咯盐离子等为代表的离子液体是新型的“绿色溶剂”,它们具有无味、无恶臭、不易燃、易与产物分离、易回收、可反复多次循环使用等优点,是传统挥发性溶剂的理想替代品,在许多领域得到了广泛应用并迅速发展成为热点[1-3]。然而随着研究的进行,人们发现离子液体对生物体具有毒性。有些离子液体会减慢生物的运动速率、摄食速率,削弱细胞组织功能。有研究表明,离子液体的毒性主要取决于阳离子,其毒性顺序为季铵盐< 吡啶< 咪唑< 三唑< 四唑,且侧链取代基链长与毒性成正比。另外离子液体的潜在危害还表现在它的难降解性。研究表明,烷基取代咪唑类化合物生物降解性很差[4-5]。因此,建立烷基取代咪唑类离子液体的定量检测方法有助于对其毒性的研究。烷基取代咪唑类化合物能与荧光物质茜素红生成荷移络合物,即咪唑类化合物作为给电子体与电子受体试剂茜素红形成荷移络合物,从而改变茜素红的荧光性质,使茜素红溶液的荧光发生猝灭现象。根据荧光变化情况,可建立起烷基取代咪唑类化合物定量分析的方法。
1 实验方法
1.1 仪器和试剂
赛多利斯 PB-10酸度计(北京赛多利斯仪器系统有限公司);BS224S电子分析天平(北京赛多利斯仪器系统有限公司);荧光分光光度计(日本岛津仪器有限公司);10 mL容量瓶20个氢氧化钠(分析纯,天津化学试剂一厂);1-十八烷基-3-甲基咪唑氯(C18MIMCl);1-十六烷基-3-甲基咪唑氯(C16MIMCl);1-十二烷基-3-甲基咪唑氯(C12MIMCl);1-辛基-3-甲基咪唑氯(C8MIMCl);1-甲基-3-丁基咪唑溴;1-甲基-3-乙基咪唑溴(分析纯,杭州科默化学有限公司);咪唑;2-甲基咪唑;茜素红(分析纯,中国医药集团上海化学试剂公司);磷酸;硼酸;冰乙酸;乙醇;实验用水为高纯水。
1.2 实验条件的选择
1.2.1 激发和发射波长
固定茜素红溶液的pH为7.24,测定其荧光光谱。从波长扫描结果可知,茜素红的最大激发波长为462 nm,最大发射波长为610 nm。当在茜素红缓冲溶液体系中加入不同浓度的离子液体,随着其浓度的增加,茜素红的荧光强度呈现不同的趋势。但发射峰位和峰形都基本不变。
2.2.2 缓冲溶液和pH
缓冲溶液选用B-R缓冲液。B-R缓冲液的配制方法如下:在100 mL磷酸、冰乙酸、硼酸三酸混合液(磷酸、乙酸、硼酸浓度均是0.04 mol/L)中加入不同体积的0.2 mol/L的NaOH溶液,即可得到不同pH值的B-R缓冲溶液。
pH的选择:固定茜素红(ARS)的浓度(10-4mol/L),分别溶于PH为4.1,4.78,6.37,7.24,8.36的缓冲溶液(3 mL)中,并测量其荧光强度,结果如图1所示(图中pH分别为4.1,4.78,6.37,7.24,8.36,C(ARS) = 10-4mol/L)。为保证反应前的茜素红溶液具有较大的荧光强度,提高猝灭反应的灵敏度,本实验采用pH = 7.24的缓冲溶液。

图1 pH对ARS荧光强度的影响,
1.2.3 反应时间
将10-4mol/L的茜素红与0.6×10-4mol/L的C18MIMCl以1:1混合,加3 mLpH = 7.24的缓冲溶液,测量荧光强度随时间变化,结果如图2所示。说明溶液混合10 min以后,反应时间对荧光强度的影响就已经很微弱。
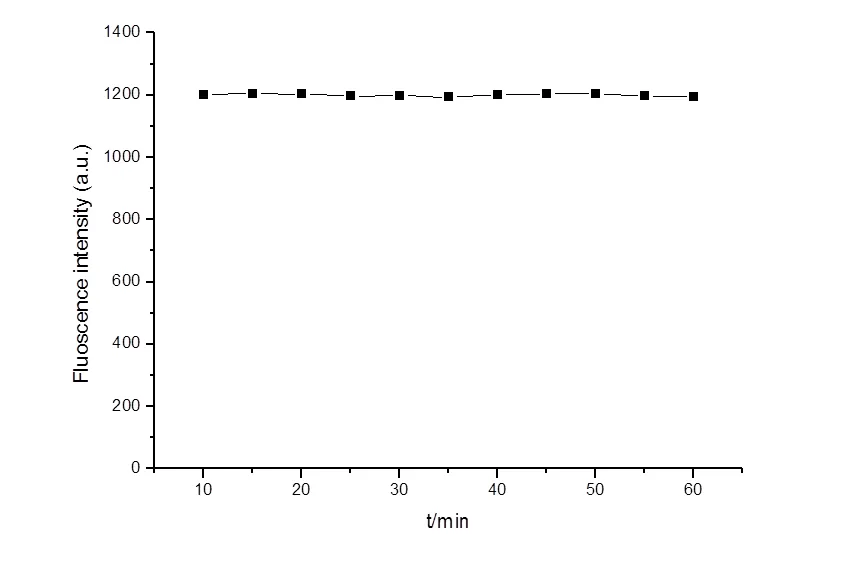
图2 荧光强度随反应时间的变化
1.3 荧光测定
实验表明,对于烷基链长度不同的咪唑盐离子液体,其荧光猝灭的程度和方式有很大的不同。通过对不同猝灭现象的研究,确定咪唑盐离子液体灵敏快捷的定量方法。反应为:

1.3.1 十八烷基咪唑盐
取15个10 mL容量瓶,固定茜素红浓度为10-4mol/L,B-R缓冲液量为2 mL,依次加入C18MIMCl,使其浓度分别为0.00,0.08,0.16,0.24,0.32,0.40,0.48,0.56,0.64,0.72,0.80,0.88,0.96,1.04,1.12 (单位:10-4mol/L),用纯化水定容。溶液的颜色随C18MIMCl的浓度增加而变化,从橙黄到紫红再到深紫色。10 min后,依次测试其荧光强度,如图3。图中离子液体的浓度从上到下依次为0.00,0.08,0.16,0.24,0.32,0.40,0.48,0.56,0.64,0.72,0.80,0.88,0.96,1.04,1.12 (单位:10-4mol/L)。

图3 加入不同浓度的C18MIMCl后茜素红的荧光发射光谱
以测定的最大荧光强度为纵坐标,以加入的C18MIMCl的浓度为横坐标,作C18MIMCl的标准曲线,如图4所示。可以看出,当茜素红浓度为10-4mol/L时,C18MIMCl的浓度在0 × 10-4~1.2×10-4mol/L时,荧光强度与C18MIMCl浓度成反比,线性方程为:= -1584.9+2039.5,2= 0.997,检出限为6.3×10-8mol/L。因此,可通过测量茜素红荧光猝灭来测定溶液中的十八烷基咪唑盐浓度。

图4 十八烷基咪唑盐的标准工作曲线
1.3.2 十六烷基咪唑盐
取17个10 mL容量瓶,固定茜素红浓度为10-4mol/L,B-R缓冲液量为2 mL,依次加入C16MIMCl,使其浓度分别为0.00,0.08,0.16,0.24,0.32,0.40,0.48,0.56,0.64,0.72,0.80,0.88,0.96,1.04,1.12 ,1.20,1.28(单位:10-4mol/L),用纯化水定容。溶液的颜色随C16MIMCl浓度增加而变化,从橙黄到紫红再到深紫色。10 min后,依次测试其荧光强度,以测定的最大荧光强度为纵坐标,以加入的C16MIMCl的浓度为横坐标,作C16MIMCl的标准曲线,如图5所示。可以看出,当茜素红浓度为10-4mol/L时,C18MIMCl的浓度在0~1.2 × 10-4mol/L时,荧光强度与C18MIMCl浓度成反比,线性方程为:= -1556.5+2140.6,2=0.9983,检出限为3.5×10-8mol/L。因此,也通过测量茜素红荧光猝灭来测定溶液中的十六烷基咪唑盐浓度。

图5 十六烷基咪唑盐的标准工作曲线
1.3.3 十二烷基咪唑盐
取13个10 mL容量瓶,固定茜素红浓度为10-4mol/L,B-R缓冲液量为2 mL,依次加入C12MIMCl,使其浓度分别为0.00,0.40,0.80,1.20,1.60,2.00,3.00,4.00,5.00,6.00,7.00,8.00,9.00,10.0(单位:10-4mol/L)。当C12MIMCl浓度较小时,溶液颜色随浓度的变化很小,在很大范围内都为棕黄色。当C12MIMC浓度较大时才开始变红到浅紫色。10 min后,依次测试其荧光强度,如图6。图中离子液体的浓度从上到下依次为0.00,0.40,0.80,1.20,1.60,2.00,3.00,4.00,5.00,6.00,7.00,8.00,9.00,10.0 (单位:10-4mol/L)。
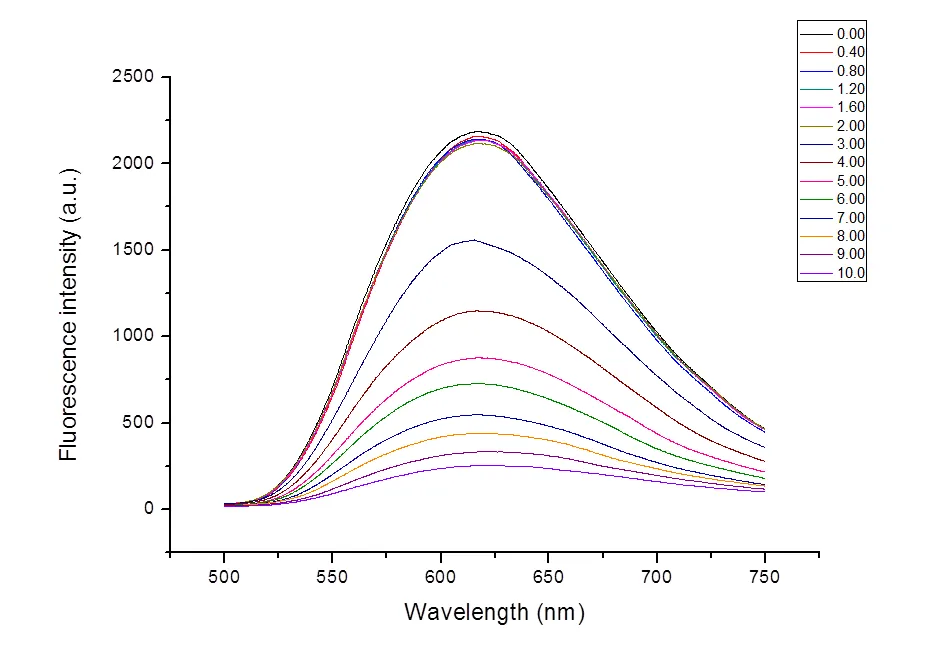
图6 加入不同浓度的C12MIMCl后茜素红的荧光发射光谱
以测定的最大荧光强度为纵坐标,以加入的C12MIMCl的浓度为横坐标,作C12MIMCl的标准曲线,如图7所示。可以看出,当茜素红浓度为10-4mol/L,C12MIMCl的浓度小于2 × 10-4时,荧光强度基本不变。然后随着离子液浓度继续增加,茜素红的荧光强度下降,坡度先急后缓。

图7 十二烷基咪唑盐的标准工作曲线
1.3.4 辛基咪唑盐
取16个10 mL容量瓶,固定茜素红浓度为10-4mol/L,B-R缓冲液量为2 mL,依次加入C8MIMCl,使其浓度分别为0.00,1.00,2.00,3.00,4.00,5.00,6.00,7.00,8.00,9.00,10.0,11.0,12.0,13.0,14.0,15.0(单位:10-4mol/L)。溶液颜色均为棕黄色,无变化。10 min后,依次测试其荧光强度,如图8。结果表明,辛基咪唑盐对茜素红的荧光强度基本无影响。
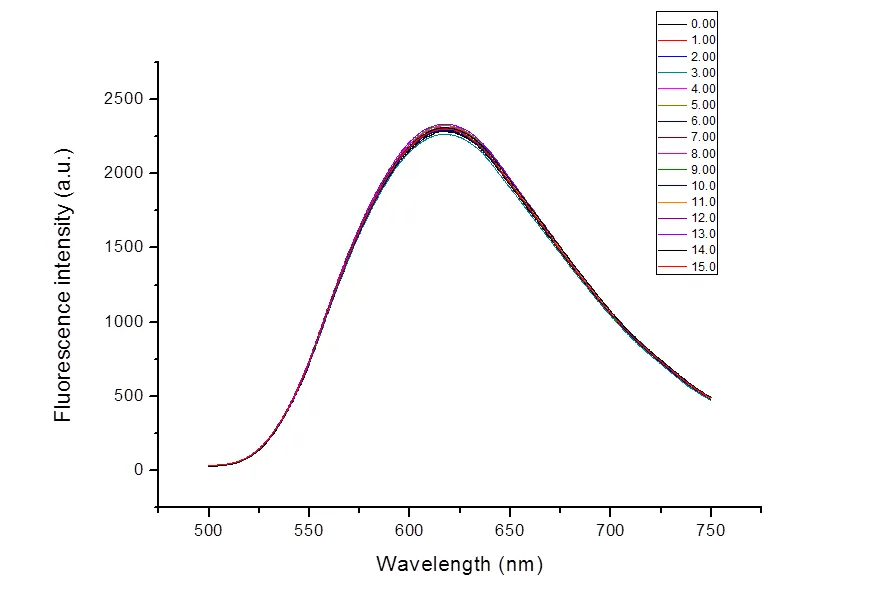
图8 加入不同浓度的C8MIMCl后茜素红的荧光发射光谱
用同样的方法比较了丁基咪唑盐、乙基咪唑盐、2-甲基咪唑、咪唑等化合物对茜素红荧光强度的影响,结果表明,它们对茜素红的荧光强度基本无影响,即不具有猝灭作用。
2 结论
从上述实验结果可以得出:茜素红的荧光猝灭现象与咪唑盐离子液体的烷基链长有很明显的关系:当烷基链较长时,荧光猝灭现象明显,如十八和十六烷基咪唑盐;随着烷基链长度的减少,荧光猝灭的效果逐渐变弱,如十二烷基咪唑盐猝灭现象不规律且稍弱;当烷基链较短时,基本没有荧光猝灭的现象发生,如辛基咪唑盐及以下烷基咪唑盐基本无荧光猝灭现象。这是因为烷基链越长,给电子能力越强,它的荷移作用越明显。而咪唑与2-甲基咪唑则根本不会发生荷移反应。对于C18MIMCl和C16MIMCl来说,其对茜素红荧光强度的影响与其加入的浓度有较好的线性关系。因此,可用茜素红作为荷移试剂来标定样品中C18MIMCl和C16MIMCl这两种物质的含量,即可以采用荧光猝灭法作为长链取代基的咪唑盐离子液体的定量方法。
[1] 明慧,吴坚平,杨立荣.离子液体及其在生物催化中的应用[J].有机化学,2005,25(4):364-374.
[2] Seddon K R J.Ionic lNllids for clean tedmology[J].Chem Biotechnol,1997,68:351-356.
[3] 李肖华,李卫坤,宋旭东,等.离子液体的合成及在分离中的应用[J].浙江化工,2008,39(2):6-8.
[4] 范杰平,曹婧,孔涛,等.离子液体的合成、纯化及回收方法研究进展[J].南昌大学学报:工科版,2008,31(4):21-25.
[5] 陈彬. 荷移反应的研究及应用和荧光分光光度法在生化及药物分析中的应用研究[D]. 郑州:郑州大学, 2001:1-4
[6] 李省云. 药物分析—荷移光谱法[M]. 北京:化学工业出版社, 2008.
[7] 许金钩. 荧光分析法[M]. 3版.北京:科学出版社, 2006.
DISCUSSION OF QUANTITY METHODS OF THE ALKYL IMIDAZOLE IONIC LIQUID
LIN Yan-ling
( Xiamen Medical College, Xia’men, Fujian 361000, China )
Fluorescence intensity varies when alizarin red interacts with alkyl imidazole ionic liquids with different alkyl chain length. Alizarin red as an electron acceptor, imidazole ionic liquid as an electron donor, the change of fluorescence intensity before and after reaction was measured by fluorescence quenching method. Based on the fluorescent spectrogram of different imidazole ionic liquid, the quality and quantity of ionic liquid could be studied.
fluorescence quenching method; ionic liquid; imidazole; alizarin red
O655.2
A
10.3969/j.issn.1674-8085.2012.06.008
1674-8085(2012)06-0032-04
2012-07-12;
2012-09-28
林燕玲(1960-),女,福建泉州人,高级讲师,主要从事基础化学研究(E-mail: 995308559@qq.com).
