枸杞多糖提取物对顺铂诱发大鼠肾毒性的影响
2012-10-25张海莲高丽萍冷洪涛
张海莲,高丽萍*,冷洪涛,李 贞
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
枸杞多糖提取物对顺铂诱发大鼠肾毒性的影响
张海莲,高丽萍*,冷洪涛,李 贞
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
目的:观察枸杞多糖(LBP)对顺铂所致肾毒性的防护作用,并初步探讨其作用机制。方法:将50只大鼠随机分为空白对照组、顺铂(CDDP)模型组、LBP低、中、高剂量组(277、554、1008g/(kg·d))(以体质量计)。空白对照组和CDDP组每天灌胃蒸馏水,LBP组每天灌胃LBP,每日1次,灌胃10d后,空白对照组腹腔注射生理盐水,其余各组一次性腹腔注射CDDP 7.0mg/kg建立肾损伤动物模型,之后继续灌胃5d。腹腔注射后第5天宰杀大鼠,检测大鼠血清尿素氮(BUN)、肌酐(Scr)的含量、肾组织中一氧化氮(NO)、丙二醛(MDA)含量和一氧化氮合酶(NOS)、超氧化物歧化酶(SOD)活性。结果:给予LBP可显著降低CDDP引起的BUN、Scr、MDA水平升高(P<0.05或P<0.01);并能降低CDDP导致的NO含量和NOS活性的升高(P<0.05或P<0.01)。结论:LBP经口给予能减轻CDDP所致的肾损伤,其机制可能与其降低NOS活性和MDA、NO含量有关。
顺铂;枸杞多糖;肾毒性;一氧化氮;丙二醛;一氧化氮合酶;超氧化物歧化酶
顺铂(CDDP)是一种广泛应用的抗癌药物。临床研究表明,CDDP抗癌作用强,与其他抗肿瘤药物无交叉抗药性,在多种恶性肿瘤的治疗中取得了显著的疗效[1-2],是目前较有希望的一种抗癌药物。但CDDP有广泛的毒性,特别是严重的肾毒性,限制了它在临床上的应用[3]。目前,CDDP所致肾毒性的确切机制尚不十分清楚,研究表明CDDP诱发肾毒性是一个复杂的过程,大致可分为3种主要的病理改变:细胞毒、炎症和纤维增生[4]。活性氧是CDDP诱发急性肾损伤的主要原因[4]。目前,许多学者致力于减轻CDDP肾毒性的研究,但迄今为止在临床上可应用的药物甚少。多糖具有清除自由基、提高抗氧化酶活性和抑制脂质过氧化的活性,从而起到保护生物膜和延缓衰老的作用。近年来,枸杞及其相关产品的开发已成为研究焦点[5]。枸杞子是传统的名贵中药材又是食品,枸杞多糖(L y c i u m b a r b a r u mpolysaccharides,LBP)是枸杞中的主要功能活性成分,现代医学研究表明,枸杞具有抗氧化、抗衰老、免疫调节、降血糖、降血脂、抑制肿瘤生长和细胞突变等[6-11]药理作用,LBP对CDDP诱发肾毒性的影响尚未见报道,本实验采用CDDP诱发大鼠肾损伤,通过观察大鼠血清尿素氮(BUN)、肌酐(Scr)、肾组织一氧化氮(NO)、丙二醛(MDA)含量、一氧化氮合酶(NOS)、超氧化物歧化酶(SOD)活性变化,研究LBP对CDDP所致肾毒性的保护作用,并初步探讨其作用机制。
1 材料与方法
1.1 实验动物、试剂与仪器
成年健康雄性SD大鼠50只(SPF级),体质量140~160g,由军事科学院实验动物中心提供。
顺铂(CDDP),批号001001DF,注射用冻干型粉剂,每支10mg,山东齐鲁制药厂生产,用时用生理盐水配制;枸杞多糖(LBP,纯度30%) 上海康舟真菌多糖有限公司(批号20100607),用时用双蒸水稀释;考马斯亮蓝蛋白测试盒、NO、NOS、SOD、MDA试剂盒南京建成生物工程研究所。
TDL-5-A型常温低速台式离心机 上海安亭科学仪器厂;5840R型低温高速离心机 德国Eppendrof公司;HH·S1-Ni型电热恒温水浴锅 北京长安科学仪器厂;MQx-200型微孔板分光光度计 基因有限公司;Selectra-E-Plus型金自动生化分析仪 荷兰威图科技公司。
1.2 实验设计
大鼠用普通饲料适应性饲养4d后,称体质量后随机分为5组,即空白对照组,CDDP模型组,LBP低、中、高剂量组,每组10只。
空白对照组和CDDP模型组每天灌胃蒸馏水1mL,LBP低、中、高剂量组((277、554、1008g/(kg·d))(以体质量计)每天灌胃相应剂量的LBP水溶液(约1mL)[12],连续15d,第10天时CDDP模型组和LBP组一次性腹腔注射CDDP 7.0mg/kg(以体质量计)可以引起肾毒性[13],建立肾损伤动物模型。空白对照组注射等量的生理盐水。每天定时给与饲料并称质量,每2d换一次饮用水,每7d换一次垫料,每2d记录各组大鼠的体质量和LBP配制溶液的量。
1.3 指标测定
注射CDDP 5d后处死大鼠,股动脉取血,用全自动生化分析仪测检测血清尿素氮(BUN)和肌酐(Scr)的含量,取血后颈椎脱臼处死大鼠,冰浴状态下剖腹取双侧肾脏,去被膜并称肾质量,计算肾脏系数(用肾质量/体质量比值表示),肾脏系数以每100g体质量对应肾脏质量表示。将肾脏组织放入10mL的小烧杯内,用生理盐水将其制成10%组织匀浆,3000r/min,4℃离心15~20min,取上清液按试剂盒说明书测蛋白质含量、MDA含量、SOD活性、NO含量和NOS活性。
1.4 数据统计
2 结果与分析
2.1 实验大鼠一般变化
表1 给予顺铂前后各组大鼠体质量的变化(±s,n=50)Table 1 Body weight changes in rats before and after cisplatin injection(±s,n=50)
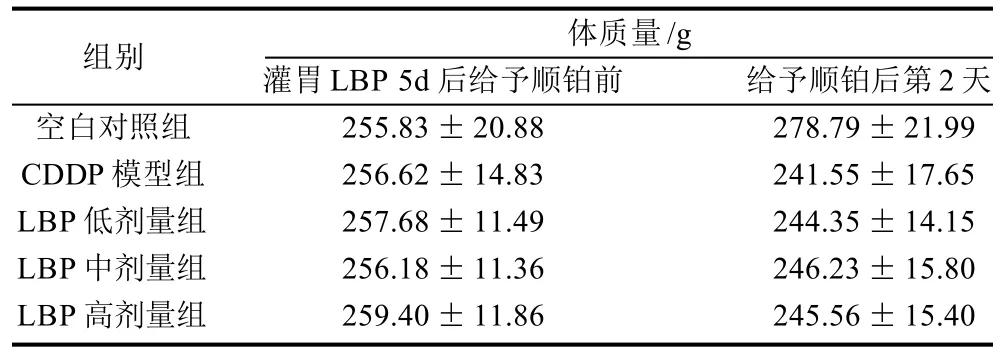
表1 给予顺铂前后各组大鼠体质量的变化(±s,n=50)Table 1 Body weight changes in rats before and after cisplatin injection(±s,n=50)
组别 体质量/g灌胃LBP 5d后给予顺铂前 给予顺铂后第2天空白对照组 255.83±20.88 278.79±21.99 CDDP模型组 256.62±14.83 241.55±17.65 LBP低剂量组 257.68±11.49 244.35±14.15 LBP中剂量组 256.18±11.36 246.23±15.80 LBP高剂量组 259.40±11.86 245.56±15.40
从表1可以看出,注射CDDP前实验组大鼠与空白对照组相似,皮毛光滑,活泼好动,每天鼠料消耗量基本恒定,体质量均稳定增长。注射CDDP后,模型组大鼠皮毛蓬乱、发黄、无光泽,鼠料消耗量明显减少,体质量逐渐下降。LBP组大鼠上述现象较模型组减轻。
2.2 LBP对CDDP所致急性肾损伤大鼠肾脏系数、血清BUN和Scr含量的影响
表2 LBP和CDDP对大鼠肾脏系数、血清BUN和Scr含量的影响(±s,n=50)Table 2 Effect of LBP and cisplatin on kidney coefficient and serum BUN and Scr levels in rats (±s,n=50)

表2 LBP和CDDP对大鼠肾脏系数、血清BUN和Scr含量的影响(±s,n=50)Table 2 Effect of LBP and cisplatin on kidney coefficient and serum BUN and Scr levels in rats (±s,n=50)
注:*.与空白对照组相比,有显著性差异(P<0.05);**.与空白对照组相比,有极显著差异(P<0.01);Δ.与CDDP模型组相比,有显著性差异(P<0.05);ΔΔ.与CDDP模型组相比,有极显著差异(P<0.01)。下同。
组别 肾脏系数 BUN含量/(mmol/L) Scr含量/(mmol/L)空白对照组 0.84±0.06 8.22±0.77 53.13±7.06 CDDP模型组 1.05±0.10** 71.21±8.88** 323.50±68.17**LBP低剂量组 1.03±0.08** 56.33±11.07** 259.64±78.74**LBP中剂量组 1.08±0.06** 60.05±10.38** 276.85±88.71**LBP高剂量组 1.00±0.08** 55.66±10.31**Δ 267.17±62.60**Δ
由表2可知,与空白对照组相比,CDDP模型组大鼠肾脏系数、血清BUN和Scr含量极显著升高(P<0.01)。LBP各剂量组与CDDP模型组相比,高剂量组的血清BUN及Scr含量显著降低(P<0.05),肾脏系数无显著性差异性;中、低剂量组大鼠肾脏系数、血清BUN和Scr含量与CDDP模型组差异均无显著性。
2.3 LBP对CDDP所致急性肾损伤大鼠肾皮质中NO和MDA含量及SOD、NOS活性的影响
表3 各组大鼠肾皮质中NO、MDA含量及SOD和NOS的活性(±s,n=50)Table 3 NO and MDA levels and SOD and NOS activities in renal cortex of rats (±s,n=50)

表3 各组大鼠肾皮质中NO、MDA含量及SOD和NOS的活性(±s,n=50)Table 3 NO and MDA levels and SOD and NOS activities in renal cortex of rats (±s,n=50)
组别NO含量/(μmol/g pro)NOS活性/(U/g pro)SOD活性/(U/g pro)MDA含量/(nmol/g pro)空白对照组 12.30±1.15 2.29±1.04 213.46±13.65 4.95±0.43 CDDP模型组 17.14±2.80** 7.37±1.62** 200.68±27.44 7.05±0.53**LBP低剂量组 14.13±1.61 5.14±1.26**Δ 211.71±18.74 6.22±0.80**ΔΔ LBP中剂量组 13.48±2.08Δ 4.96±1.08**Δ 211.96±17.01 6.12±0.56**ΔΔ LBP高剂量组 13.08±0.93Δ 4.73±1.03**ΔΔ 212.61±17.64 5.99±0.57*ΔΔ
由表3可见,与空白对照组相比,CDDP致大鼠肾损伤模型组中,NO和MDA含量、NOS活性明显升高(P<0.01)。与CDDP模型组相比,LBP各剂量组中MDA含量极显著性降低(P<0.01);LBP高剂量组大鼠NO含量显著升高(P<0.05),NOS活性极显著升高(P<0.01),SOD活性升高,但不具有显著性差异;LBP中、低剂量组NOS活性显著降低(P<0.05),LBP低剂量组 NO含量、SOD活性均无显著性差异。
3 讨 论
CDDP肾毒性的表现形式多种多样,包括从可逆的急性肾功能损伤到伴有显著肾组织学改变的不可逆的慢性肾功能衰竭。它对肾脏的不同部位都可损伤,可引起肾小管、肾小球的功能和形态学的改变;肾小管,特别是近曲小管和集合管是CDDP肾损伤的主要靶位,发生肾毒性时,血清BUN变化最为敏锐,多在用药后1~3周内出现,肾脏病理改变程度与BUN相符。本实验结果也表明:注射CDDP后第5天,模型组大鼠血清BUN、Scr含量较正常对照组显著升高,提示7mg/kg CDDP诱发大鼠明显的肾损伤。
CDDP精确的肾细胞毒性机理仍不明,大量研究[14-15]表明,CDDP所致肾损害与氧化应激有关,表现在CDDP诱发肾损害的同时可引起脂质过氧化产物(如MDA等)含量增多,抗氧化酶(如SOD等)活性下降。MDA是脂质过氧化反应的产物之一,组织中 MDA含量可反映脂质过氧化的程度,并间接反映该组织损伤情况。脂质是生物膜的主要成分,当自由基与活性氧攻击生物膜时,对生物膜易造成过氧化损害,同时产生脂质过氧化产物MDA。生物膜的过氧化损伤会导致其通透性增加、流动性下降、膜蛋白功能异常等变化,影响和破坏生物膜正常的生理功能,从而对细胞造成损伤。
脂质过氧化物与CDDP的肾毒性有关,这个抗癌药物的单一剂量已经被报道过[16]。Kruidering等[17]研究表明CDDP的毒性与脂质过氧化作用没有直接的关系,抗氧化剂也许是通过减少炎症反应和损伤组织中活性氧的释放来缓解肾毒性。因此,炎性细胞浸润或许增加了肾脏中活性氧的产生,这将导致广泛的脂质过氧化肾损伤。本研究数据显示给予大鼠7mg/kg CDDP后的第5天,MDA含量明显升高,表明CDDP诱发肾皮质细胞氧自由基产生增加,造成肾组织细胞损伤。
王黎等[18]提出肾皮质SOD与血清Scr、BUN含量呈负相关。SOD是人体内最重要的自由基清除剂,其活性的降低反映了自由基生成的增多及巯基(-SH)的耗竭。CDDP可诱发肾脏SOD活性降低,这可能是因为CDDP可导致肾脏组织细胞的Cu、Zn离子丢失,而Cu离子、Zn离子是SOD发挥作用所需要的金属离子[19]。或是CDDP直接与SOD活力点巯基基团结合所致[20],SOD活性的下降使组织不能有效地清除代谢产生的自由基,脂质化反应增强。也可能是CDDP诱发产生大量自由基,超出肾组织抗氧化系统的代谢能力后,大量消耗细胞内的抗氧化物,并攻击生物大分子,导致脂质和蛋白质的氧化损伤及酶活性的降低[21]。但也有研究表明[22],CDDP并没有引起SOD活性下降,反而略有升高,CDDP导致肾脏的抗氧化系统出现代偿性的应激反应。自由基是氧化酶的底物,自由基浓度的升高可正反馈引起其代谢酶活性的增强。因此,SOD活性的升高,预示着肾组织内产生了大量的超氧阴离子自由基和羟自由基。本研究结果表明,给予大鼠7mg/kg CDDP后的第5天,SOD活性下降,但与空白对照组没有显著性差异。提示CDDP诱发SOD活性的变化是一个复杂的过程,本研究SOD活性与对照组没有显著性差异原因有待进一步探讨。
大量的研究表明,NO在调节氧化应激与组织损伤过程中起重要作用,Peresleni等[23]证明对上皮细胞氧化应激引起NOS产生增加,从而导致NO释放、亚硝酸盐产生增加、细胞的生存能力降低。自由基引起NOS产生的机制还不清楚,NO的细胞毒性作用依赖于细胞的氧化还原状态及产生超氧化亚硝基阴离子(ONOO-)的能力。据报道[24],NO并不直接造成组织损害,而是与超氧化物阴离子(O2-)反应生成超氧亚硝基阴离子(ONOO-),后者可分解产生羟自由基(·OH)而产生毒性。NO与O2-反应的速率比SOD清除的速率快得多,所以NO可与SOD竞争O2-,与O2-反应生成ONOO-。ONOO-还可通过使蛋白中的酪氨酸硝基化,抑制SOD活性[25],以致经SOD清除得极少,而使更多的O2-与NO反应,生成大量ONOO-,后者又可继续抑制SOD活性,以致形成恶性循环。体外研究已表明,外源性NO能抑制SOD和过氧化氢酶(CAT)的活性,并引起明显的脂质过氧化形成[26]。目前,NO在环孢菌素A诱发急性肾衰中作用的文献报道较多[27],但在CDDP诱发急性肾衰过程中的研究很少。本研究结果表明,在注射CDDP后的第5天肾皮质NOS与NO的含量明显高于空白对照组,推测NOS的产生可能是由于氧化应激反应中自由基引起的。NO S产生增加,引起NO释放,导致肾脏病理损伤,NOS、NO含量变化与血清BUN、Scr变化完全一致,因此,在CDDP诱发肾衰过程中,NO起着很重要的作用。
枸杞是我国传统保健良药,还是营养增补剂(功能食品),具有滋补肝肾等多方面的药理作用和生物活性功能[28]。一般认为枸杞子的抗氧化作用主要与其所含枸杞多糖等活性成分有关。本研究结果显示,1008mg/kg LBP组大鼠肾皮质NO含量、NOS活性、MDA含量及血清BUN及Scr含量均明显低于CDDP模型组,277mg/kg LBP和554mg/kg LBP对CDDP所致肾毒性也有防护作用,但抗氧化作用不明显。LBP的抗氧化性呈现一定的剂量-反应关系。实验表明,1008mg/kg LBP可明显减轻CDDP诱导的肾损伤,其作用主要是通过抑制NOS活性从而降低肾组织NO含量,减少肾组织氧自由基的产生而实现的。
[1] WANG Dian, LIPPARD S J. Cellular processing of platinum anticancer drugs[J]. Nat Rev Drug Discov, 2005, 4: 307-320 .
[2] PABLA N, DONG Zhou. Cisplatin nephrotoxicity: mechanisms and nenoprotective strategies[J]. Kidney Int, 2008, 73: 994-1007.
[3] KUHLMANN M K, BURKHARDT G, KOHLER H. Insights into potential cellular mechanisms of cisplatin nephrotoxicity and their clinical application[J]. Nephrology Dialysis Transplantation, 1997, 12: 2478-2480.
[4] TAGUCHI T, NAZNEEN A, ABID M R, et al. Cisplatin-associated nephrotoxicity and pathological events[J]. Contrib Nephrol, 2005, 148:107-121.
[5] 郑哲君, 李德远. 枸杞子、枸杞多糖抗疲劳作用的研究进展[J]. 中国营养与科学, 2008(12): 53-54.
[6] HAO Wu, GUO Hongwei, ZHAO Rui. Effects ofLycium barbarrumpolysaccharide on the improvement of antioxidant and DNA damage in NIDDM rats[J]. Yakugaku Zasshi, 2006, 126(5): 365-369.
[7] 李晶, 欧芹, 孙洁. 枸杞多糖对衰老大鼠蛋白质氧化损伤影响的实验研究[J]. 中国老年学杂志, 2007, 27(12): 2384-2385.
[8] 宋锦苹, 张洪玉, 曲丽娜, 等. 柘木多糖和枸杞多糖对尾吊小鼠免疫功能的防护效应[J]. 航天医学与医学工程, 2007, 20(6): 402-405.
[9] 孙桂菊, 张勇, 黄杰, 等. 枸杞多糖对Ⅱ型糖尿病大鼠肾脏保护作用及其机制研究[J]. 营养学报, 2006, 28(1): 47-50.
[10] 马灵筠, 孙海双, 陈群力, 等. 枸杞多糖对动脉粥样硬化内皮细胞功能及炎症反应的影响[J]. 江苏中医药, 2006, 27(5): 61-63.
[11] 甘璐, 张声华. 枸杞多糖的抗肿瘤活性和对免疫功能的影响[J]. 营养学报, 2003, 25(2): 200-202.
[12] XIN Yanfei, WAN Lili, PENG Jinliang. Alleviation of the acute doxorubicin-induced cardiotoxicity byLycium barbarrumpolysaccharides through the suppression of oxidative stress[J]. Food and Chemical Toxicology, 2011, 49: 259-264.
[13] SIBEL S, OGUZ E, MURAT K. The protective effect of royal jelly against cisplatin-induced renal oxidative stress in rats[J]. World J Urol,2011, 29: 127-132.
[14] SUGIHARA K, NAKANO S, GEMBA M. Effect of cisplatin onin vitroproduct ion of lipid peroxides in rat kidney cortex[J]. Japan J Pharmacol,1987, 44: 71-76.
[15] ZHANG Jiagang, ZHONG Lifen, ZHANG Mei, et al. Protection effects of procaine on oxidative stress and toxicities of renal cortical slices from rats caused by cisplatinin vitro[J]. Arch Toxicol, 1992, 66: 354-358.
[16] AYDINOZ S, UZUN G, CERMIK H, et al. Effects of different doses of hyperbaric oxygen on cisplatin-induced nephrotoxicity[J]. Ren Fail,2007, 29: 257-263.
[17] KRUIDERING M, WALTER B V, HEER E, et al. Cisplatin-induced nephrotoxicity in porcine proximal tubular cells: mitochondrial dysfunction by inhibition of complexes Ⅰ to Ⅳ of the respiratory chain[J]. J Pharmacol Exp Ther, 1997, 280: 638-649.
[18] 王黎, 杨红梅, 裴瑞, 等. 顺铂致大鼠肾功能衰竭时肾皮质脂质过氧化的变化[J]. 河南职工医学院学报, 2003, 15(2): 15-18.
[19] SHARMA R P. Interactions of cisplatin with cellular zinc and copper in liver and kidney tissues[J]. Pharmacological Research Communications,1985, 17: 197-206.
[20] ZHANG J G, ZHONG L F, ZHANG M. Protection effects of procaine on oxidative stress and toxicities of renal cortical slices from rats caused by cisplatinin vitro[J]. Arch Toxieol, 1992, 66: 354-358.
[21] HUSAIN K, MORRS C, WHITWORTH C. 4-Me-thylthiobenzoie acid protection against cisplatin nephrotoxicity: antioxidant system[J]. Fundam Appl Toxicol, 1996, 32: 278-284.
[22] 廖英俊, 汤浩, 金亚平. 抗癌药顺铂对小鼠的耳、肾和肝毒性及其机制的研究[J]. 中国药理学通报, 2004, 320(1): 82-85.
[23] PERESLENI T, NOIRI E, BAHOU W F, et al. Antisense oligodeoxy nucleotides to inducible NO synthase rescue epithelial cells from oxidative stress injury[J]. Am J Physiol, 1996, 270(62): F971-F977.
[24]SARAN M, MICHEL C, BORS W. Reaction of NO with O2-implications for the action of endothelium-derived relaxing factor(EDRF)[J].Free Radic Res Commun, 1990, 10: 221-226.
[25] ISCHIROPOULOS H, ZHU L, TSAI M. Peroxynittite mediate mine nitration catalyzed by superoxide disrautase[J]. Arch Biochm Biophys,1992, 298: 431-437.
[26] 申兆菊, 沈川, 肖希龙. 外源性一氧化氮对大鼠抗氧化酶活性的影响[J]. 卫生毒理学杂志, 1997(11): 148-149.
[27] GOSSMANN J, RADOUNIKLI A, BERNEMANN A, et al. Pathophysiology of cyclosporine-induced nephrotoxicity in humans: a role for nitric oxide[J]. Kidney Blood Press Res, 2001, 24: 111-115.
[28] LI X L, ZHOU A G. Evaluation of the antioxidant effects of polysaccharides extracted fromLycium barbarrum[J]. Med Chem Res, 2007, 15:471-482.
Protective Effect ofLycium barbarumPolysaccharide against Cisplatin-induced Nephrotoxicity in Rats
ZHANG Hai-lian,GAO Li-ping*,LENG Hong-tao,LI Zhen
(Beijing Municipal Key Laboratory of Biological Active Substance and Functional Food, College of Applied Arts and Technology,Beijing Union University, Beijing 100083, China)
Objective: To reveal the protective effect and possible mechanism ofLycium barbarumpolysaccharide (LBP) against cisplatin (CDDP)-induced nephrotoxicity in rats. Methods: A total of 50 rats were randomly divided into blank control group,CDDP model group, and high-dose, medium-dose and low-dose LBP groups (orally administered at doses of 277, 554, 1008 g/(kg ·d)respectively once daily for 15 days). The blank control and CDDP model groups were both orally administered with distilled water during the adminstrtion period. After 10 days of administration, the blank control group was given normal saline by intraperitoneal injection while a single injection of CDDP in the remaining groups was carried out to establish a mouse model of renal injury.At the end of the administration period, all rats were sacrificed to determine serum BUN and Scr contents as well as NO and MDA contents and NOS and SOD activities in the kidney. Results: In the rats with CDDP-induced nephrotoxicity LBP pretreatment could significantly reduce the increase in serum BUN and Scr levels and kidney MDA and NO levels and NOS activity caused by CDDP (P<0.05 orP<0.01). Conclusions: Oral intake of LBP ameliorates CDDP-induced renal dysfunction.The mechanism may be related to the decreased NOS activity and NO and MDA contents.
cisplatin;Lycium barbarumpolysaccharide (LBP);nephrotoxicity;nitrogen monoxide (NO);malondialdehyde (MDA);nitric oxide synthase (NOS);superoxide dismutase (SOD)
R318.0
A
1002-6630(2012)05-0268-04
2011-04-11
北京市教委科技发展面上项目(KM200911417004)
张海莲(1984—),女,硕士研究生,研究方向为功能性食品生化作用。E-mail:zhl200521502008@126.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为功能性食品生化作用。E-mail:gaolip62@163.com
