源于不同加工条件下大豆分离蛋白的电子顺磁共振分析
2012-10-25黄友如陈义勇朱东兴王叹玉
黄友如,陈义勇,朱东兴,赵 阳,王叹玉
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
源于不同加工条件下大豆分离蛋白的电子顺磁共振分析
黄友如,陈义勇,朱东兴,赵 阳,王叹玉
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
分析比较几种不同来源的大豆分离蛋白的电子顺磁共振波谱(EPR)。结果表明:制备工艺条件不同,大豆分离蛋白EPR波谱中场碳自由基信号存在差异。降低蛋白提取过程中豆粕浸提的温度或减少原料脱脂豆粕的残留脂质含量、钝化原料脱脂豆粕中脂肪氧合酶活力,可使大豆分离蛋白中场碳自由基信号显著减弱。
大豆分离蛋白;电子顺磁共振;自由基
电子顺磁共振(electron paramagnetic resonance,EPR)也称电子自旋共振(electron spin resonance,ESR),这两个名称在当今国际文献中并行通用,在我国常简称为顺磁。EPR是检测未偶电子的唯一直接方法[1],比核磁共振(NMR)具有更高的灵敏度。g因子,也称光谱分裂因子,表征电子的自旋角动量与其轨道角动量对分子磁矩的相对贡献。它是未偶电子所在分子的特征量,表明样品EPR信号共振磁场的位置,是反映样品分子结构特征的重要参数,根据g因子可区别碳、氮和硫等中心自由基[2]。通过EPR,利用g因子黄友如等[3-4]研究了模拟体系中导致大豆蛋白聚集体形成的自由基由氧化亚油酸到大豆蛋白的迁移,并比较研究了不同微波功率下的大豆蛋白EPR波谱,确定了碳自由基、硫自由基、羟自由基和醛自由基等4种自由基类型。为更好地了解工业化生产过程中大豆蛋白自由基的性质,阐明大豆蛋白制备过程中自由基形成及转移机制,本实验以源于不同加工条件的大豆分离蛋白为原料,通过其EPR波谱的比较研究,探讨制备方法对大豆蛋白碳自由基浓度的影响,为大豆蛋白的工业化生产与应用提供理论指导。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(SPI-A) 东营植物蛋白科技有限公司;大豆分离蛋白(SPI-B) 吉林不二蛋白有限公司;大豆分离蛋白(SPI-C、SPI-D、SPI-E) 本实验室制备;低温脱脂豆粕 东海粮油工业(张家港)有限公司;其他试剂均为分析纯。
1.2 大豆分离蛋白的制备
样品SPI-C的制备:在室温条件下,将低温脱脂豆粕按1:15(m/V)的料液比与水混合,用2mol/L NaOH溶液调pH值至7.0。搅拌1h后,将其悬浮液在3000×g条件下离心30min,取上清液用2mol/L HCl溶液调pH值至4.5。静置后在3000×g离心30min,取蛋白沉淀分散于水中并用2mol/L NaOH溶液调pH值至7.0,喷雾干燥即得大豆分离蛋白(SPI-C)。喷雾干燥的条件为:浆料质量分数8%,进口温度168~175℃,出口温度75~80℃,压力0.4MPa。
样品SPI-D的制备:浸提温度由室温改为50℃,浸提pH值由7.0提高到9.0,其他条件同样品SPI-C的制备。
样品SPI-E的制备:低温脱脂豆粕→粉碎→过80目标准筛→乙醇和正己烷混合浸出(脱脂豆粕、95%乙醇、己烷质量比1:4:2,20℃,2h)→离心分离(3000×g,30min)→沉淀→95%乙醇浸出(质量比1:5,20℃,1h)→离心分离(3000×g,30min)→沉淀→真空干燥→低脂质含量豆粕(LRSF)→粉碎→过80目标准筛→90℃真空加热30min灭活脂肪氧合酶(LOX)→醇提浓缩蛋白→以醇提浓缩蛋白为原料制备大豆分离蛋白(SPI-E),工艺条件同样品SPI-D的制备。
1.3 分析方法
水分测定:105℃烘箱标准法[5];蛋白质测定:凯氏定氮法[5];脂质测定:氯仿-甲醇改良法[5];脂肪氧合酶活力测定:参照Huang Youru等[6]的方法,样品各指标为3次测定的平均值。
1.4 EPR波谱检测
准确称取20mg大豆分离蛋白样品,将其转移至内径3.5mm石英样品管中,使用JES-FA200 EPR波谱仪(日本JEOL公司)检测。检测条件:调制频率100kHz,微波频率9058.369MHz,微波功率0.998mW,中心磁场323.482mT,扫描宽度10mT,调制幅度0.5mT,信号增益范围200~2000。
残留脂质的EPR波谱:将大豆分离蛋白经氯仿-甲醇改良法[5]抽提所得的残留脂质,用移液枪分别移取0.5mL,将其转移至内径3.5mm石英样品管中,使用EPR波谱仪检测,检测条件同大豆分离蛋白样品的EPR波谱检测。
1.5g值的计算
采用双标样法测量g因子,即采用锰标的第3、4条峰做参考,其g值分别为2.0357和1.9804,校正ΔH=0.449mT。根据下列共振公式[7]计算。

式中:h为普朗克(Planck)常数;β为玻尔磁子;v为微波频率/GHz;H为磁场/kG(1G = 0.1mT);H=H测-ΔH。
2 结果与分析
2.1 各种类型豆粕及大豆分离蛋白的主要理化指标及残余脂肪氧合酶活力

表1 各种类型豆粕及大豆分离蛋白的主要理化指标及残余脂肪氧合酶活力Table 1 Some major components and LOX activity of different types of soybean flour and soybean protein isolates
从表1可以看出,脱脂豆粕中脂质的含量和脂肪氧合酶的活力都很高,在工业生产中利用此类脱脂豆粕为原料,在较高的温度(例如30~50℃),pH值为7.0~9.0的条件下来制备大豆分离蛋白,脂肪氧合酶就会作用于脂质,尤其是脂质中多不饱和脂肪酸,引起脂质和蛋白质的氧化,从而导致蛋白质的改性和功能性质的变化[3]。本实验中脱脂豆粕经乙醇与正己烷混合处理后,LRSF中脂质含量和脂肪氧合酶活力均明显降低,不及脱脂豆粕的10%。而且LRSF的脂肪氧合酶活力在90℃热处理30min后又进一步降低了。5种不同来源的大豆分离蛋白样品,其蛋白质和水分含量基本相同,仅残留脂质含量及脂肪氧合酶活力有差异,SPI-A、SPI-B、SPI-C和SPI-D的脂质含量及脂肪氧合酶活力基本一致,但样品SPI-E脂质含量及脂肪氧合酶活力较低。
2.2 源于3种不同来源大豆分离蛋白残留脂质的EPR波谱
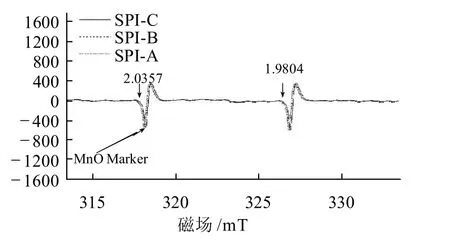
图1 3种大豆分离蛋白残留脂质的EPR波谱Fig.1 EPR spectra of lipid from three kinds of soy protein isolates
应用EPR波谱研究自由基产物,作为同类样品的相对定量测定,在实验中忽略线宽的贡献,只用EPR峰高近似表示吸收曲线的强度,且样品中自旋粒子数量与吸收曲线强度成正比。由图1可见,SPI-A、SPI-B和 SPI-C残留脂质在本实验中几乎没有EPR信号(样品SPI-D和SPI-E残留脂质的EPR波谱与之相同,EPR信号极低,故未另外标出),因此后面实验观察到的自由基信号仅在大豆蛋白存在的情况下才产生。
2.3 3种不同来源大豆分离蛋白的EPR波谱

图2 3种大豆分离蛋白的EPR波谱Fig.2 EPR spectra of three kinds of soy protein isolates
由图2所示,SPI-A和SPI-B的中场碳自由基信号强度基本一致,且中场EPR波谱几近重合;但样品SPI-C的中场碳自由基信号强度极弱,且中场EPR波谱与样品SPI-A和SPI-B相比有明显差异。样品SPI-C的中场碳自由基信号强度仅是SPI-A或SPI-B样品的12.8%。SPI-C与SPI-A、SPI-B的工艺差异主要是浸提温度的不同,SPI-C为室温,SPI-A、SPI-B通常为50℃。可见浸提温度对SPI的中场碳自由基信号有明显的影响。3种大豆分离蛋白EPR波谱中源于碳原子的中场自由基信号,其g值范围在2.0051~2.0054之间(表2、图2)。从信号的g值范围、线宽及线型来看,该碳自由基或者位于蛋白质骨架的α-碳原子上,或者位于蛋白质侧链的其他碳原子上[8-12]。
自由基是指含有奇数价电子并因此在一个轨道上具有一个未成对电子的原子或原子团。自由基有3个显著的特征,一是顺磁性,二是反应性强,三是寿命短。这些特点都与它存在未成对电子有关。分子成键过程中,电子都倾向于配对,自由基中的未成对电子也是如此。因此大多数自由基均是很活泼的,反应性极强,容易反应生成稳定分子,此乃自由基的一个非常重要的性质。那么,3种大豆分离蛋白EPR波谱的差异是在生产过程中产生的,还是在制备后的贮藏期间产生的?为此,将3种大豆分离蛋白分别保存在相同材质的塑料密封袋中,常温下保存30d后,重复上述实验,结果发现:贮藏时间等因素对粉末状大豆分离蛋白的EPR波谱几乎没有影响(图3、表3),说明大豆分离蛋白的工业化生产与实验室制备的工艺条件存在差异,该差异不仅影响终产品的脂质含量与功能性质,而且对大豆分离蛋白EPR波谱的中场碳自由基信号等也有明显的影响。

表2 3种大豆分离蛋白的中场碳自由基信号Table 2 Central carbon radical singlet signal of three kinds of soy protein isolates

图3 常温下保存30d后的3种大豆分离蛋白EPR波谱Fig.3 EPR spectra of three kinds of soy protein isolates stored at room temperture for 30 days

表3 常温下保存30d后的3种大豆分离蛋白中场碳自由基信号Table 3 Central carbon radical singlet signal of three kinds of soy protein isolates stored at room temperature for 30 days
与实验室制备相比较,工业化生产大豆分离蛋白的主要不同在于蛋白质的浸提阶段,工业化生产过程中,为了提高蛋白质得率,浸提温度通常为50℃,浸提pH值一般是9.0(有的为pH6.8)[13-14]。而低温脱脂豆粕中脂肪氧合酶的活力较高(表1),在蛋白浸提过程中,呈现较高的生物活性。Huang Youru等[15]应用电子顺磁共振(EPR)波谱研究了模拟体系中导致大豆蛋白聚集体形成的自由基由氧化亚油酸到大豆蛋白的迁移,证明大豆蛋白EPR波谱的中场碳自由基信号源于脂肪氧合酶催化亚油酸氧化所形成的自由基转移而来。低温脱脂豆粕中残留脂质含量较高约2.55%左右(表1),在蛋白质制备的浸提过程中如果温度较高(如50℃),浸提pH值适合(如pH9.0),脂肪氧合酶可催化残留脂质中的不饱和脂肪酸氧化,产生的自由基可转移至大豆蛋白,进一步导致蛋白质的氧化和/或聚集。因此,3种大豆分离蛋白EPR波谱的中场碳自由基信号的差异,可能是由于加工工艺条件的不同而造成的。
鉴于此,本研究调整了实验室制备大豆分离蛋白的工艺条件,采用两种方法分别制备大豆分离蛋白SPI-D和SPI-E。SPI-D与SPI-E的区别在于,前者原料是低温脱脂豆粕;而后者的原料是低温脱脂豆粕经过进一步脱脂和灭酶处理,形成低脂质含量与低脂肪氧合酶活力的醇提浓缩蛋白。两者的浸提温度均是50℃,浸提pH值均是9.0。将制备所得的大豆分离蛋白(SPI-D和SPI-E)做EPR波谱检测,结果见图4、表4。

图4 大豆分离蛋白SPI-D和SPI-E的EPR波谱Fig.4 EPR spectra of sample SPI-D and SPI-E

表4 大豆分离蛋白SPI-D和SPI-E的中场碳自由基信号Table 4 Central carbon radical singlet signal of samples SPI-D and SPI-E
由表4、图4可知,在以低温脱脂豆粕为原料制备大豆分离蛋白的过程中,采用pH9.0浸提条件恰是脂肪氧合酶的最佳反应pH值范围,若浸提温度较高(如50℃),脂肪氧合酶的活力进一步增加,催化浸提液中残留脂质的不饱和脂肪酸氧化,产生自由基可转移至大豆蛋白,导致大豆蛋白中场碳自由基信号的增强;降低原料脱脂豆粕的残留脂质含量,同时钝化原料脱脂豆粕中脂肪氧合酶活力,可使大豆分离蛋白中场碳自由基信号显著减弱。
值得注意的是,作为食品添加剂,工业化生产的大豆分离蛋白中较强的自由基信号,在含有大豆蛋白的食品加工过程中,将会发生进一步的变化,进而对终产品的品质产生影响,相关的研究正在进行中。
3 结 论
本实验比较了3种不同来源大豆分离蛋白的EPR波谱,结果发现3种大豆分离蛋白EPR波谱的中场碳自由基信号存在差异,分离3种不同来源大豆分离蛋白中的残留脂质,并在相同条件下做EPR分析,结果表明此条件下残留脂质的EPR波谱自由基信号极其微弱,说明实验观察到的自由基信号仅在大豆蛋白存在的情况下才产生。进一步研究表明制备大豆分离蛋白的工艺条件不同,是造成其EPR波谱中场碳自由基信号差异的主要原因。降低蛋白提取过程中豆粕浸提的温度或减少原料脱脂豆粕的残留脂质含量、钝化原料脱脂豆粕中脂肪氧合酶活力,可使大豆分离蛋白中场碳自由基信号显著减弱。
[1] DAVIES K J A. Protein damage and degradation by oxygen radicals[J]. The Journal of Biological Chemistry, 1987, 262(20): 9895-9901.
[2] SCHAICH K M. Free radical initiation in proteins and amino acids by ionizing and ultraviolet radiations and lipid oxidation[J]. CRC Critical Reviews in Food Science & Nutrition, 1980, 13(2): 131-160.
[3] 黄友如, 华欲飞, 顾建华, 等. 脂肪氧合酶催化亚油酸氧化与大豆蛋白相互作用过程中自由基迁移的电子顺磁共振研究(I)自由基的检测[J]. 食品科学, 2008, 29(3): 87-93.
[4] 黄友如, 华欲飞, 王雪峰, 等. 脂肪氧合酶催化亚油酸氧化与大豆蛋白相互作用过程中自由基迁移的电子顺磁共振研究(II)自由基类型的确定[J]. 食品科学, 2008, 29(4): 41-45.
[5] 宁正祥. 食品成分分析手册[M]. 北京: 中国轻工业出版社, 1998.
[6] HUANG Youru, HUA Yufei, QIU Aiyong. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39(2): 240-249.
[7] DADAYLI D, SUNNETGIOGLU M M, KOKSEL H, et al. Detection of irradiated wheat using the electron paramagnetic resonance[J]. Cereal Chemistry, 1997, 74(4): 375-378.
[8] SAEED S, FAWTHROP S A, HOWELL N K. Electron spin resonance (ESR) study on free-radical transfer in fish lipid-protein interactions[J]. Journal of the Science of Food and Agriculture, 1999, 79(13): 1809-1816.
[9] 方允中, 郑荣梁. 自由基生物学的理论与应用[M]. 北京: 科学出版社, 2002: 155; 924-939.
[10] PSHEZHETSKII S Y, KOTOV A G, MILINCHUK V K, et al. EPR of free radicals in radiation chemistry[M]. New York: Halsted Press, 1972.
[11] HENRIKSEN T, MELA T B, SAXEBEL G. Free radical in biology: Vol 2[M]. London: Academic Press, 1976.
[12] QIAN S Y, TOMER K B, YUE G H, et al. Characterization of the initial carbon-centered pentadienyl radical and subsequent radicals in lipid peroxidation: identification via LC-ESR and MS[J]. Free Radical Biology & Medicine, 2002, 33(7): 998-1009.
[13] 石彦国, 任莉. 大豆制品工艺学[M]. 北京: 中国轻工业出版社. 1993: 371-386.
[14] 李正明, 王兰君. 植物蛋白生产工艺与配方[M]. 北京: 中国轻工业出版社, 1998: 104.
[15] HUANG Youru, HUA Yufei, QIU Aiyong. Detection of free radical transfer in lipoxygenase I-B-catalyzed linoleic acid-soybean proteins interaction by electron spin resonance spectroscopy (ESR)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(24): 9216-9220.
Electron Paramagnetic Resonance Spectroscopy (EPR) Study of Soybean Protein Isolates Prepared by Different Processing Methods
HUANG You-ru,CHEN Yi-yong,ZHU Dong-xing,ZHAO Yang,WANG Tan-yu
(School of Biological Science and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Soybean protein isolates were prepared by different methods and comparatively analyzed by electron paramagnetic resonance (EPR) spectroscopy. The results showed that soybean protein isolates obtained by different methods were different in central singlet signal attributed to the carbon radical (gvalue ranged between 2.0051 and 2.0054). The central free radical signal of soybean protein isolates could be weakened by decreasing extraction temperature, reducing lipid contents of defatted soybean flakes or inactivating lipoxygenase activity.
soybean protein isolates;electron paramagnetic resonance(EPR);free radicals
TS201.21;TQ645.99
A
1002-6630(2012)05-0098-04
2011-05-04
江苏省高校自然科学研究项目(10KJB550001);苏州市科技计划项目(SYND201003)
黄友如(1966—),男,副教授,博士,主要从事生物高分子及植物蛋白的基础研究与开发。E-mail:huangyouru@yahoo.com.cn
