迷迭香对生鲜猪肉颜色变化与抗氧化稳定性的影响
2012-10-25应丽莎赵东方
应丽莎,赵东方,傅 阳,张 敏*
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆 400715)
迷迭香对生鲜猪肉颜色变化与抗氧化稳定性的影响
应丽莎,赵东方,傅 阳,张 敏*
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆 400715)
选用鼠尾草酸质量分数分别为5%和20%的迷迭香(CAP05、CAP20),分别以一定质量浓度梯度喷射到生鲜猪肉表面,并将猪肉置于超市标准荧光灯下冷藏8d。检测迷迭香对猪肉贮藏期间CIEa*值、色相、氧合肌红蛋白、正铁肌红蛋白、TBARS值、蛋白质羰基和感官评价的影响。实验发现,5%鼠尾草酸的抗氧化效果总体优于20%鼠尾草酸的作用效果,其中r500、r1000和R500组较大程度上延缓了肉品的变色及脂肪和蛋白质的氧化,且r500组肉品在第8天变色最轻、异味最少。统计分析发现猪肉的氧合肌红蛋白、正铁肌红蛋白、TBARS值和蛋白质羰基与颜色CIEa*值之间具有极显著的相关性(P<0.01)。
迷迭香;鼠尾草酸;抗氧化;颜色;猪肉
猪肉脂肪含有高浓度的多不饱和脂肪酸,极易发生脂类氧化反应,致使整个体系稳定性下降。体系中复杂的氧化反应,除影响薄膜磷脂外,同样影响蛋白质的稳定性[1-2]。色素(肌红蛋白和血红蛋白)同样会在脂类-色素反应中发生氧化,导致肉品颜色发生改变[3]。而颜色直接影响消费者对肉类产品的购买欲望[4-6]。为了增加肉品在储运、销售等过程中体系的稳定性,延缓高活性化合物的产生,具有高抗氧化活性的天然植物提取物如迷迭香在食品领域有着广泛的应用前景。
迷迭香属于唇形科芳香植物,其提取物作为一种高效抗氧化剂广泛运用于食品企业,其高抗氧化活性主要与一些酚二萜类化合物的存在有关,这些酚二萜类物质主要通过提供氢原子以中断体系的自由基反应链[7],抑制氧化进程的进一步发展。大量研究报道显示迷迭香提取物可以使肉品获得更高的感官得分并且有效延缓其脂类氧化[8-10]。而鼠尾草酸(carnosic acid,CA)、鼠尾草酚和迷迭香酸被证明是迷迭香抗氧化活性的主要成分[11],其中鼠尾草酸是迷迭香叶子中发现的主要二萜酚化合物[12]。鼠尾草酸是一种高效的亲脂抗氧化剂,含有一个芳香环结构,芳香环上的两个羟基可以作为电子供体,而且邻位羟基可以螯合促氧化的金属离子[13]。研究发现迷迭香提取物的抗氧化活性与鼠尾草酸的质量分数有一定关联[14]。Terpinc等[12]发现迷迭香提取物的自由基清除能力随其总酚含量(主要是鼠尾草酸含量)的增加而增加。目前,迷迭香的添加浓度[15]和食品基质[16]对迷迭香抗氧化活性的影响已经被大量研究报道,然而迷迭香对猪肉的抗氧化活性与其鼠尾草酸质量分数之间的关系鲜有报道,且国内外研究者大多以肉制品为抗氧化研究对象,对新鲜肉品关注较少。本实验以新鲜猪肉为实验材料,模拟鲜肉超市销售环境,探讨迷迭香的抗氧化活性和鼠尾草酸含量之间的关系,并分析在迷迭香的作用下肉品的颜色与抗氧化稳定性之间的关系及肌红蛋白、脂肪和蛋白质氧化三者之间的关系。
1 材料与方法
1.1 材料与试剂
迷迭香提取物(鼠尾草酸质量分数为5%的迷迭香粉末(CAP05),鼠尾草酸质量分数为20%的迷迭香粉末(CAP20)) 海南舒普生物科技有限公司。
盐酸胍、丙二醛二乙缩醛(TEP) 北京大田丰拓化学技术有限公司;三氯乙酸、硫代巴比妥酸、无水乙醇和正戊烷等(均为分析纯) 成都市科龙化工试剂厂。
1.2 仪器与设备
UV2450紫外分光光度计 日本岛津公司;UltraScan PRO测色仪 美国HunterLab公司;GL-20G-Ⅱ型高速冷冻离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 肉样制备
将猪通脊肉剔除可见脂肪,用无菌手术刀切成1.5cm厚的肉排,置于4℃空气中1h,使其充分熟化[8],然后对部分肉样表面喷射迷迭香提取物。两种迷迭香(CAP05、CAP20)均用正戊烷溶解[17],并分别配成3种不同质量浓度的处理液。迷迭香处理组肉品喷射2mL处理液,对照组肉品喷射2mL正戊烷。
猪肉总共被分成7个处理组。1)对照组:正戊烷;2) r500组:0.05g/100mL CAP05溶液;3) r1000组:0.1g/100mL CAP05溶液;4) r1500组:0.15g/100mL CAP05溶液;5) R250组:0.025g/100mL CAP20溶液;6) R500组:0.05g/100mL CAP20溶液;7) R1000组:0.1g/100mL CAP20溶液。
1.3.2 实验设计
所有样品均放置在尺寸为18.5cm×11.5cm×2.5cm的聚苯乙烯塑料托盘内,用聚乙烯薄膜(水蒸气透过率40.7g/(m2·d);透氧率0.19cm3/(m2·d·Pa)包裹,放置在超市标准荧光灯下于4℃贮藏8d,每2d取1次样进行分析。
1.4 指标测定
1.4.1 表面颜色
参照Rubio等[18]方法。根据CIEL*a*b*颜色标准采用色差仪于室温条件下测得。使用D65照明光源,10°标准观察角。每个样品取上表面均匀分布的6处不同位置进行测量并求其平均值。同时计算肉品的色相(Hue),Hue=tan-1(b*/a*)。
1.4.2 肌红蛋白含量
参照Krzywicki[19]方法。正铁肌红蛋白用冷的0.04mol/L、pH6.8的磷酸盐缓冲液提取,样品和缓冲液的比例为1:10(m/V)。 样品匀浆在5℃、50000×g离心30min,吸取上清液于525、545、565、572nm波长处测其吸光度。不同形态肌红蛋白所占百分比由以下公式得出[19]。

1.4.3 脂肪氧化测定
参照Sorensen等[20]方法,检测猪肉脂肪氧化的次级产物丙二醛的含量。取5g肉样加入到15mL、7.5%的三氯乙酸(TCA)溶液中充分混匀,过滤。滤液与同体积0.02mol/L硫代巴比妥酸(TBA)混合,100℃水浴40min,用流动的自然水冷却至室温。取上清液在532nm波长处比色。用丙二醛二乙缩醛(TEP)作丙二醛标准曲线,由曲线可得出样品的硫代巴比妥酸反应值(TBARS)。
1.4.4 蛋白质氧化测定
参照Mercier等[21]方法,通过检测样品中生成的羰基含量来评定。取1g猪肉在磷酸盐缓冲液中高速匀浆,移取两份等量提取液分别与20% TCA反应。其中一份用0.2%二硝基苯肼(DNPH)处理,另一份用2mol/L HCl作空白对照。体系置于25℃水浴反应30min,再加1mL TCA,冷冻高速离心15min,弃上清。沉淀经乙醇-乙酸乙酯(体积比1:1)洗涤3次后溶解于6mol/L盐酸胍中,于370nm波长处测定其吸光度。总蛋白质含量通过测定HCl空白组在280nm波长处的吸光度,并以牛血清白蛋白(BSA)作标准曲线计算可得。结果用每毫克蛋白质中含有与DNPH结合的蛋白浓度表示。
1.4.5 感官评价
参照Djenane等[22]方法。由6人组成的评价小组对猪肉表面变色及气味进行感官评定。采用5分制计分法。“变色”评分依据肉表面变色百分比确定:1分=无,2分=0~10%,3分=11%~20%,4分=21%~ 60%,5分=61%~100%;“气味”评分是根据肉品异味强烈程度确定:1分=无,2分=轻微,3分=少量,4分=中等程度,5分=极其强烈。取评定小组中占多数的评分结果作为最终感官评定结果[23]。
1.5 数据处理
使用SPSS 13.0软件对各指标进行相关性分析。
2 结果与分析
2.1 表面颜色变化

图1 不同处理组猪肉冷藏期间a*值的变化Fig.1 Change of a* value in pork with different treatments during chilled storage
由图1可知,未经迷迭香处理的对照组贮藏2d后a*值增加,但之后呈急剧下降趋势,而大量研究均报道肉品a*值随贮藏时间延长而减少[24-25],这可能是由于猪肉在前2d仍然在进行熟化作用,脱氧肌红蛋白与空气中的O2发生结合反应。除r1000组外,迷迭香处理的猪肉在第2天a*值均小于对照组,但是所有迷迭香处理组的a*值下降速率较慢,且第8天其a*值均大于对照组。其中r500、r1000、R500组从第4天开始a*值均大于对照组,增加了猪肉a*值的持留能力。
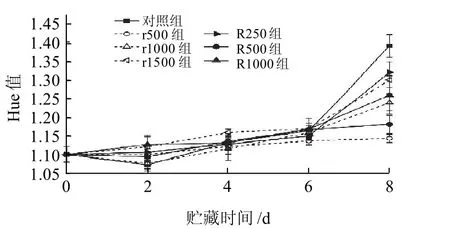
图2 不同处理组猪肉冷藏期间色相(Hue值)的变化Fig.2 Change of hue angle in pork with different treatments during chilled storage
由图2可知,Hue值表示颜色发生偏离的程度,Hue值越小,说明变色程度越小。经统计分析,鲜肉a*值与色相呈极显著负相关(P<0.01),对照组肉品贮藏6d后Hue值迅速增加,而r500和R500两组很好地抑制了肉品后期Hue值的快速增加,其中r500组肉品虽在第2天的Hue值略大于对照组,但是在整个贮藏期间其色相值一直处于较低水平,说明r500组有效延缓了猪肉贮藏期间的变色。
由图1、2可知, r500、r1000、R500组对猪肉的护色效果较好,其中r1000组在第2天呈现最佳的护色效果,但是在第8天其作用效果低于r500组和R500组。2.2 肌红蛋白含量的变化

图3 不同处理组猪肉冷藏期间氧合肌红蛋白含量的变化Fig.3 Change of oxymyoglobin content in pork with different treatments during chilled storage
由图3可知,各组氧合肌红蛋白(OxyMb)在贮藏前2d呈上升趋势,表明此阶段猪肉的肌红蛋白与空气中O2结合形成亮红色的OxyMb,这也解释了对照组肉品前2da*值增加的原因。由分析可知,猪肉贮藏期间氧合肌红蛋白含量与肉品a*值呈极显著相关性(P<0.01),与色相呈显著相关性(P<0.05)。对照组样品前期氧合肌红蛋白含量较高,第4天出现迅速下降,到第8天OxyMb含量几乎接近20%。而r500、r1000、R500组样品从第2天开始OxyMb含量一直维持在40%以上,其中r500处理组鲜肉在贮藏期间的OxyMb含量一直处于最高水平,到第8天仍维持在50%左右。而R250、R1000、r1500组对氧合肌红蛋白的生成与维持产生了不利影响。
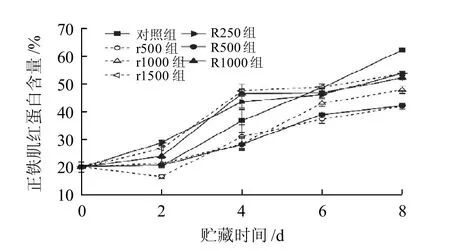
图4 不同处理组猪肉冷藏期间正铁肌红蛋白含量的变化Fig.4 Change of metmyoglobin content in pork with different treatments during chilled storage
由图4可知,鲜肉正铁肌红蛋白(MetMb)含量与CIEa*值及Hue值的相关性均达到极显著水平(P<0.01)。 r500、r1000、R500组明显延缓了正铁肌红蛋白的生成。相反,R250、R1000、r1500组由加速了猪肉MetMb的形成,这3组猪肉第4天MetMb含量已超过40%。这是因为抗氧化剂的作用效果依赖于其与自由基中间体的反应速率,自由基能够催化体系中底物的氧化进程[26],迷迭香通过淬灭自由基来中断反应链,从而显示抗氧化作用。但是这些植物多酚类抗氧化剂自身组分同样会受到自由基攻击,发生氧化反应导致活性下降,而氧化产物又作为促氧化剂促进氧化反应的进行[27]。
2.3 脂肪氧化
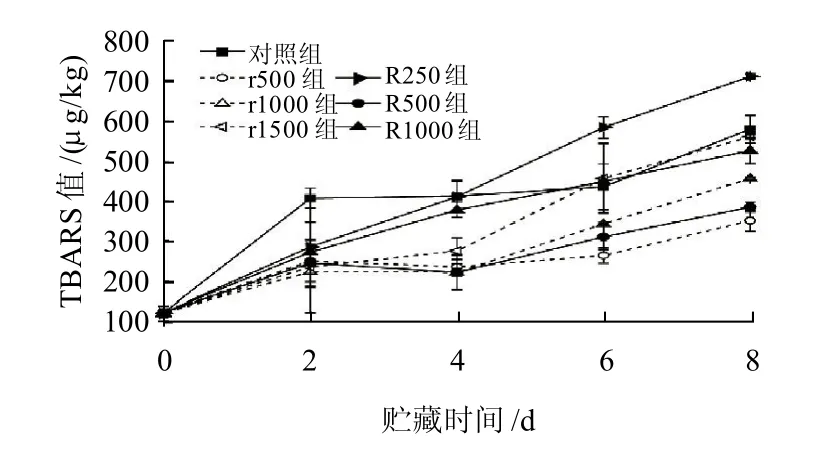
图5 不同处理组猪肉冷藏期间脂肪次级氧化产物TBARS值的变化Fig.5 Change of TBARS from secondary lipid oxidized products in pork with different treatments during chilled storage
由图5可知,R250和R1000两组虽然在第2天其TBARS值低于对照组,但是这两组样品的TBARS值在贮藏期间一直以较大速率增长,在第4天其TBARS值已接近对照组。r1500在前4d较好地抑制了猪肉TBARS值的增加,第6天肉品的TBARS值也达到了对照组水平。而r500、r1000、R500组在8d贮藏期间其TBARS值始终低于对照组,有效延缓了猪肉的脂肪氧化,其中r500组从第6天开始其TBARS值低于其他两组,说明此阶段r500组对猪肉脂肪氧化的抑制能力最强。
脂类氧化和肌红蛋白氧化可分别导致肉品酸败及变色反应,这两个进程通常认为具有一定的关联[28]。研究报道氧化的脂质对肌红蛋白具有促氧化作用[29-30]。脂类氧化产物如α,β不饱和醛通过与蛋白质共价结合增加血红素裂口的暴露,从而促进肌红蛋白氧化[31]。先前大量研究报道迷迭香可明显减少鸡肉香肠[10]、猪肉糊[3]、羊肉[32]、牛肉夹饼[9]等TBARS值的积累及正铁肌红蛋白形成。本实验也发现r500、r1000、R500组对猪肉肌红蛋白和脂肪均显示良好的抗氧化作用。O'Grady等[33]认为脂类氧化极有可能是氧合肌红蛋白氧化和肉品变色的一种重要催化剂,但是脂类氧化进程对OxyMb氧化起催化作用的可能是初级氧化产物而非次级产物,这与本实验的结果一致。本实验显示由脂肪次级氧化产物生成的TBARS值与氧合肌红蛋白没有相关性,但是与正铁肌红蛋白呈极显著正相关(P<0.01)。研究发现MetMb可以与过氧化氢或脂类氢过氧化物发生作用,导致游离铁原子和血红素的释放,MetMb产生的血红素被认为是诱导脂类氧化的主要催化剂[34-35]。
2.4 蛋白质氧化
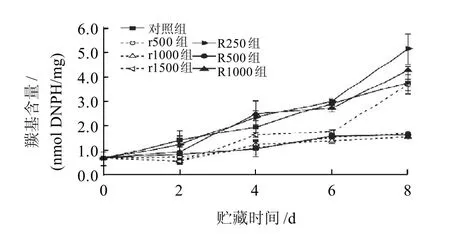
图6 不同处理组猪肉冷藏期间蛋白质羰基含量的变化Fig.6 Change in content of carbonyls from protein oxidized products in pork with different treatments during chilled storage
由图6可知,R250和R1000两组对蛋白质没有抗氧化作用,反而显示了轻微的促氧化效果,r1500组对蛋白质羰基的抑制作用只限于前6d,而r500、r1000、R500组在整个贮藏期间对蛋白质羰基的形成起到了很好的抑制作用。实验发现蛋白质羰基含量与脂类TBARS值呈极显著正相关(P<0.01),r500、r1000、R500组对猪肉脂肪和蛋白质均起到了很好的抗氧化作用。Estevez等[36]也发现蛋白质氧化与脂类氧化在统计学上具有极显著相关性(P<0.01),认为蛋白质氧化与脂类氧化存在着一定的关联。而Lund等[26]报道0.05%迷迭香有效抑制了牛肉夹饼的脂类氧化,但是对蛋白质氧化没有抑制作用,这与本实验结果不一致,这可能是由于迷迭香作用介质的差异性造成的。抗氧化剂对蛋白质氧化的作用效果依赖于食品基质,即蛋白质存在形式、金属离子的存在及氧化诱因[26]。
2.5 感官指标变化

表1 不同处理组猪肉4℃冷藏8d期间感官评价分值的变化Table 1 Change of sensory evaluation of pork with different treatments during 4 ℃ storage for 8 days
从表1可以看出。鲜肉感官颜色与CIEa*值呈极显著相关(P<0.01)。r1500、R250、R1000组对猪肉颜色产生了不利影响,到第4天已出现严重变色,而对照组在第6天才发生大面积变色。r1000组虽然第2天变色程度低于对照组,但是在之后的贮藏过程中没有显示明显的护色作用。而r500和R500两组有效延缓了猪肉的变色,到第8天其变色程度仍在20%以下,而其余各组肉品均已严重变色。
感官评定发现对照组样品最先出现异味,但是第6天各处理组均出现不同程度的异味,到第8天,除r500组肉品有少量异味,其余各组均已出现较强烈的异味。肉品出现的异味可能是由脂肪氧化造成的,本实验发现TBARS值与感官异味呈极显著正相关(P<0.01),这在Colindres等[37]的研究中也报道过。Brewer[13]指出猪肉中的高浓度多不饱和脂肪酸极易发生氧化反应,会产生各种醛类、烯烃类、烷烃等氧化产物,而其中的大部分氧化产物具有的异味在极低质量浓度时就可被感官感知。2.6 相关性分析
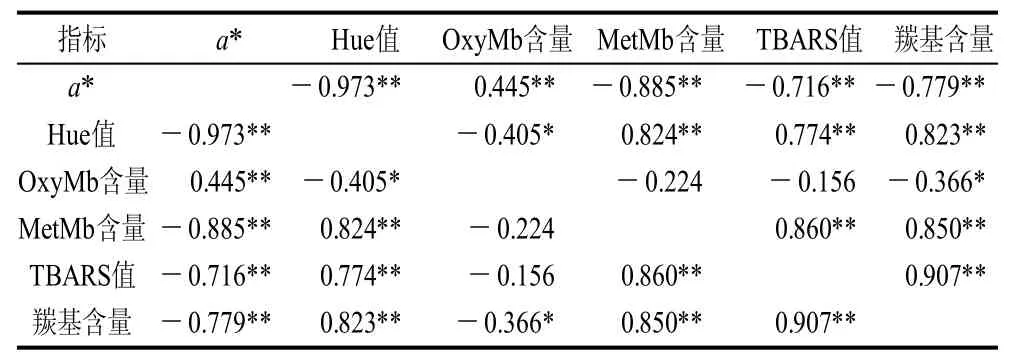
表2 a*值、色相、氧合肌红蛋白含量、正铁肌红蛋白含量、TBARS值和蛋白质羰基含量之间的相关性Table 2 Correlation among a*, hue, oxymyoglobin, metmyoglobin, TBARS and carbonyls in pork with different treatments during chilled storage
从表2可以看出,迷迭香对猪肉颜色的保护作用与肉品抗氧化稳定性之间呈现一定的相关性OxyMb含量、MetMb含量、TBARS值和羰基含量与猪肉CIEa*值之间有极显著的相关性。TBARS值和羰基含量两者与MetMb含量的相关性(P<0.01)强于与OxyMb含量的相关性(P<0.05),虽然相关性并不意味着因果关系,但是可以猜测猪肉中正铁肌红蛋白含量比氧合肌红蛋白含量更能显示肉品发生氧化的程度。实验也发现蛋白质羰基含量与脂类TBARS值呈极显著正相关,相关系数达到0.907。
3 结 论
迷迭香对新鲜猪肉8d冷藏期间的抗氧化效果受含鼠尾草酸质量分数5%和20%的迷迭香类型的影响。实验发现r500、r1000、R500组显示了较强的抗氧化活性,增加了猪肉贮藏期间红色的持留能力,并且有效抑制了肌红蛋白、脂肪和蛋白质的氧化。其中感官评定发现r500组肉品第8天变色和异味最少,认为r500组的抗氧化效果略优于r1000和R500两组。统计分析发现猪肉a*值与肌红蛋白、TBARS和蛋白质羰基三者之间的相关性达到极显著水平,说明猪肉的颜色与肉品的抗氧化稳定性紧密相关。
总体而言,鼠尾草酸质量分数为5%的迷迭香(CAP05)的作用效果优于鼠尾草酸质量分数为20%的迷迭香(CAP20)。这说明5%鼠尾草酸对于猪肉的抗氧化作用已经足够,增加鼠尾草酸的质量分数并没有显著提高迷迭香对猪肉的抗氧化效果,相反,高质量分数的鼠尾草酸有可能会产生促氧化的不利效果,如r1000对猪肉的变色,肌红蛋白、脂类和蛋白质的氧化均有一定的抑制作用,而相同添加质量浓度的R1000在本实验中没有表现出明显的抗氧化活性。
此外,两种迷迭香以相同鼠尾草酸质量浓度添加到肉品中也呈现出不同的抗氧化效果,如r1000和R250两种处理液中鼠尾草酸的质量浓度均为0.005g/100mL,但是R250组对猪肉的抗氧化效果远远不及r1000组,这是因为迷迭香粉末提取物是一个混合体系,鼠尾草酸只是其中起抗氧化作用的主要成分,而不是唯一成分。这说明r1000和R250两组虽然有相同含量的鼠尾草酸,但是两种处理液中其他酚类物质的构成和含量可能存在较大差异,而这些物质成分在特定的食品基质中可能与鼠尾草酸发生协同或拮抗作用。Wang等[38]研究发现迷迭香乙醇提取物的抗氧化活性高于其中单一的酚类物质。Hernandez-Hernandez等[3]也指出总酚含量高并不代表高抗氧化活性,一系列不知名的活性物质可以作为抗氧化剂,与主成分显示协同作用。酚类以混合物形式存在时活性增强,因为活性高的酚类容易发生氧化,而活性低的酚类使体系重新具有较强的活性。但是Zhang Ying等[39]研究3种含高鼠尾草酸的迷迭香提取物的体外抗氧化活性及对葵花籽油的保护作用,实验发现鼠尾草酸含量越高,迷迭香DDPH自由基清除活性和还原能力越强,而且对葵花籽油的脂类氧化的抑制作用也越强,这与本实验的结果不符,这可能是由于本实验使用的两种迷迭香中鼠尾草酸含量较低,故鼠尾草酸的作用效果容易受到体系中其他酚类物质的干扰。
[1] LIU Fang, DAI Ruitong, ZHU Jinyuan, et al. Optimizing color and lipid stability of beef patties with a mixture design incorporating with tea catechins, carnosine, and alpha-tocopherol[J]. Journal of Food Engineering, 2010, 98(2): 170-177.
[2] FASSEAS M K, MOUNTZOURIS K C, TARANTILIS P A, et al. Antioxidant activity in meat treated with oregano and sage essential oils [J]. Food Chemistry, 2008, 106(3): 1188-1194.
[3] HERNANDEZ-HERNANDEZ E, PONCE-ALQUICIRA E, JARAMILLO-FLORES M E, et al. Antioxidant effect rosemary (Rosmarinus officinalisL.) and oregano (Origanum vulgareL.) extracts on TBARS and colour of model raw pork batters[J]. Meat Science, 2009, 81(2): 410-417.
[4] O,GRADY M N, MAHER M, TROY D J, et al. An assessment of dietary supplementation with tea catechins and rosemary extract on the quality of fresh beef[J]. Meat Science, 2006, 73(1): 132-143.
[5] KIM Y H, KEETON J T, YANG H S, et al. Color stability and biochemical characteristics of bovine muscles when enhanced withL-orD-potassium lactate in high-oxygen modified atmospheres[J]. Meat Science, 2009, 82(2): 234-240.
[6] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121.
[7] BASAGA H, POLI G, TEKKAYA C, et al. Free radical scavenging and antioxidative properties of silibin, complexes on microsomal lipid peroxidation[J]. Cell Biochem Funct, 1997, 15(1): 27-33.
[8] DJENANE D, SANCHEZ-ESCALANTE A, BELTRAN J A, et al. Ability of alpha-tocopherol, taurine and rosemary, in combination with vitamin C, to increase the oxidative stability of beef steaks packaged in modified atmosphere[J]. Food Chemistry, 2002, 76(4): 407-415.
[9] GEORGANTELIS D, BLEKAS G, KATIKOU P, et al. Effect of rosemary extract, chitosan and alpha-tocopherol on lipid oxidation and colour stability during frozen storage of beef burgers[J]. Meat Science, 2007, 75 (2): 256-264.
[10] LIU Dengcheng, TSAU R T, LIN Y C, et al. Effect of various levels of rosemary or Chinese mahogany on the quality of fresh chicken sausage during refrigerated storage[J]. Food Chemistry, 2009, 117(1): 106-113.
[11] ARUOMA O I, HALLIWELL B, AESCHBACH R, et al. Antioxidant and pro-oxidant properties of active rosemary constituents: carnosol and carnosic acid[J]. Xenobiotica, 1992, 22(2): 257-268.
[12] TERPINC P, BEZJAK M, ABRAMOVIC H. A kinetic model for evaluation of the antioxidant activity of several rosemary extracts[J]. Food Chemistry, 2009, 115(2): 740-744.
[13] BREWER M S. Natural antioxidants: sources, compounds, mechanisms of action, and potential applications[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(4): 221-247.
[14] TROJAKOVA L, R BLOVA Z, NGUYEN H T T, et al. Antioxidant activity of rosemary and sage extracts in rapeseed oil[J]. Journal of Food Lipids, 2001, 8(1): 1-13.
[15] WANG Hua, LIU Fang, YANG Lei, et al. Oxidative stability of fish oil supplemented with carnosic acid compared with synthetic antioxidants during long-term storage[J]. Food Chemistry, 2011, 128(1): 93-99.
[16] ESTEVEZ M, CAVA R. Effectiveness of rosemary essential oil as an inhibitor of lipid and protein oxidation: contradictory effects in different types of frankfurters[J]. Meat Science, 2006, 72(2): 348-355.
[17] DJENANE D, SANCHEZ-ESCALANTE A, BELTRAN J A, et al. Extension of the shelf life of beef steaks packaged in a modified atmosphere by treatment with rosemary and displayed under UV-free lighting [J]. Meat Science, 2003, 64(4): 417-426.
[18] RUBIO B, MARTINEZ B, GARCIA-CACHAN M D, et al. Effect of the packaging method and the storage time on lipid oxidation and colour stability on dry fermented sausage salchichon manufactured with raw material with a high level of mono and polyunsaturated fatty acids[J]. Meat Science, 2008, 80(4): 1182-1187.
[19] KRZYWICKI K. The determination of haem pigments in meat[J]. Meat Science, 1982, 7(1): 29-36.
[20] SORENSEN G, JORGENSEN S S. A critical examination of some experimental variables in the 2-thiobarbituric acid (TBA) test for lipid oxidation in meat products[J]. Zeitschrift fur Lebensmitteluntersuchung und -Forschung A, 1996, 202(3): 205-210.
[21] MERCIER Y, GATELLIER P, VIAU M, et al. Effect of dietary fat and vitamin E on colour stability and on lipid and protein oxidation in Turkey meat during storage[J]. Meat Science, 1998, 48(3/4): 301-318.
[22] DJENANE D, SANCHEZ-ESCALANTE A, BELTRAN J A, et al. Extension of the retail display life of fresh beef packaged in modified atmosphere by varying lighting conditions[J]. Journal of Food Science, 2001, 66(1): 181-186.
[23] ABOU-ARAB E A, ABU-SALEM F M. Effect of natural antioxidants on the stability of ostrich meat during storage[J]. Grasas Y Aceites, 2010, 61(1): 102-108.
[24] HAYES J E, STEPANYAN V, ALLEN P, et al. Effect of lutein, sesamol, ellagic acid and olive leaf extract on the quality and shelf-life stability of packaged raw minced beef patties[J]. Meat Science, 2010, 84(4): 613-620.
[25] CARPENTER R, O,GRADY M N, O,CALLAGHAN Y C, et al. Evaluation of the antioxidant potential of grape seed and bearberry extracts in raw and cooked pork[J]. Meat Science, 2007, 76(4): 604-610.
[26] LUND M N, HVIID M S, SKIBSTED L H. The combined effect of antioxidants and modified atmosphere packaging on protein and lipid oxidation in beef patties during chill storage[J]. Meat Science, 2007, 76 (2): 226-233.
[27] HUANG S W, FRANKEL E N. Antioxidant activity of tea catechins in different lipid systems[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 3033-3038.
[28] FAUSTMAN C, SUN Q, MANCINI R, et al. Myoglobin and lipid oxidation interactions: mechanistic bases and control[J]. Meat Science, 2010, 86(1): 86-94.
[29] FAUSTMAN C, LIEBLER D C, MCCLURE T D, et al. alpha, betaunsaturated aldehydes accelerate oxymyoglobin oxidation[J]. J Agric Food Chem, 1999, 47(8): 3140-3144.
[30] LEE S, PHILLIPS A L, LIEBLER D C, et al. Porcine oxymyoglobin and lipid oxidationin vitro[J]. Meat Science, 2003, 63(2): 241-247.
[31] ZANARDI E, DORIGONI V, BADIANI A, et al. Lipid and colour stability of Milano-type sausages: effect of packing conditions[J]. Meat Science, 2002, 61(1): 7-14.
[32] CAMO J, BELTRAN J A, RONCALES P. Extension of the display life of lamb with an antioxidant active packaging[J]. Meat Science, 2008, 80 (4): 1086-1091.
[33] O'GRADY M N, MONAHAN E J, BRUNTON N P. Oxymyoglobin oxidation and lipid oxidation in bovine muscle: mechanistic studies[J]. Journal of Food Science, 2001, 66: 386-392.
[34] AHN D U, KIM S M. Prooxidant effects of ferrous iron, hemoglobin, and ferritin in oil emulsion and cooked-meat homogenates are different from those in raw-meat homogenates[J]. Poult Sci, 1998, 77(2): 348-355.
[35] MIN B, NAM K C, AHN D U. Catalytic mechanisms of metmyoglobin on the oxidation of lipids in phospholipid liposome model system[J]. Food Chemistry, 2010, 123(2): 231-236.
[36] ESTEVEZ M, CAVA R. Lipid and protein oxidation, release of iron from heme molecule and colour deterioration during refrigerated storage of liver pate[J]. Meat Science, 2004, 68(4): 551-558.
[37] COLINDRES P, BREWER M S. Oxidative stability of cooked, frozen, reheated beef patties: effect of antioxidants[J]. Journal of the Science of Food and Agriculture, 2011, 91(5): 963-968.
[38] WANG W, WU N, ZU Yuangang, et al. Antioxidative activity ofRosmarinus officinalisL. essential oil compared to its main components [J]. Food Chemistry, 2008, 108(3): 1019-1022.
[39] ZHANG Ying, YANG Lei, ZU Yuangang, et al. Oxidative stability of sunflower oil supplemented with carnosic acid compared with synthetic antioxidants during accelerated storage[J]. Food Chemistry, 2010, 118 (3): 656-662.
Effect of Rosemary on Color Change and Antioxidant Stability of Fresh Pork
YING Li-sha,ZHAO Dong-fang,FU Yang,ZHANG Min*
(Chongqing Special Food Programme and Technology Research Center, College of Food Science, Southwest University, Chongqing 400715, China)
Two rosemary extracts with different carnosic acid contents (CAP05 and CAP20) were added to fresh pork. Samples were stored at 4 ℃ with illumination of standard supermarket fluorescent lamps for 8 days. CIEa* value, hue, oxymyoglobin, metmyoglobin, lipid and protein oxidation and sensory evaluation of fresh pork were investigated. Results showed that rosemary with 5% carnosic acid revealed better protective effect on fresh pork than rosemary with 20% carnosic acid. Moreover, r500, r1000 and R500 exhibited better protection against discoloration, lipid and protein oxidation during storage. The r500 had the least discoloration and odor at the end of storage. Statistical analysis showed a significant correlation of color CIEa* value with the contents of oxymyoglobin, metmyoglobin, TBARS and carbonyls (P<0.01).
rosemary;carnosic acid;antioxidation;color;pork
TS251.1
A
1002-6630(2012)05-0001-06
2011-10-21
“十二五”国家科技支撑计划项目(2011BAD36B02);农业部公益性行业(农业)科研专项(200903012)
应丽莎(1987—),女,硕士研究生,研究方向为食品包装材料及技术。E-mail:yls.214@163.com
*通信作者:张敏(1975—),男,副教授,博士,研究方向为食品包装材料及技术。E-mail:zmqx123@163.com
