盐胁迫富集发芽大豆γ-氨基丁酸的工艺优化
2012-10-25郭元新杨润强顾振新
郭元新,杨润强,陈 惠,宋 玉,顾振新,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.安徽科技学院食品药品学院,安徽 凤阳 233100)
盐胁迫富集发芽大豆γ-氨基丁酸的工艺优化
郭元新1,2,杨润强1,陈 惠1,宋 玉1,顾振新1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.安徽科技学院食品药品学院,安徽 凤阳 233100)
在单因素试验基础上,应用响应面试验研究氯化钠浓度、培养时间和培养温度对大豆发芽富集γ-氨基丁酸(γ-aminobutyric acid,GABA)的影响,目的是优化盐胁迫条件下发芽大豆富集GABA的最佳培养条件。研究结果表明:豆芽在盐胁迫条件下富集GABA的最优条件是氯化钠浓度133.5mmol/L、培养时间5.5d、培养温度33.3℃,在此条件预测的最高GABA富集量为1205.24μg/g。方差分析和验证实验显示,模型可准确的预测盐胁迫条件下大豆发芽过程中GABA的富集。
大豆;发芽;盐胁迫;γ-氨基丁酸富集;响应面试验
在中国及亚洲,发芽大豆作为人类的食物已有2000多年的历史。作为一种健康和时尚产品,豆芽在欧洲各国饮食生活中的重要性与日俱增[1]。大豆(Glycine maxL.)是一种质优价廉的优质蛋白质、碳水化合物、维生素和矿物质来源。众多研究表明,种子发芽过程中发生了大量复杂的生理生化变化[2-4],种子中的酶不断产生或被激活,一些大分子物质如淀粉和蛋白质被分解。控制发芽条件,还可生成和富集γ-氨基丁酸(γaminobutyric acid,GABA)等[3,5]大豆中原来含量低或不具有的功能成分。
GABA是一种以自由态广泛存在于原核生物和真核生物中的四碳非蛋白质氨基酸。因为GABA具有降血压,改善脑机能和缓解疼痛和焦虑等作用,富含GABA的食品近年来备受消费者欢迎[5-6]。已有的研究表明,植物中GABA的合成主要受GABA支路和多胺降解的影响,其中谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC 4.1.1.15)和二胺氧化酶(diamine oxidase,DAO,EC 1.4.3.6)分别是这两条途径中的限速酶[7-8]。
植物在热击、冷害、盐胁迫、机械刺激和低氧等胁迫条件下能够强烈的激活GAD和DAO的酶活性,从而导致GABA的积累[7,9],其中盐胁迫是一种安全,环保的胁迫方式。尽管目前已有学者研究了不同发芽条件下[1,10-11]、CO2处理[12]、低氧胁迫[13]和谷氨酸钠等条件[14]对大豆芽菜GABA富集的影响,但在发芽过程中应用盐胁迫的方式促进豆芽GABA的富集,目前还没有见到相关的报道。本研究利用响应面法优化盐胁迫条件下发芽大豆富集GABA的最优工艺条件,为芽菜科学和大豆资源的开发利用提供技术支持。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
Orion818型pH测试仪 美国Orion公司;1200型液相色谱仪 美国Agilent公司;TDL-40B型离心机 上海安亭科学仪器厂;DZF-6020型真空干燥器 上海一恒科技有限公司;PYX-DH-CBS型隔水电热恒温培养箱 上海跃进医疗器械厂;真空冷冻干燥系统 美国Labconce公司。
1.3 方法
1.3.1 单因素试验
大豆种子用去离子水清洗后,用1%的次氯酸钠溶液消毒15min,用去离子水冲洗至pH值中性,于去离子水中30℃浸泡4h。置于铺有两层滤纸的培养皿中,每8h喷氯化钠溶液(胁迫处理)或去离子水(对照)一次,于生化培养箱中暗发芽,具体操作如下:(1)样品分别置于20、25、30、35℃的培养箱内暗发芽,期间以100mmol/L氯化钠溶液进行盐胁迫处理;(2)样品分别用0、50、10、150mmol/L的氯化钠胁迫处理,发芽温度30℃;(3)样品用100mmol/L 氯化钠溶液进行胁迫处理,分别培养0、1、2、3、4、5、6d后取样测定其GABA含量。试验结束后,所有样品用去离子水清洗后用吸水纸吸干水分,液氮速冻后真空冷冻干燥,随后粉碎至过8 0目筛,待测。
1.3.2 Box-Behnken设计

表1 大豆发芽富集GABA的培养条件响应面试验因素及水平表Table 1 Factors and levels of RSM analysis
采用响应面试验优化大豆发芽富集GABA的培养条件,每个处理重复3次。在单因素试验的基础上,选取氯化钠浓度(X1)、培养时间(X2)和培养温度(X3)作为研究对象(表1),整个设计包括5个中心点共17个组合。以GABA含量(Y)作为响应值。优化结果将得出一个响应值(Y)与变量(Xi)间的二元多项回归模型。
1.3.3 GABA含量的测定
唐玄奘,前世为如来二弟子金蝉子,法号“玄奘”,被尊称为“三藏法师”,后世俗称“唐僧”,受大唐皇帝之托组建取经四人组,从东土大唐出发,到西天拜佛求取真经。唐僧作为整个取经团队的领袖,负责整个团队的经营和管理,和车间主任的岗位较为相似。每天要掌控车辆的维修进度,协调车间的日常管理工作,对那些不听话的人员不时还要念念“紧箍咒”。当然除了管理之外还要配合其他部门完成相应工作,关心自己团队人员的工作与生活困难,遇到问题时还要帮忙解决。总的来说唐僧的工作比较繁琐,需要由胆大心细、有责任心的人来做。
G A B A测定采用高压液相色谱法,色谱柱为ZORBAX Eclipse AAA reversed-phase column(3.5μm),4.6mm×150mm,条件参照Guo等[13]的方法。
1.3.4 统计分析
试验设3次重复,结果以“x-±s”表示。响应面设计及分析采用Design Expert软件(Version7.0.0,Stat-Ease Inc.,Minneapolis,MN,USA),P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 盐胁迫条件下发芽温度对发芽大豆GABA富集的影响
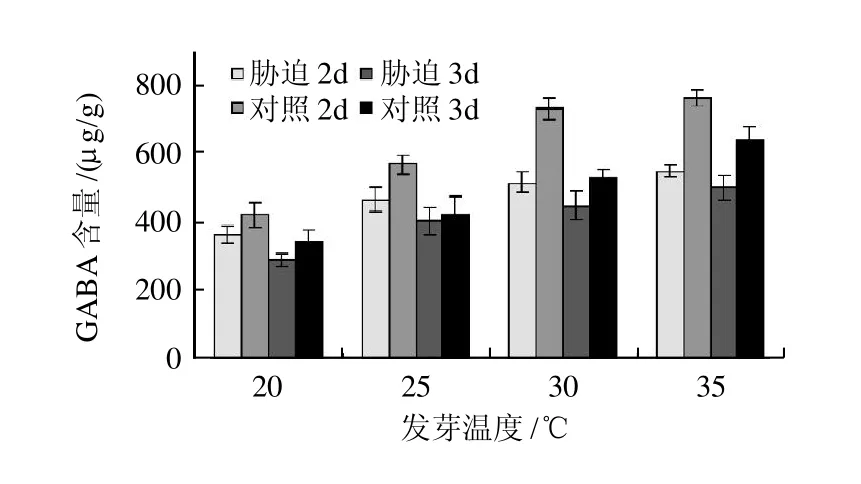
图1 盐胁迫条件下温度对发芽大豆GABA富集的影响Fig.1 Effect of temperature on GABA accumulation in germinated soybean under salt stress
如图1所示,发芽至2d时,在35℃的培养温度、盐胁迫处理条件下豆芽中GABA含量(以干质量计,下同)达556.12μg/g,分别为30、25、20℃条件下的1.06、1.17、1.47倍;发芽至3d时,盐胁迫处理组GABA含量则达765.13μg/g,分别为1.04、1.32、1.77倍,对照处理也呈现了相同的趋势。另外,大豆发芽至2d时,20~35℃各温度条件下,盐胁迫组GABA含量分别是非胁迫组的1.25、1.15、1.14倍和1.09倍,发芽至3d时则达到1.22、1.34、1.37倍和1.19倍。可见,在20~35℃温度范围内,温度越高越有利于豆芽积累GABA,各处理间差异极显著(P<0.01),且盐胁迫环境有利于GABA的富集。
2.2 氯化钠浓度对发芽大豆GABA富集的影响
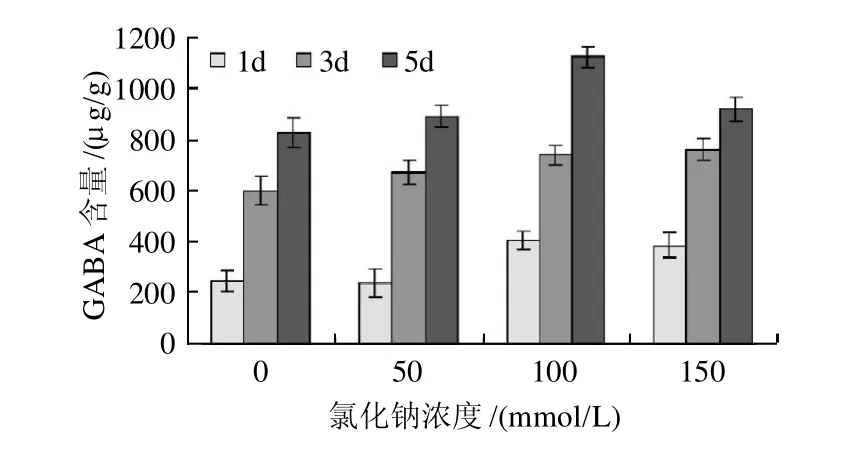
图2 氯化钠浓度对发芽大豆GABA富集的影响Fig.2 Effect of NaCl content on GABA accumulation in germinated soybean under salt stress
由图2可见,在同一发芽时点上,不同的氯化钠浓度对豆芽GABA的富集均有极显著影响(P<0.01)。浓度在0~100mmol/L变化时,豆芽中GABA含量升高,发芽5d后GABA含量达1121.8μg/g ,是对照(0mmol/L)处理的1.35倍,是原料的7倍(数据未显示)。当氯化钠浓度高于100mmol/L时,豆芽中GABA含量则呈下降的趋势,然而发芽1d和3d时,100mmol/L和150mmol/L的氯化钠处理间并未显著差异(P<0.05)。
2.3 盐胁迫条件下发芽时间对发芽大豆GABA富集的影响
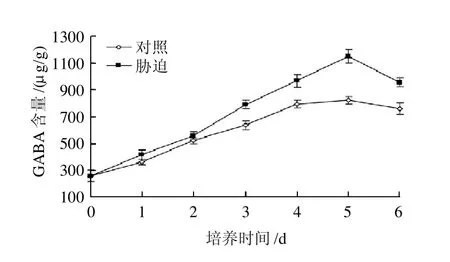
图3 培养时间对发芽大豆GABA富集的影响Fig.3 Effects of culture time on GABA accumulation in germinated soybean
如图3所示,培养时间对豆芽中GABA的富集具有极显著影响(P<0.01)。在盐胁迫条件下,随着培养时间的延长,豆芽中的GABA富集量逐步增长,在5d时达到最大值1145.5μg/g,是对照发芽5d后的1.40倍,是发芽前的4.4倍。发芽5d后,豆芽中GABA的富集有下降的趋势。
2.4 Box-Behnken试验模型的建立与方差分析
响应面设计和相应的试验数据见表2。用多元统计分析结果显示响应面的实验结果符合二次回归公式。描述GABA产量与各自变量关系的多项式公式如下:
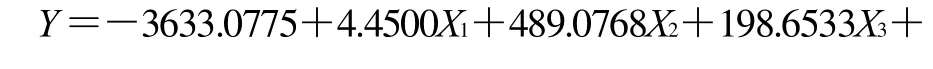
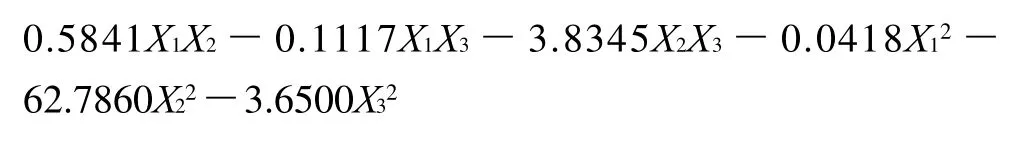
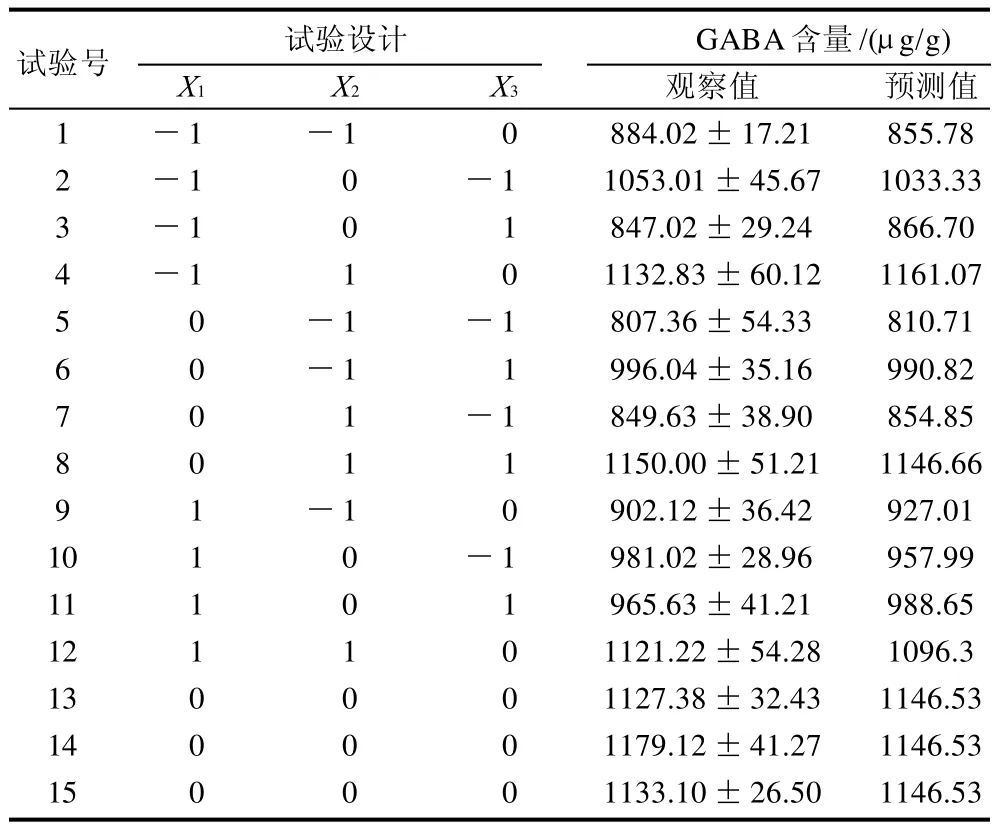
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken design and experimental results for GABA content from germinated soybean
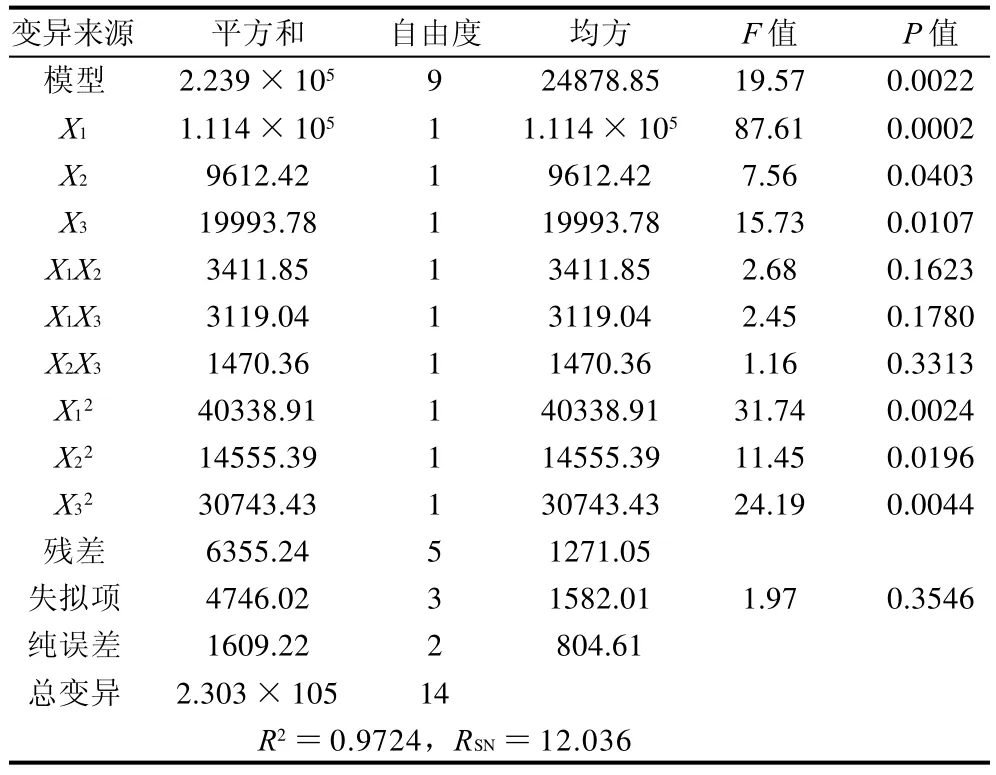
表3 回归方程各项的方差分析Table 3 Analysis of variance (ANOVA) for the regression equation
统计分析结果(表3)显示所建立的模型显著,决定系数(R2)为0.9724,测定值与预测值之间有极高的拟合度。对回归模型进行方差分析,F值为19.57,回归模型极其显著(P<0.005)。模型的失拟性检验不显著(P>0.05),说明二次模型相关性良好。比较模型的预测值和观察值(图4),其预测方程的决定系数为0.9724,二者具有极显著的相关性。模型的信噪比为12.036,其值远大于4。所有的统计分析特征值表明,模型具有实践指导意义。
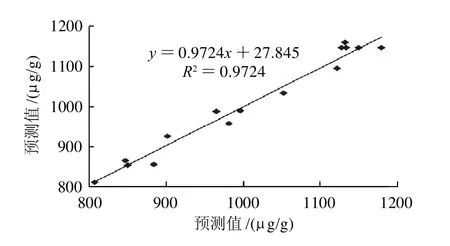
图4 预测值和观察值之间的相关性Fig.4 Correlation between predicted and experimental results of GABA content
2.5 盐胁迫条件下发芽大豆富集GABA的响应面分析及优化
为了确定发芽大豆富集GABA过程中各变量的最优水平和相互关系,利用回归方程可以构建试验因素之间的三维响应面图,利用响应面曲线,可以很容易的分析因素之间的变化关系。
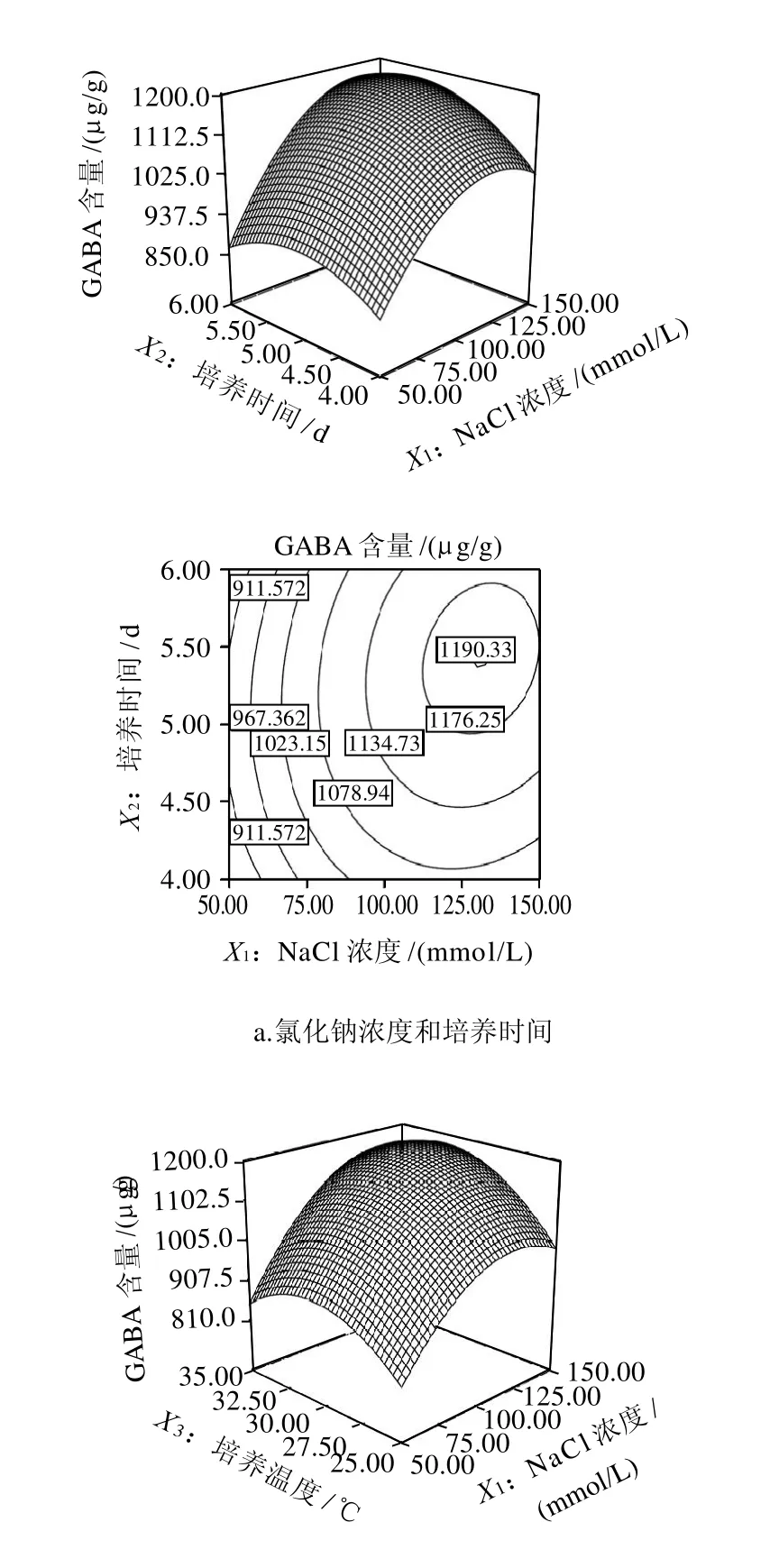

图5 各两因素交互作用对发芽大豆GABA含量影响的响应面及等高线图Fig.5 Response surface and contour plots for the effect of crossinteraction among factors on GABA accumulation in germinated soybean
图5a表示,在培养温度30℃条件下,氯化钠浓度和培养时间对GABA含量的影响。氯化钠浓度的一次项(P<0.005)和二次项(P<0.005)极显著影响GABA的含量,培养时间的一次项(P<0.05)和二次项(P<0.05)显著的影响大豆芽菜中GABA的含量,但氯化钠浓度和培养时间的交互作用不显著(P=0.1623)。在一定的氯化钠浓度条件下,GABA含量随着培养时间的延长增加,发芽5.5d时达到最高值。同样,在一定培养时间条件下,GABA含量随着氯化钠浓度的增加呈现快速的增加,在发芽5.5d后GABA的富集达到最大值,随后GABA含量缓慢下降。豆芽中GABA的富集受到氯化钠胁迫的影响,这与其他研究得出的盐胁迫使植物细胞胞内Ca2+浓度快速上升,从而诱导GAD活性上升[15],同时,盐胁迫还伴随着多胺的减少和DAO活性的增加[7],从而促进了植物中GABA的富集结果是一致的。
图5b表示大豆芽菜培养5d后,氯化钠浓度和培养温度对发芽大豆富集GABA的影响。培养温度的一次项(P<0.05)和二次项(P<0.005)显著影响GABA的产量,但氯化钠浓度和培养温度的交互作用不显著(P>0.05)。在固定氯化钠浓度的情况下,当培养温度从25℃增加到33.3℃时,豆芽中GABA含量快速增加,继续升高温度时,GABA含量下降,说明33.3℃的的胁迫温度有利于豆芽中GABA的富集。已有的研究表明,保持植物组织中GAD活性的最佳温度为40℃[16],较高的温度有利于大豆芽菜中DAD酶活性的提高,导致GABA的富集,这与我们的研究结论是一致的。但大豆是适合生长在北方的耐寒性较强的作物,当温度达到40℃时(数据未显示),豆芽的生长受到抑制,芽体变软,最后会使豆芽萎缩直至死亡。
图5c显示了培养时间和温度对发芽大豆GABA含量的影响。模型分析表明,二者的交互作用不显著(P>0.05)。在固定的培养温度条件下,随着培养时间的增加,GABA的含量上升,优化的培养时间为5.5d,这与固定氯化钠浓度条件下培养时间的变化趋势一致。在固定的培养时间条件下,随着温度的增加,GABA的含量上升,优化的培养温度为33.3℃,和固定氯化钠浓度条件下GABA随培养温度的变化相一致。
2.6 工艺条件优化及验证实验
根据响应面试验结果,运用试验模型得到发芽大豆富集GABA的最佳培养条件为氯化钠浓度133.5mmol/L、培养时间5.5d、培养温度33.3℃,在此条件下,GABA含量达到1197.36μg/g。
为考察模型的可靠性和准确性,随机选择最佳试验组合和任一试验组合进行验证性实验,验证实验的设计与结果列于表4。在优化的试验条件下,发芽大豆中GABA的含量最高,达到1197.36μg/g,这与预测值的1205.24μg/g接近,任意组合试验也显示了同样的预测性,验证实验结果进一步证明响应面模型优化试验结果是可靠的。
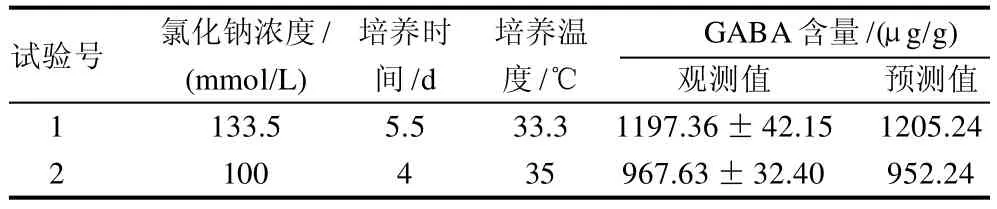
表4 验证实验结果Table 4 Results of validation tests
3 结 论
在单因素试验基础上,采用响应面分析法优化盐胁迫处理富集大豆芽菜GABA的培养条件。结果表明:氯化钠浓度、培养时间、培养温度对大豆芽菜GABA富集的影响极显著,交互项均不显著。盐胁迫条件下大豆发芽富集GABA的最优条件为氯化钠浓度133.5mmol/L、培养时间5.5d、培养温度33.3℃,在此条件预测的最高GABA富集量为1025.24μg/g,而实际实验测得的GABA富集量为1197.36μg/g,其相关系数极显著(P<0.01)。研究结果表明,大豆是生产富含GABA食品的优质原料,盐胁迫可显著提高豆芽中GABA的富集量。
[1] MARTINEZ-VILLALUENGA C, KUO Y H, LAMBEIN F, et al.Kinetics of free protein amino acids, free non-protein amino acids and trigonelline in soybean (Glycine maxL.) and lupin (Lupinus angustifoliusL.) sprouts[J]. European Food Research and Technology, 2006, 224(2):177-186.
[2] SIERRA I, VIDAL-VALVERDE C. Kinetics of free and glycosylated B-6 vitamers, thiamin and riboflavin during germination of pea seeds[J].Journal of the Science of Food and Agriculture, 1999, 79(2): 307-310.
[3] XU Maojun, DONG Jufang, ZHU Muyuan. Effects of germination conditions on ascorbic acid level and yield of soybean sprouts[J]. Journal of the Science of Food and Agriculture, 2005, 85(6): 943-947.
[4] BAU H M, VILLAUME C, NICOLAS J P, et al. Effect of germination on chemical composition, biochemical constituents and antinutritional factors of soya bean (Glycine max) seeds[J]. Journal of the Science of Food and Agriculture, 1997, 73(1): 1-9.
[5] VIDAL-VALVERDE C, FRIAS J, SIERRA I, et al. New functional legume foods by germination: effect on the nutritive value of beans,lentils and peas[J]. European Food Research and Technology, 2002, 215(6): 472-477.
[6] ABDOU A M, HIGASHIGUCHI S, HORIE K, et al. Relaxation and immunity enhancement effects ofγ-Aminobutyric acid (GABA) administration in humans[J]. Biofactors, 2006, 26(3): 201-208.
[7] SU Guoxing, YU Bingjun, ZHANG Wenhua, et al. Higher accumulation ofγ-aminobutyric acid induced by salt stress through stimulating the activity of diarnine oxidases inGlycine max(L.) Merr. roots[J]. Plant Physiology and Biochemistry. 2007, 45(8): 560-566.
[8] BOUCHE N, FROMM H. GABA in plants: just a metabolite?[J].Trends in Plant Science, 2004, 9(3): 110-115.
[9] BOUCHE N, LACOMBE B, FROMM H. GABA signaling: a conserved and ubiquitous mechanism[J]. Trends in Cell Biology, 2003, 13(12): 607-610.
[10] KUO Y H, ROZAN P, LAMBEIN F, et al. Effects of different germination conditions on the contents of free protein and non-protein amino acids of commercial legumes[J]. Food Chemistry, 2004, 86(4): 537-545.
[11] MATSUYAMA A, YOSHIMURA K, SHIMIZU C, et al. Characterization of glutamate decarboxylase mediatingγ-aminobutyric acid increase in the early germination stage of soybean (Glycine maxL. Merr)[J]. Journal of Bioscience and Bioengineering, 2009, 107(5): 538-543.
[12] KATAGIRI M, SHIMIZU S.γ-aminobutyric acid accumulation in bean sprouts (soybean, black gram, green gram) treated with carbon dioxide[J]. Nippon Shokuhin Kagaku Kougaku Kaishi, 1989, 36(11):916-919.
[13] GUO Yuanxin, CHEN Hui, SONG Yu, et al. Effects of soaking and aeration treatment onγ-aminobutyric acid accumulation in germinated soybean (Glycine maxL.)[J]. European Food Research and Technology,2011, 232(5): 787-795.
[14] 毛健, 马海乐. 大豆发芽富集γ-氨基丁酸的工艺优化[J]. 食品科学,2009, 30(24): 227-331.
[15] REDDY V S, REDDY A S N. Proteomics of calcium-signaling components in plants[J]. Phytochemistry, 2004, 65(12): 1745-1776.
[16] ZHANG Hui, YAO Huiyuan, CHEN Feng, et al. Purification and characterization of glutamate decarboxylase from rice germ[J]. Food Chemistry,2007, 101(4): 1670-1676.
Optimization of GABA Accumulation Process of Germinated Soybean under Salt Stress
GUO Yuan-xin1,2,YANG Run-qiang,CHEN Hui1,SONG Yu1,GU Zhen-xin1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. College of Food and Drug, Anhui Science and Technology University, Fengyang 233100, China)
Based on the single factor tests, the effects of NaCl content, culture time and culture temperature onγ-aminobutyric acid (GABA) accumulation during the germination of soybean (Glycine maxL.) were explored by response surface methodology(RSM). The objective of this study was to optimize the culture conditions for GABA production in germinated soybeans under salt stress. The results showed that the optimal conditions with salt stress for GABA accumulation in germinated soybean were NaCl content of 133.5 mmol/L, culture time of 5.5 days and culture temperature of 33.3 ℃. Under the optimal conditions, the predicted highest GABA yield was up to 1205.24 μg/g. Analysis of variance and validation experiments for the regression model suggested that the model could accurately predict GABA accumulation in germinated soybean under salt stress.
soybean;germination;salt stress;γ-aminobutyric acid accumulation;response surface methodology
TS201.1
A
1002-6630(2012)10-0001-05
2011-05-10
国家自然科学基金面上项目(31071581);中央高校基本科研业务费专项 (KYZ200917)
郭元新(1970—),男,副教授,博士,研究方向为生物技术与食品资源高效利用。E-mail:guoyuanxiner@163.com
*通信作者:顾振新(1956—),男,教授,博士,研究方向为农产品加工。E-mail:guzx@njau.edu.cn
