高效液相色谱法测定西兰花中萝卜硫素的研究
2012-10-25顾颖娟陈志刚韩永斌顾振新
顾颖娟,张 亮,邹 宇,陈志刚,韩永斌,顾振新
(南京农业大学食品科技学院,江苏南京 210095)
高效液相色谱法测定西兰花中萝卜硫素的研究
顾颖娟,张 亮,邹 宇,陈志刚,韩永斌,顾振新*
(南京农业大学食品科技学院,江苏南京 210095)
建立了采用高效液相色谱法(HPLC)测定西兰花种子及芽苗中萝卜硫素的方法。具体方法为:采用反相XDB-C18色谱柱分离,乙腈-水梯度(10%-60%-100%,0-25-30min)洗脱,流速0.6mL/min,检测波长254nm,进样量50μL。萝卜硫素测定结果的相对标准偏差小于1%,平均回收率达到97.14%。该方法具有较好的分离效果和较高的稳定性,适用于西兰花中萝卜硫素含量的测定。
西兰花,高效液相色谱法,萝卜硫素,测定
西兰花(Brassica oleracea var.italics)系十字花科芸薹属蔬菜,它的种子和植株中均含有硫苷,在内源酶作用下可水解得到异硫氰酸酯类物质,其中以萝卜硫素(1-异硫氰基-4-甲基亚磺酰基丁烷,sulforaphane)最受人们关注[1-2]。目前,萝卜硫素被认为是最有效的植物源抗癌活性物质之一[2]。它能诱导机体产生II型解毒酶,通过提高机体代谢致癌物和抗氧化能力,诱导癌细胞程序性凋亡并起到化学防癌功能。萝卜硫素分子结构中-N=C=S基团具有很强的亲电子能力,与氨基、羟基、硫醇、β-羰基、羧酸等亲核试剂发生加成反应,生成相应的硫脲[2]。早期用于检测萝卜硫素含量的方法主要有硝酸银滴定法、对羟基汞基苯甲酸滴定法[3]、哌啶滴定法、吗啉滴定法、紫外分光光度法等[4]。此外,也可通过释放萝卜硫素结构中的S并采用硫酸钡沉淀法[5]检测微量的萝卜硫素。目前,常见的萝卜硫素的分析方法主要有薄层色谱法(TLC)、纸色谱法(PC)和气相色谱法(GC)等。这些方法都存在不同程度的局限性,如薄层色谱和纸色谱法操作繁琐、耗时长、重复性差;气相色谱法的高温条件会使萝卜硫素部分降解,导致结果不准确[6-8]。HPLC法已被证明是一种检测西兰花中萝卜硫素含量的有效方法,但在提取步骤、分离效果以及检测灵敏度和回收率等方面仍需改进[9-12]。本实验针对以上问题,对HPLC法测定萝卜硫素的提取方法、色谱柱和色谱条件等进行了研究,旨在建立一种简单、快速、精密的萝卜硫素测定方法,为富含萝卜硫素芽苗食品的质量控制和综合开发提供参考依据。
1 材料与方法
1.1 材料与仪器
西兰花种子 购自南京金盛达种子公司,品种为绿领香80d;萝卜硫素 标准品,CAS号:4478-93-7,Sigma公司;甲醇 色谱纯,南京化学试剂有限公司;其余化学试剂 上海国药集团。
液相色谱仪 Agilent1200 美国安捷伦公司; DZF-6020型真空干燥器 上海一恒科技有限公司; LG10-2.4A型高速离心机 北京医用离心机厂; ZFA-1型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 标准溶液配制 取5mg萝卜硫素标准品,准确定容至10mL的10%乙腈中,得浓度为0.5mg/mL的萝卜硫素标准品溶液。再分别配制浓度为0.00、0.10、0.20、0.30、0.40、0.50mg/mL的萝卜硫素标准液,4℃保存一个月。
1.2.2 萝卜硫素提取 西兰花种子在无光照条件下发芽48h,经冷冻干燥后研成粉末。取样品1.0g,用5mL正己烷脱脂3次,挥干,加入3mL去离子水,混匀后35℃水浴2h,加入1g氯化钠,用等体积的乙酸乙酯萃取3次,合并萃取液并35℃旋转蒸发至黄油状液体(或蒸干),用1mL 10%乙腈溶解残留液,过0.45μm滤膜,待用。
1.2.3 色谱条件 采用反相SB-C18或反相XDB-C18色谱柱分析,乙腈-水梯度洗脱,流速0.6mL/min,检测波长254nm。乙腈-水梯度洗脱时,采用以下3种参数:30%-80%-100%,0-10-12min,乙酸乙酯为溶剂;40%-100%,0-20min,乙酸乙酯为溶剂;10%-60%-100%,0-25-30min,溶剂为10%乙腈。
2 结果与分析
2.1 色谱柱和色谱条件的选择
2.1.1 SB-C18色谱柱分析 反相SB-C18色谱柱适用在低pH下分离蛋白质、多肽、维生素类物质等,具有较宽的pH适用范围,常用于酸性、碱性和极性化合物的分离。SB-C18色谱柱具有亲水性表面,可以有效地防止固定相的塌陷,在高水分含量流动相中有强保留作用。本研究采用两种不同的乙腈-水梯度洗脱方法(0%-80%-100%,0-10-12min和40%-100%,0-20min),萝卜硫素标准品分离效果较为理想(图1、图2),但是,两种洗脱方法均未将西兰花种子和芽苗中的萝卜硫素与其他硫代葡萄糖苷水解产物分离开。
2.1.2 XDB-C18色谱柱分析 反相XDB-C18色谱柱主要适用于中性及酸性化合物的分离,可在pH 2~9的宽pH范围内提供良好的峰形。采用10%乙腈水溶液溶解种子和芽苗萃取物,采用反相XDB-C18色谱柱分离,流动相组成为乙腈和水,梯度洗脱,浓度范围为10%-60%-100%,洗脱时间为0-25-30min,流速为0.6mL/min,紫外检测器254nm,萝卜硫素出峰时间为15.5min(图3)。实验结果表明,采用以上色谱柱和色谱条件,可从硫代葡萄糖苷的酶解液中分离出多种化合物,无拖尾、肩峰等现象,可有效的将西兰花种子和芽苗中的萝卜硫素与其他硫代葡萄糖苷水解产物分离开,可用于西兰花中萝卜硫素的分析测定。
2.2 标准曲线制作
采用XDB-C18色谱柱层析分离,以萝卜硫素质量为横坐标,峰面积为纵坐标,制作萝卜硫素HPLC标准曲线,得回归方程为y=519.81x,R2=0.9999,萝

图1 反相SB-C18色谱柱分析萝卜硫素Fig.1 Sulforaphane analysis with reversed SB-C18column
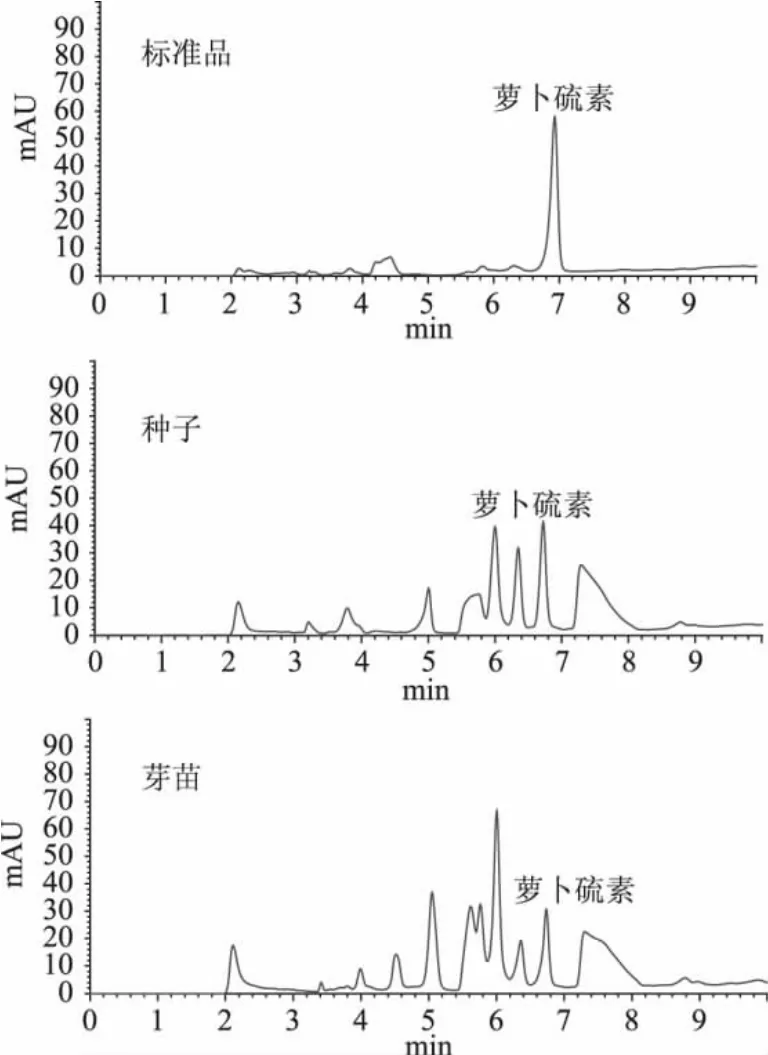
图2 反相SB-C18色谱柱分析萝卜硫素Fig.2 Sulforaphane analysis with reversed SB-C18column
2.3 回收率实验
加标回收率实验(表1)表明,萝卜硫素的平均回收率为97.14%,RSD为2.94%(n=3),表明该方法具有较高的加标回收率。

表2 精密度检验Table 2 Precision inspection

图3 XDB-C18色谱柱分离检测萝卜硫素Fig.3 Separation and detection of sulforaphane with XDB-C18column
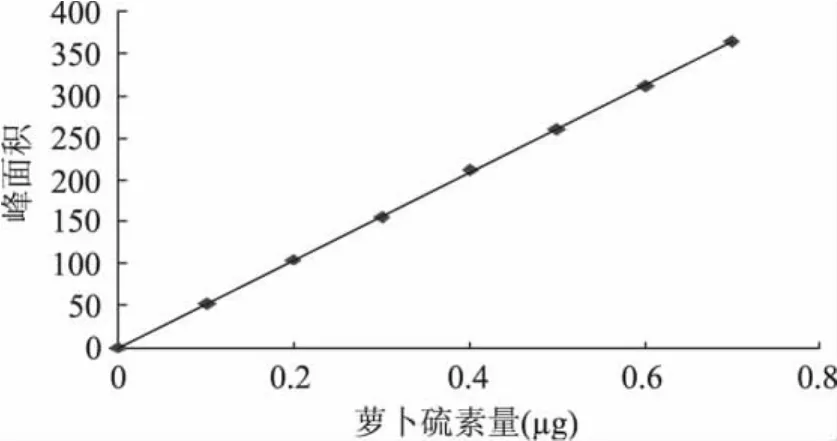
图4 萝卜硫素HPLC峰面积标准曲线Fig.4 Standard curve of sulforaphane HPLC peak area

表1 加标回收实验Table 1 Spiked recovery experiment
2.4 精密度实验
精密度实验结果(表2)表明,对不同浓度的样品,RSD小于1%(n=6),表明该方法精密度较好。
3 结论
采用HPLC法检测西兰花种子中萝卜硫素含量虽有报道,但缺陷依然明显。由于有机溶剂从西兰花种子酶解液中萃取萝卜硫素时存在脂肪、糖类、可溶性蛋白、色素和其他硫苷水解物等干扰,导致分离效果差、基线过高等问题。本研究采用多次液-液萃取纯化技术对西兰花种子及芽苗样品进行预处理,提取西兰花种子及芽苗中萝卜硫素。在此基础上,选用反相XDB-C18色谱柱对含萝卜硫素的10%乙腈提取液进行定性定量测定,取得了较好的分析结果。该方法不仅适用于西兰花种子及芽苗中萝卜硫素的分析,也可用于硫苷酶解物中其他组分的分析。
[1]Fenwick GR,Heaney RK,Mullin WJ.Glucosinolates and their breakdown products in food and food plants[J].Critical Reviews in Food Science and Nutrition,1983,18:123-201.
[2]Zhang Y,Kensler TW,Cho CG,et al.Anticarcinogenic activitiesofsulforaphane and structurally related synthetic norbornyl isothiocyanates[J].Process of the National Academy of Sciences of the United States of America,1994,91(8):3147-3150.
[3]Nakamura Y,Miyoshi N.Electrophiles in foods:The current status of isothiocyanates and their chemical biology[J].Bioscience Biotechnology and Biochemistry,2010,74(2): 242-255.
[4]Josefsson E.Method for quantitative determination of phydroxybenzyl isothiocyanate in digests of seed meal ofSinapis albaL.[J].Journal of the Science of Food and Agriculture,1968,19(4):192-194.
[5]姜子涛,李荣.快速测定芥末油中ITCs的含量[J].中国调味品,1992(8):29-30.
[6]Raghavan B,Shankaranarayana ML,Nagalakshmi S,et al.Volumetric determination of p-hydroxybenzyl isothiocyanate in sinalbin(p-hydroxybenzylglucosinolate)and in white mustard seed(Sinapis AlbaL)[J].Journal of the Science of Food and Agriculture,1971,22(10):523-525.
[7]胡晔,梁浩,袁其朋.十字花科植物种子中莱菔硫烷的薄层色谱鉴别[J].北京化工大学学报,2006,33(2):33-36.
[8]吴元峰,毛建卫,袁海娜,等.气质联用分析芸苔属种子水解液中的异硫氰酸盐[J].分析实验室,2008,27(9):53-56.
[9]吴元锋,沈莲清,毛建卫,等.芸苔属植物种子中萝卜硫素的提取工艺研究[J].食品与生物技术学报,2009,28(5): 647-651.
[10]Liang H,Yuan QP,Dong HR,et al.Determination of sulforaphane in broccoli and cabbage by high-performance liquid chromatography[J].Journal of Food Composition and Analysis,2006,19(5):473-476.
[11]Bertelli D,Plessi M,Braghiroli D,et al.Separation by solid phase extraction and quantification by reverse phase HPLC of sulforaphane in broccoli[J].Food Chemistry,1998,63(3): 417-421.
[12]Nakagawa K,Umeda T,Higuchi O,et al.Evaporative lightscattering analysis of sulforaphane in broccoli samples:Quality of broccoli products regarding sulforaphane contents[J].Journal of agricultural and food chemistry,2006,54(7):2479-2483.
Study on determination method of sulforaphane in broccoli by HPLC
GU Ying-juan,ZHANG Liang,ZOU Yu,CHEN Zhi-gang,HAN Yong-bin,GU Zhen-xin*(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
A high performance liquid chromatograph(HPLC)method had been set up for determination of content of sulforaphane in broccoli seeds and buds.The chromatographic separation was achieved on reversed XDB-C18using acetonitrile-water as the mobile phase(10%-60%-100%,0-25-30min)at a flow rate of 0.6mL/min.The detector wavelength was set at 254nm and the injection volume used was 50μL.The relative standard deviation of sulforaphane content determinated was less than 1%and the average recovery was 97.14%.This method showed good separation effect and high stability,and could be used for determining the content of sulforaphane in broccoli.
broccoli;HPLC;sulforaphane;determination
TS255.1
A
1002-0306(2012)04-0080-04
2011-03-01 *通讯联系人
顾颖娟(1988-),女,硕士研究生,研究方向:食品中功能成分的富集技术。
江苏省科技支撑计划项目(BE2006309)。
