重组海藻糖合酶工程菌高密度发酵条件的研究
2012-10-25杨丽维陈晓云李明春
陈 颖,杨丽维,齐 欣,陈晓云,李明春,唐 柳,张 峻,*
(1.天津市林业果树研究所,天津 300112;2.南开大学微生物学系,天津 300071)
重组海藻糖合酶工程菌高密度发酵条件的研究
陈 颖1,杨丽维1,齐 欣1,陈晓云1,李明春2,唐 柳1,张 峻1,*
(1.天津市林业果树研究所,天津 300112;2.南开大学微生物学系,天津 300071)
目的:通过对前期构建的海藻糖合酶基因工程菌进行高密度发酵的研究,获得了其高密度工艺条件。方法:采用摇瓶发酵和10L自控罐高密度发酵研究了培养基、pH、发酵方式对工程菌生长及目的蛋白表达的影响,并考察了工程菌中重组质粒的遗传稳定性。结果:海藻糖合酶基因工程菌高密度发酵的培养基为2YT+0.2%葡萄糖,最适pH为7.0,发酵方式为分批补料,通过10L自控罐高密度发酵最终得到的工程菌细胞密度达到了50.78g/L,酶活达到了3.197U/mL。所构建的重组质粒在宿主中得到了稳定遗传。结论:优化了海藻糖合酶基因工程菌高密度发酵的条件,为海藻糖规模化生产奠定了基础。
海藻糖合酶,基因工程菌,高密度发酵
海藻糖合酶单酶法生产海藻糖,由于具有严格的底物专一性,原料易得,产物组成简单等特点成为近几年酶法生产海藻糖的研究热点[1]。海藻糖合酶由日本株式会社林原生物化学研究所首先发现[2],随后,Tsusaki等人利用放射性探针筛选基因组DNA文库的方法,分别从Pimelobacter sp.R48和水生栖热菌(Thermus aquaticus ATCC33923)中克隆得到了海藻糖合酶的基因[3-4],这是最早的对海藻糖合酶基因的报道。随后不久,De Smet等人克隆了结核分枝杆菌的海藻糖合酶,并在大肠杆菌中实现了异源表达[5]。目前,来源于多种菌株的海藻糖合酶基因均已在大肠杆菌中实现了表达。然而产海藻糖合酶基因工程菌普遍存在的产酶水平较低、酶制备成本较高等不利因素,限制了其工业化应用。基因工程菌(细胞)的高密度发酵是外源基因实现高水平表达,获得大量外源基因产物的重要工艺技术。高密度发酵技术不仅可减少培养体积,强化下游分离提取,还可以缩短生产周期,减少设备投资从而降低生产成本,极大地提高其在市场上的竞争力[6]。但外源蛋白的表达水平受宿主细胞、重组体的稳定性、培养基成分、培养方式、培养条件以及培养过程中抑制性代谢产物的积累等多种因素的影响,能否实现高密度培养及高目标产物浓度,是工程菌能否以较低成本实现规模生产的决定性因素。蒙健宗、黄日波等人利用pH-stat法对重组海藻糖合酶工程菌进行40L发酵罐分批补料发酵,最终获得的细胞密度为51.5g/L,是分批培养的7.5倍。诱导后重组海藻糖合成酶表达率为15.2%,单位体积内的表达量是分批培养的4.5倍[7]。本项目组从一株红色亚栖热菌中克隆得到了海藻糖合酶基因[8],并利用混合质粒PCR筛选的方法获得了其全长基因,构建了含有海藻糖合酶基因的大肠杆菌质粒(PET21TreS),并将其转化到大肠杆菌BL21a中,得到了重组海藻糖合酶的基因工程菌[9]。本文以该工程菌为生产菌株,对其进行高密度发酵条件的优化和研究。

表1 7种不同培养基组成成分Table 1 Different components of seven culture mediums
1 材料与方法
1.1 材料与设备
海藻糖合酶基因工程菌(PET21TreS/BL21(DE3)) 南开大学生命科学院构建,-20℃甘油冻干保存;平板培养基 LB固体培养基加终浓度100μg/mL的氨苄青霉素;种子培养基 LB液体培养基加终浓度100μg/mL的氨苄青霉素;高密度发酵培养基 选取大肠杆菌发酵常用培养基,并通过改良,比较了7种不同组分的培养基(见表1)对海藻糖合酶基因工程菌高密度发酵的细胞密度与酶活的影响;补料培养基 胰蛋白胨 128g/L,酵母粉 80g/L,硫酸镁10g/L,葡萄糖448g/L;胰蛋白胨、酵母粉、氨苄青霉素、IPTG、咪唑 北京鼎国昌盛生物技术有限公司;葡萄糖 天津光复科技发展有限公司,分析纯;泡敌 天津开发区乐泰化工有限公司,分析纯。
10-100L自控发酵罐 镇江东方生物工程设备技术有限公司;智能型超声波细胞粉碎机 上海之信仪器有限公司;恒温振荡器 太仓市科教器材厂;电子显微镜 日本HITACHI公司;超净工作台 天津医疗净化设备厂;高速冷冻离心机 湘仪离心机公司;双光束紫外可见分光光度计 北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 海藻糖合酶基因工程菌摇瓶发酵条件的确定
1.2.1.1 高密度发酵培养基的筛选 种子液制备:挑取一阳性转化菌落接种于5mL含100μg/mL氨苄青霉素的种子培养基中,37℃,过夜培养。发酵培养:按1%接种量将种子液分别接种至7种不同发酵培养基中(500mL三角瓶装液 100mL),37℃,pH7.0发酵培养。按照 pH-stat法,定时补料2mL。发酵20h后,加入终浓度1.0mmol/L的IPTG溶液,37℃,pH7.0条件下诱导4h。定时取样测葡萄糖浓度、细胞密度及酶活。
1.2.1.2 发酵方式对细胞密度及酶活的影响 分批发酵:按1%接种量将种子液接种至100mL 2YT培养基中(装于500mL三角瓶中),发酵50h,定时取样测细胞密度。分批补料发酵:按1%接种量将种子液接种至100mL 2YT培养基中(含0.2%葡萄糖),定时取样测葡萄糖浓度,当初始葡萄糖耗尽后开始补料。按pH-stat法补料,定时取样测细胞密度,并通过光学显微镜观察菌体生长状况。
1.2.1.3 高密度发酵最适pH 按1%接种量将种子液分别接种至 pH 为6.0、6.5、7.0、7.5、8.0不同条件下的2YT+葡萄糖发酵培养基中(500mL三角瓶装液100mL),37℃发酵培养。按照pH-stat法,定时添加补料液。定时取样测细胞密度和酶活。
1.2.2 10L自控发酵罐高密度发酵
1.2.2.1 种子液的制备 一级种子液:取平板上阳性转化的单个菌落接于5mL含终浓度100μg/mL氨苄青霉素的LB液体培养基中,37℃过夜培养。二级种子液:将上述一级种子液离心清洗后以1%的接种量接于100mL含终浓度100μg/mL氨苄青霉素的LB液体培养基中,37℃培养至OD600在0.6~0.8,备用。
1.2.2.2 10L自控式发酵罐培养条件 10L发酵罐装发酵培养基4L,将种子液按2.5%接种量接入,保持罐温 37℃、pH7.0、罐压 0.05MPa、搅拌速率 500~600r/min、通气量 6~7L/min,通过 pH-stat法控制补料,定时取料检测。
1.2.2.3 质粒稳定性研究[10]分别于 3、12、20、26h取样,考察不同时间不同条件下质粒的缺失率,来判定质粒的稳定性。取一接种环发酵液溶于3mL的LB液体培养基中,适当稀释后取40μL涂LB平板,37℃过夜培养后,挑取100个单菌落于含终浓度100μg/mL氨苄青霉素的LB平板上,37℃培养16h后,计算菌落个数。
质粒稳定性(%)=添加Amp平板上的菌落数/不添加Amp平板上的菌落数×100
1.3 分析方法
1.3.1 生物量分析(OD600) 取0.5mL发酵液定量稀释后于600nm处测吸光度。
1.3.2 葡萄糖含量测定 葡萄糖标准曲线法。
1.3.3 酶活测定 将发酵后的粗酶液超声破碎后,将1mL粗酶液加入到1mL以pH7.0、10mmol/L的磷酸缓冲液配制的2%(w/v)的海藻糖溶液中,50℃反应60min,然后于100℃加热10min中止酶反应。反应混合物冷却后12000r/min离心10min,取上清液用0.22μm的滤膜过滤,用高效液相色谱法测定生成的海藻糖含量。
酶活力单位定义为:在上述反应条件下,每分钟形成1μmol海藻糖所需的酶量定义为1U。
2 结果与讨论
2.1 高密度发酵培养基
实验通过摇瓶发酵对7种大肠杆菌常用培养基(见表1)进行了实验比较,发现以2YT加0.2%葡萄糖为发酵培养基时,工程菌的细胞密度和酶活均高于其它7种培养基(图1~图2)。实验结果显示,在培养基中加入一定浓度的葡萄糖有助于菌体的生长,尤其在菌体生长的中后期,细胞密度较未加葡萄糖的提高35%,这说明海藻糖合酶基因工程菌在生长阶段,尤其是对数生长期对碳源和氮源的需求量比较大,而2YT培养基富含丰富的氮源,再加入一定量的葡萄糖,能满足菌体快速生长的需要。
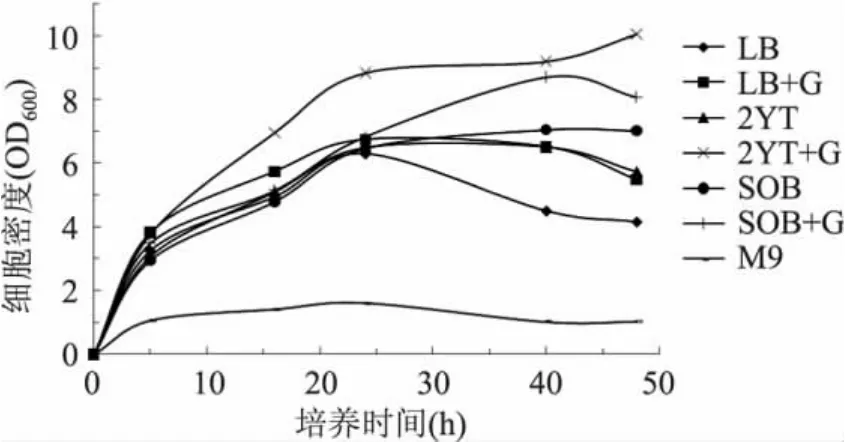
图1 不同培养基发酵培养的细胞密度Fig.1 The cell density after different culture medium fermentation
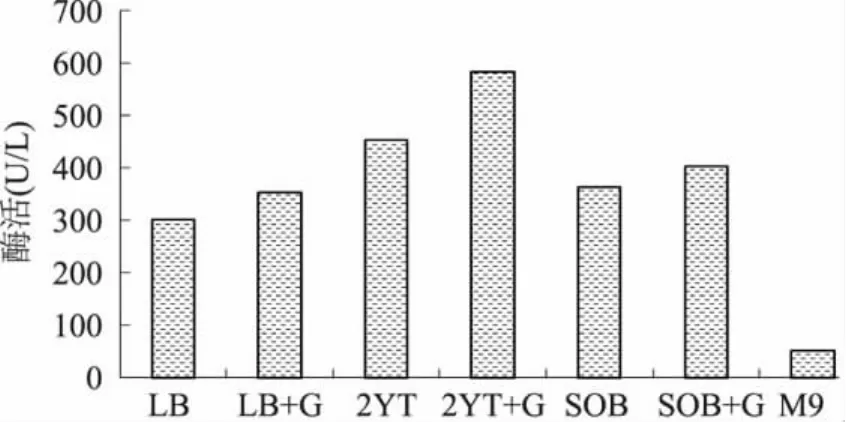
图2 不同培养基发酵培养后的酶活Fig.2 The enzyme activity after fermentation in different medium
2.2 发酵方式的比较
实验对分批发酵与分批补料发酵进行了比较(图3),分批补料培养过程中,实验采用了pH-stat法通过对发酵液进行定时补料和加碱,始终控制发酵液pH维持在7.0左右。取样检测结果显示,分批发酵的细胞密度生长速度很快,但20h后呈现出下降趋势,而分批补料发酵前期缓慢生长,但最高细胞浓度明显大于分批发酵。经进一步镜检发现,24h后分批发酵菌体有自溶现象(图4),而分批补料由于连续不断地为菌体生长提供了丰富的碳源和氮源,24h后菌体仍保持正常分裂(图5)。

图3 不同发酵方式下菌体的生长情况Fig.3 Cell growth after different fermentation mode culture

图4 分批发酵24h后菌体生长情况Fig.4 The bacterial growth after batch fermentation 24h

图5 分批补料发酵24h后菌体生长情况Fig.5 The bacterial growth after fed-batch fermentation 24h
2.3 最适pH
实验分别于发酵5、24、31、48h取样比较不同pH下(pH 分别为 6.0、6.5、7.0、7.5、8.0)菌体生长情况及酶活大小(见图6~图7),发现pH7.0时细胞密度及酶活均优于其他pH条件,因此后面的实验均采用7.0作为发酵pH。
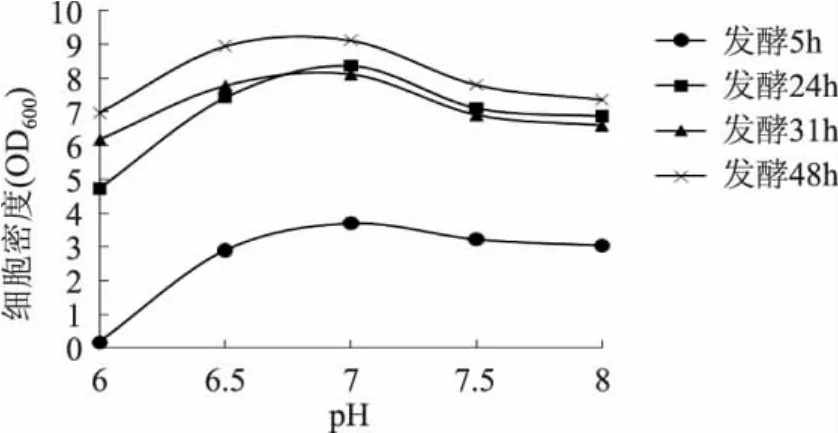
图6 不同时间不同pH培养的细胞密度(OD600)Fig.6 The cell density after different time and different pH fermentation
2.4 10L自控罐分批补料发酵条件
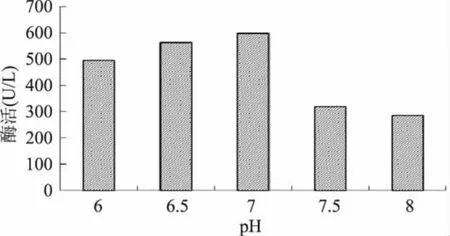
图7 不同pH发酵培养48h后的酶活Fig.7 The enzyme activity after different pH fermentation 48h
实验采用10L自控式发酵罐,装料量为4L,通气量为7L/min,pH7.0,保持罐温 37℃,罐压 0.05MPa,搅拌速率500~600r/min,消泡以泡敌手动消泡,其余条件均为自动控制。按照发酵过程中发酵液的pH变化设定补料时间,补料采用连续流加的方式,培养24h后收集发酵液备用。
2.4.1 海藻糖合酶工程菌高密度发酵过程中pH及溶解氧的变化 发酵过程中采用pH-stat法,设定初始pH为7.0,发酵罐装液量为4L,通气量为6L/min,罐温始终保持在37℃,罐压始终保持在0.05MPa。发酵初始,发酵液pH始终呈下降趋势,表明菌体充分利用了发酵液中的初始葡萄糖,并产生了发酵副产物乙酸使得发酵液pH下降,实验通过自动添加15%氨水调整pH为7.0。发酵至240min左右,发酵液pH持续上升(每分钟上升0.01)。取样测葡萄糖浓度后发现,发酵液中的初始葡萄糖已基本耗尽。而此时菌体生长代谢产生的铵离子使发酵液的pH持续升高。此时通过连续流加补充葡萄糖和氮源,使得菌体重新利用葡萄糖并产生乙酸使发酵液pH回落至7.0。补料20h后停止补料,以致发酵后期pH持续上升(见图8)。
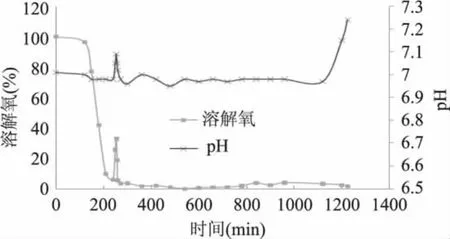
图8 重组海藻糖合酶工程菌高密度发酵走势图Fig.8 High density fermentation chart of recombinant trehalose synthase engineering
随着发酵时间的延长溶解氧迅速下降。发酵3h左右,溶解氧降至5%左右,此时调整转速,将转速由500r/min提高至600r/min后,溶解氧上升至25%左右,随后很快又下降,直至发酵4h后降至10%。由于实验条件有限无法通入纯氧来维持菌体生长的需要,因此在一定程度上影响了菌体的比生长率。
2.4.2 海藻糖合酶工程菌高密度发酵过程中细胞浓度与葡萄糖浓度的变化 如图9所示,细胞密度快速上升的同时发酵液中的葡萄糖浓度迅速下降,说明菌体生长过程对葡萄糖的利用很快。初始葡萄糖的添加浓度为2g/L,缩短了前期初始葡萄糖的耗尽时间,延长了补料时间,从而使得发酵液中的葡萄糖浓度始终处于一个较低水平(<1g/L),有效控制了乙酸的生成,延长了菌体对数生长期的时间。实验于发酵中后期(20h)加入1.0mmol/L的诱导剂进行诱导,诱导温度为37℃,时间为4h。
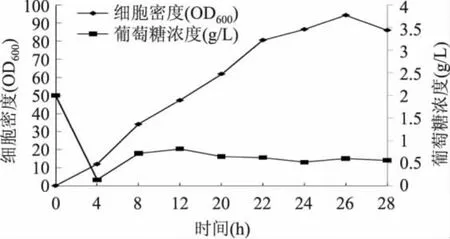
图9 10L高密度发酵过程中细胞密度与葡萄糖浓度的变化Fig.9 The cell density and glucose concentration changes of 10L high-density fermentation process
2.5 10L自控罐高密度发酵与常规发酵的比较
通过pH-stat法进行重组海藻糖合酶10L自控罐高密度发酵,并改进了发酵培养基和补料策略,最终获得的细胞密度达到LB摇瓶发酵的21倍,酶活为LB培养基摇瓶发酵的5.5倍。

表2 10L自控罐高密度发酵与常规发酵的细胞密度及酶活比较Table 2 The cell density and activity of 10L high cell density and conventional fermentation
2.6 质粒稳定性研究
通过考察不同时间段温度、pH、溶解氧及补料条件等因素对质粒稳定性的影响(见表3),结果发现发酵前期在温度、pH、压力恒定的条件下,溶解氧 >40%时,质粒稳定遗传达能到100%。发酵12h时,温度、pH、压力恒定的条件下,溶解氧降到10%左右,而通过补料,质粒稳定性仍能达到100%,发酵至24h后其他条件不变,而溶解氧<10%(已经持续10h),质粒稳定性能达到95%,证明重组海藻糖合酶菌株在高密度发酵过程中能正常遗传。
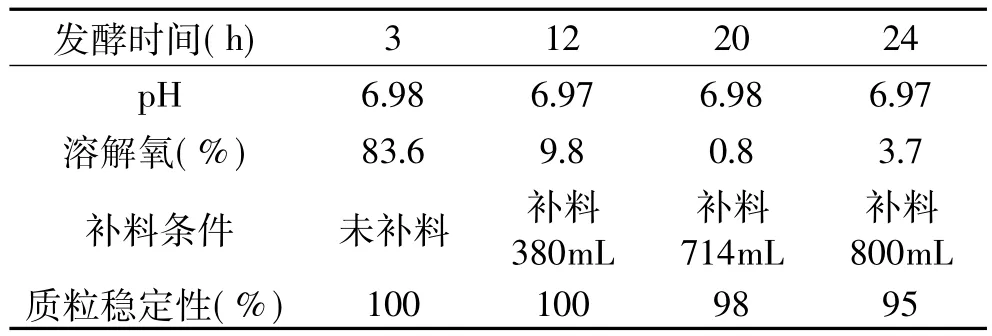
表3 重组海藻糖合酶工程菌质粒稳定性Table 3 Plasmid stability of recombinant trehalose synthase engineering
3 结论
3.1 海藻糖合酶工程菌高密度发酵条件的优化
本实验通过对已构建的海藻糖合酶基因工程菌进行摇瓶发酵条件的研究,确定了海藻糖合酶基因工程菌高密度发酵的最适培养基为2YT培养基,发酵初始葡萄糖浓度为0.2%,菌体生长最适pH为7.0,最佳发酵方式为分批补料法。
3.2 10L自控式发酵罐高密度发酵的研究
实验采用10L自控式发酵罐,装液量为4L,发酵温度为37℃,pH为7.0,通气量为7L/min,罐压为0.05MPa。通过pH-stat法控制加碱和定时补料,发酵过程中以15%氨水控制加碱,在初始葡萄糖耗尽后(发酵4h)定时补料,将发酵液pH维持在7.0左右,补料方式为连续流加,补料液的体积为总发酵液的20%,流速为 0.7mL/min,葡萄糖浓度维持在<1g/L,以减少副产物乙酸的生成,延长了工程菌对数期的生长时间,大大提高了菌体的发酵密度,最终得到的海藻糖合酶基因工程菌的细胞密度达到了50.78g/L。在发酵20h后加入浓度为1.0mmol/L的IPTG诱导、诱导温度为37℃、诱导时间为4h,得到的重组海藻糖合酶的酶活达到了3197U/L,为LB摇瓶发酵的5.5倍。
3.3 质粒稳定性
10L自控罐发酵过程中基因工程菌的质粒稳定性达到了95%以上,说明重组海藻糖合酶工程菌的质粒比较稳定,在高密度过程中可正常遗传。
[1]邵引刚,李峰,孙辉,等.海藻糖的应用及基因工程研究[J].安徽农业科学,2008,36(3):857-859.
[2]Nishimoto T,Nakano M,Bnakada T,et al.Purification and properties of a novel enzyme, trehalose synthase, from Pimelobacter sp.R48[J].Biosci Biotechnol Biochem,1995,60,640-644.
[3]Tsusaki K,Nishimoto T,Nakada T,et al.Cloning and sequencing of trehalose synthase gene from Thermus aquaticus ATCC 33923[J].Biochim Biophys Acta,1997,1334:28-32.
[4]Tsusaki K,Nishimoto T,Nakada T,et al.Cloning and sequencing of trehalose synthase gene from Pimelobacter sp.R48[J].Biochim Biophys Acta,1996,1290,1-3.
[5]McIntyre H J,Davies H,Hore T A,et al.Trehalose biosynthesis in Rhizobium leguminosa YUm bv.trifolii and its role in desiccation tolerance[J].Appl Environ Microbiol.2007,73:3984-3992.
[6]霍向东,石玉瑚.大肠杆菌高密度发酵补料调控策略的研究进展[J].新疆农业科学(专刊),2004,41:16-18.
[7]蒙健宗,陈发忠,王青艳,等.重组海藻糖合成酶工程菌的pH-stat高密度发酵工艺研究[J].食品工业科技,2006,27(8):125-128.
[8]南开大学,天津市林业果树研究所.红色亚栖热菌海藻糖合酶的核苷酸序列及其应用[P]:中国,200810052194.4,2008-1-29.
[9]Yueming Zhu,Jun Zhang,Dongsheng Wei,et al.Isolation and identification of a thermophilic strain producing trehalose synthase from geothermal water in China[J].Biosci Biotechnol Biochem,2008,72(8):2019-2024.
[10]喻国策,焦瑞身,王骥程,等 .大肠杆菌 E.coli HB101(pBR322)高密度培养过程质粒的稳定性[J].过程工程学报,2001,1(2):185-188.
High cell density fermentation condition of trehalose synthase genetic engineering bacteria
CHEN Ying1,YANG Li-wei1,QI Xin1,CHEN Xiao-yun1,LI Ming-chun2,TANG Liu1,ZHANG Jun1,*
(1.Tianjin Institute of Forest and Pomology,Tianjin 300112,China;2.Department of Microbiology,Nankai University,Tianjin 300071,China)
Object:To obtain the high dense fermentation procedure of trehalose synthase(Tres)genetic engineering bacteria previously construct.Methods:Studied the influence of medium,pH,ferment mode for incubation and induction on the growth of recombinant genetic engineering bacterial and expression of target protein in a 10L auto control biostat fermentator,and explored the genetic stability of recombinant plasmid.Result:The high-density culture medium of trehalose synthase genetic engineering bacteria was 2YT+0.2%glucose,the optimum pH was 7.0,the ferment mode was fed-batch.After the recombinant genetic engineering bacterial strain cultured in 10L high-density fermentation,the density of bacteria reached 50.78g/L,the enzyme activity reached 3.197U/mL.The constructed recombinant plasmid was inherited steadily in host bacteria.Conclusion:The high-density fermentation condition of trehalose synthase genetic engineering bacteria was optimized.It laid a foundation of large-scale production of trehalose.
trehalose synthase(Tres);genetic engineering bacteria;high-density fermentation
TS201.2
A
1002-0306(2012)17-0154-05
2012-02-22 *通讯联系人
陈颖(1977-),女,硕士,助理研究员,主要从事食品微生物和食品加工方面的研究。
天津市应用基础及前沿技术研究计划(10JCYBJC09600,10JCYBJC05000);国家自然科学基金(21076162)。
