响应面法优化胶质芽孢杆菌GM 1增殖发酵培养基
2012-10-25李东华
李东华,杨 博
(华南理工大学生物科学与工程学院,广东广州 510006)
响应面法优化胶质芽孢杆菌GM 1增殖发酵培养基
李东华,杨 博*
(华南理工大学生物科学与工程学院,广东广州 510006)
在摇瓶培养条件下,优化提高胶质芽孢杆菌GM1菌体浓度的发酵培养基组分。在单因素的基础上选择糖蜜、复合氮源(硫酸氨与豆粕)以及初始pH为自变量,芽孢杆菌数为响应值,根据Box-Behnken实验设计原理以及Design Expert 8.0软件进行回归分析,确定了胶质芽孢杆菌GM1发酵培养基的最佳组成为:糖蜜3.2%、复合氮源0.4%,pH为8.0,在此条件下最大理论数值为3.03×108CFU·mL-1。经过3次平行实验验证,实际活菌体数为3.09×108CFU·mL-1,该实验值与预测值拟合较好。优化后的活菌浓度与优化前菌体浓度相比提高了40%,由此可知,响应面分析法优化微生物发酵条件是一种十分有效的方法。
胶质芽孢杆菌,响应面法,菌体密度,优化
胶质芽孢杆菌(Bacillusmucilaginosus)是一种能分解硅酸盐矿物的细菌,国内一些学者也把它称为硅酸盐细菌[1]。除此之外胶质芽孢杆菌还具有解磷、解钾、固氮的作用,它不仅可以提高土壤中可溶性磷和钾的含量,而且还有促进植物生长、提高植物抗病性,以及改善土壤结构等作用,是良好的微生态肥料生产菌种[2-3],所以最近几年来对胶质芽孢杆菌在生物肥料领域中的应用研究越来越多。中国钾肥资源严重不足[4],国家每年需大量进口无机钾肥。开发利用微生态钾、磷肥不仅可以带来较好的经济效益,也能维护生态平衡。因此,对于工业化生产来说,如何降低投入成本、采用价格低廉且来源丰富的原材料作为胶质芽孢杆菌培养基具有重要的意义。本研究以前期实验为基础,采用单因素实验和响应面法[5-6]对发酵培养基组分进行了优化,这对有效地利用和促进菌株的生长具有重要的现实意义,可为生物菌肥的研制提供必要的理论依据。
1 材料与方法
1.1 材料与仪器
胶质芽孢杆菌(Bacillusmucilaginosus)GM1 由华南理工大学生物科学与工程学院筛选保存;斜面培养基 胶冻样芽孢杆菌琼脂培养基[7];种子液 蔗糖5g/L、NaHPO42g/L、MgSO40.5g/L、CaCO30.1g/L、FeCl35mg/L、pH 7.5~8.5,蒸馏水体积1000m L;单因素实验培养基 糖蜜1%~5%、复合氮源(硫酸氨∶豆粕=2∶1)0.2%~0.5%、K2HPO42g/L、MgSO41g/L、CaCO31g/L、FeCl35mg/L、pH7.5,蒸馏水体积1000m L。
PHS-3C型手持式pH计 上海伟业仪器厂;CP2245型电子天平感量0.0001g 德国Sartorius公司;DSHZ-300A型全温生化培养箱 太仓市实验设备公司;HJ-VD-650型超净工作台(SW-CJ) 上海净化;YXQ-SG46-280S型压力蒸汽灭菌锅 上海博迅;Labnet P3960型系列移液枪 美国。
1.2 实验方法
1.2.1 培养方法 斜面菌种34℃活化24h后接种一环至种子培养液(装液量50m L/250m L锥形瓶),34℃培养42h后以5%的接种量接入单因子实验及Box-Behnken实验培养基(50m L/250m L锥形瓶),34℃、200r/min培养42h。
1.2.2 活菌数的测定 活菌数的测定采用平板稀释法。
1.2.3 单因素实验 a.糖蜜浓度对活菌数的影响。目前研究[10]表明,糖蜜等复合碳源比其他碳源更有利于菌体的增殖。分别选择糖蜜浓度为1%、2%、3%、4%、5%,其他成分不变,摇瓶培养42h,观察活菌数的变化,以确定最佳糖蜜浓度。b.复合氮源(硫酸氨∶豆粕=2∶1)浓度对活菌数的影响。复合氮源更有利于菌体的增殖,且复合氮源中有机和无机氮源的添加比例是一个重要的影响因素[11]。分别选择氮源浓度为0.2%、0.3%、0.4%、0.5%、0.6%,其他成分不变,摇瓶培养42h,观察活菌数的变化以确定最佳氮源浓度。c.氮源比例(硫酸氨∶豆粕)对活菌数的影响。分别选择氮源比例[8]为1.5∶1、2.0∶1、2.5∶1、3.0∶1、3.5∶1、4.0∶1,氮源浓度为0.4%,其他成分不变,摇瓶培养42h,观察活菌数的变化以确定最佳氮源比例。d.初始pH对活菌数的影响。pH通过影响细胞膜的通透性、膜结构的稳定性以及酶促反应的稳定性等,从而影响微生物的生长速率[9]。分别调培养基初始pH为6.5、7.0、7.5、8.0、8.5,摇瓶培养42h,观察活菌数的变化以确定最佳pH。
1.2.4 响应面设计 根据单因素实验结果和Box-Behnken设计原理,选取对活菌数有较大影响的3个因素进行3因素3水平的响应面分析实验,因素水平编码见表1,并且利用统计分析软件Design-Expert 8.0进行实验设计和数据分析,以确定各因素对活菌数影响的显著性和发酵条件的最优组合。

表1 因素水平编码表Table 1 Factors and levels of response surface experiments
2 结果与分析
2.1 单因素实验结果
2.1.1 最佳糖蜜浓度的确定 由图1可知,当糖蜜浓度较低时,GM1活菌数随着糖蜜浓度的增大而增大,当糖蜜浓度为3%时活菌数达到最大值,之后随着糖蜜浓度的增大,活菌数略有下降。因此确定糖蜜最佳浓度为3%。且从作者以前做过的实验中可知,糖蜜浓度越高,发酵后pH越低,很有可能抑制GM 1的生长。

图1 糖蜜浓度对菌体密度的影响Fig.1 Influence of themolasses on the spore production ofGM1
2.1.2 最佳复合氮源浓度的确定 由图2可知,随着复合氮源浓度的增加,GM 1活菌数呈先上升后下降的趋势,当复合氮源浓度为0.4%时活菌数达到最大值,之后随着复合氮源浓度的增大,活菌数呈下降趋势。因此,确定复合氮源最佳浓度为0.4%。无机氮源比有机氮源更易被菌体直接吸收利用,促进菌体增殖,这可能是因为铵盐中的氮与细胞中的氮处于相同的氧化水平[9],而添加豆粕粉会在生长后期作为迟效氮源对菌体增殖产生明显的促进作用[10]。

图2 复合氮源浓度对菌体密度的影响Fig.2 Influence of the complex nitride on the spore production of GM1
2.1.3 最佳氮源比例的确定 由图3可知,随着无机氮与有机氮比例的增加,菌体密度逐渐增加,当比例为2∶1时,菌体密度达到最大值,说明此氮源比例的培养基最适宜微生物生长繁殖,这可能是因为菌体生长初期,其酶系还未建立完全,无机氮源更有利于菌体吸收利用;而当菌体酶系建立完善后,则分解并利用营养更为丰富的有机氮源[11]。

图3 氮源比例对菌体密度的影响Fig.3 Influence of complex nitride ratio on the spore production of GM1
2.1.4 最佳pH的确定 微生物生长过程中机体内发生的绝大多数的反应是酶促反应,而酶促反应都有一个最适pH范围,在此范围内只要条件适合,酶促反应速率最高,微生物生长速率最大。pH通过影响细胞膜的透性、膜结构的稳定性和物质的溶解性或电离性来影响营养物质的吸收,从而影响微生物的生长速率[9]。由图4可知,起始pH对细菌的生长有明显影响,随着pH的增加,GM 1活菌数也呈先升高后降低的趋势,在pH8.0时菌数达到最大值,故确定8.0作为最佳pH。实验表明偏碱性的条件更有利于胶质芽孢杆菌的生长繁殖。

图4 初始pH对菌体密度的影响Fig.4 Influence of pH value o on the spore production of GM1
2.2 响应面实验
依据单因素实验结果,选取糖蜜、复合氮源和初始pH三因素进行响应面法Box-Behnken模型实验设计,实验设计与数据分析见表2。

表2 响应面实验设计及结果Table 2 Results of response surface experiments
利用Design Expert 8.0软件对表2实验数据进行回归分析,得二次多元回归模型为:Y=3.00+0.0862X1+ 0.094X2-0.15X3+0.19X1X2+7.500E-003X1X3-0.038X2X3-0.21X12-0.97X22-0.39X32对所得模型进行方差分析,结果见表3。
由表3知,二次多项模型具有高度的显著性(pmodel<0.0001),说明二次回归模型是显著的,失拟项p=0.3190>0.05,没有显著意义,不必引入更高次项,模型适当,相关系数R2=0.9883,表明发酵GM 1活菌数的实测值与预测值之间具有较好的拟合度,可以应用于胶质芽孢杆菌发酵的理论预测。
初始pH的一次项和二次项,糖蜜浓度和复合氮源浓度的二次项对GM 1活菌数的影响达到极显著水平(p<0.01)。各因素对活菌数量的影响顺序为:X22>X32>X12>X3。

表3 回归模型的方差分析Table 3 Analysis results of regression and variance
2.3 各因素之间的交互作用
根据回归方程在考察的区域内利用Design Expert 8.0软件对以上3个因素绘制响应面图及等高线图(图5~图7),各图表示糖蜜浓度、复合氮源浓度、pH 3个因素中一个因素取零点时其余2个因素对芽孢数量的影响。
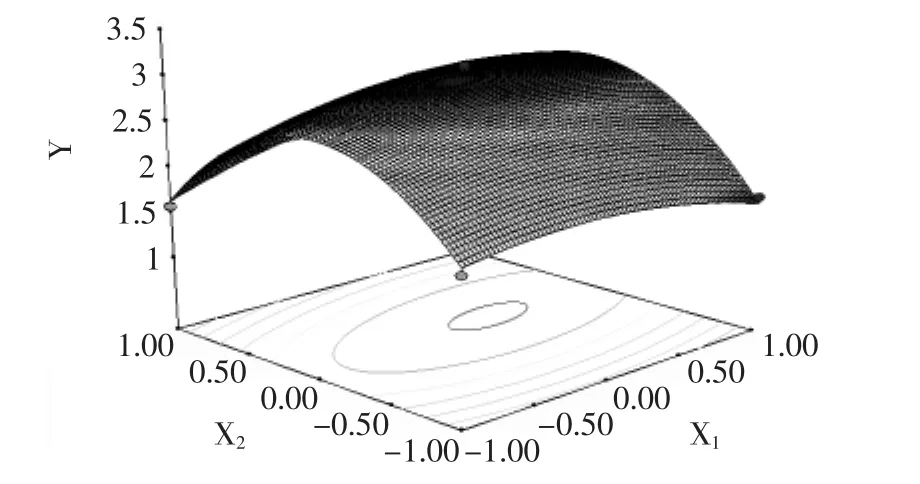
图5 糖蜜和复合氮源对GM1菌体密度影响的响应面图Fig.5 Response surface ofmolasses and complex nitride on the spore production of GM1

图6 复合氮源和初始对GM1菌体密度影响的响应面图Fig.6 Response surface of complex nitride and pH on the spore production of GM1

图7 糖蜜和初始pH对GM1菌体密度影响的响应面图Fig.7 Response surface of themolasses and pH on the spore production of GM1
由图5~图7可知,3个响应面均为开口向下的凸形曲面,说明响应值(活菌数)存在极高值。3个响应曲面的等高线中心均位于-1~1之间,说明设计的最优条件存在于所设计的因素水平范围之内。由图5~图7及软件分析可知,回归方程存在稳定点(0.24,0.08,-0.19),即当糖蜜浓度3.24%、复合氮源0.41%,pH为7.91时,该模型预测的GM 1活菌数为3.03×108CFU·m L-1,考虑到实际应用,选取条件为糖蜜3.2%、复合氮源0.4%,pH为8.0,在该条件下进行了验证实验,3次实验平均活菌数为3.09×108CFU·m L-1,与理论值相差2.01%。进一步说明该模型能较好地预测实际发酵情况。活菌体数比优化前(2.21×108CFU·m L-1)提高了40%,由此可知响应面分析法优化微生物发酵条件是一种十分有效的方法。
3 结论
本实验主要从发酵培养基原料易得,且成本低廉出发,用响应面法优化提高胶质芽孢杆菌发酵密度,适合用于大规模的工业化发酵生产生物肥料。通过对二次多项回归方程求解得知,最佳发酵培养基配方为:糖蜜3.24%、复合氮源0.41%,pH为7.91,在此条件下最大理论数值为3.03×108CFU·m L-1。经过3次平行实验验证,该模型是合理可靠的。优化后的GM 1活菌浓度与优化前菌体浓度相比提高了40%,进一步说明该模型能较好地预测实际发酵情况。在实际生产中,考虑到操作的方便性,可将培养基配方改为:糖蜜3.2%,复合氮源0.4%,pH为8.0。本实验对微生态制剂的研制具有一定的理论指导意义。
[l]周吉奎,胡岳华,邱冠周.硅酸盐细菌在矿物工程领域应用研究进展[J].金属矿山,2002(1):26-28.
[2]吴小琴.硅酸盐细菌的应用概况[J].江西科学,1977,15(1):60-66.
[3]Li X,Wu ZQ,LiW D,et al.Growth Promoting Effect of a Transgenic Bacillusmucilaginosus on Tobacco Planting[J].Appl Microbiol Biotechnol,2007,74(5):1120-1125.
[4]莱斯利·胡克.中国钾肥需求日增.http://www.ftchinese.com/ story/001034290.
[5]王永菲,王成国.响应面法的理论与应用[J].中国民族大学学报:自然科学版,2005,14(3):236-240.
[6]郝学财,余晓斌,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006,127(3):38-41.
[7]刘五星,徐旭士,杨启银,等.胶质芽孢杆菌发酵条件研究[J].南昌大学学报:理科版,2002,26(3):299-302.
[8]贺积强,李登煜,张小平,等.硅酸盐细菌的研究进展[J].西南农业学报,1999,12(1):102-107.
[9]曾晓希,周洪波,柳建设,等.脱硅细菌B.mucilaginosus Lv1-2的培养条件研究[J].现代生物医学进展,2006,6(9):57.
[10]吴向华,刘五星.胶冻样芽孢杆菌培养条件及发酵工艺的优化[J].江苏农业科学,2006(4):155-158.
[11]赵志浩,徐银荣,邱龙.胶质芽胞杆菌的发酵工艺研究和田间应用[J].湖南农业科学,2004(5):34-37.
App lication of response surface methodology to optim ize the spore production of B.mucilaginosus GM 1
LIDong-hua,YANG Bo*
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
Using shaking-flask fermentation in the laboratory to op tim ize the com ponents of GM 1 fermentation medium.On the basis of sing le experiments and accord ing to the Box-Behnken experimental design p rincip les,the response surface methodology was app lied to op tim ize the three major fac tors for GM1 liquidstate fermentation.By solving the quad ratic reg ressionmodelequation,the op timal values of the variab les were determ ined as:the molasses 3.24%,com p lex nitride 0.41%,pH7.91.Then the largest number of bacteria p redic ted by the theoretical model was 3.0293×108CFU·m L-1.With the op timum medium,the live bacteria number was 3.09×108CFU·m L-1,which increased nearly more than 40%contrasting on the initial culture medium.On the conc lusion that response surface methodology was an availab le way to op tim ize the fermentation conditions.
Bacillus mucilaginosus;response surface method;colony-form ing units;op tim ization
TS201.3
B
1002-0306(2012)22-0206-04
2012-06-12 *通讯联系人
李东华(1986-),男,硕士,主要从事发酵工程、微生态制剂方面的研究。
